活性氧(ROS)诱导氧化反应能导致衰老并引发多种疾病,如心血管疾病、糖尿病、帕金森病、癌症等[1,2]。目前国内外大多使用人工合成的抗氧化剂来清除机体中过量的氧自由基,如2,6-二叔丁基-4-甲基苯酚(BHT)、丁基羟基茴香醚(BHA)等,这些抗氧化剂抗氧化能力较强,但具有潜在的毒性和致癌作用,现已被多个国家禁用[3,4],因而开发天然抗氧化剂日益受到重视。中药以其丰富的资源、高效的抗氧化活性、副作用小、毒性低等优点成为人们寻找天然抗氧化剂的重要资源[5]。
目前,中药抗氧化剂的筛选主要利用体外试管法,即通过测定样品抑制脂质类物质氧化的能力和对自由基的清除能力来评价待测样品的抗氧化活性,此法简便、快速,但体外测试与生物体内的抗氧化作用存在着差异性[6]。中药的体内抗氧化活性研究模式生物主要有鸡、小鼠等[7,8]。由于其成本较高、周期长、劳动量大,因而中药的大量筛选受到了一定的局限。果蝇作为重要模式生物,具有生长周期短、繁殖能力强、成本低等优点,且与人类在生长发育、神经退化、肿瘤形成等方面有很多相似之处[9,10],故可利用果蝇大量筛选具有抗氧化活性的中药。
百草枯(Paraquat)与氧气反应产生的超氧阴离子在超氧化物歧化酶(SOD)的催化下产生H2O2,H2O2在Fe2+的催化下分解为羟自由基,因此百草枯和H2O2可通过提高体内ROS水平引起氧化应激反应[11,12]。本实验通过喂食果蝇百草枯和H2O2后,统计果蝇生存率的方法,从50种中药提取物中筛选出具有缓解氧化应激损伤作用的4种中药提取物(瓜蒌、红花、川芎和菊花提取物)。通过分析果蝇寿命、肠道干细胞和成肠细胞数量等,探索4种中药提取物对果蝇肠道氧化应激损伤的影响,为天然抗氧化剂开发和利用提供理论基础。
1 材料 1.1 药材与试剂50种中药购自哈尔滨人民同泰药店,由东北林业大学生命科学学院王秀华教授鉴定,鉴定结果见表 1。百草枯(Paraquat,批号STBB4829V)和H2O2(批号014K3646)购自Sigma公司;其他试剂均为分析纯。
|
|
表 1 50种供试中药及药用部位 Table 1 Names and their medicinal parts of 50 kinds of CMM |
野生型W1118品系黑腹果蝇Drosophila melanogaster Meigen为本实验室保存,esgGal4 UAS-GFP品系果蝇由北京大学袭荣文教授提供。果蝇培养温度为25 ℃、相对湿度60%。
1.3 仪器ALC—210.4型电子分析天平,北京赛多利斯公司;Elix5去离子水系统,Millipore公司;SZ51型显微镜,日本Olympus公司;Axioskop 2 plus型荧光显微镜,Zeiss公司。
2 方法 2.1 中药水提液的制备50种中药各称取20 g,加入200 mL(或400 mL)去离子水浸泡12 h,中火熬制3 h,滤过,滤渣再加入200 mL去离子水用同样的方法提取1次,合并2次滤液浓缩至100 mL,即得到质量浓度为0.2 g/mL(20%)的中药水提液,置-40 ℃保存备用。
2.2 果蝇培养基的配制对照组培养基(正常培养基):配制方法参考文献方法[13];实验组培养基(中药提取物培养基):加入与对照组去离子水等体积的中药提取液,培养基中各中药提取物的质量分数(以生药计):百部和苦参为1.25%;防己和川牛膝为2.5%;肉桂为5%;其他中药提取物均为10%。
2.3 果蝇生存率实验随机收集对照组和实验组羽化3~5 d的果蝇,雌雄各15只。果蝇饥饿处理2 h后转移到放有5张滤纸的果蝇管中,向滤纸中加入6 mmol/L百草枯或1% H2O2溶液(含5%蔗糖),使滤纸充分湿润,每24小时更换1次滤纸并记录果蝇死亡数,共记录6 d,每组重复3次。
2.4 果蝇寿命实验随机收集对照组和实验组羽化4d的果蝇。雌雄分开,每组各30只。每2天更换1次培养基,每天定时统计果蝇死亡数,直至全部死亡。每组重复4次。
2.5 果蝇肠道干细胞和成肠细胞计数羽化4~5 d的esgGal4 UAS-GFP品系雌果蝇喂食含5%蔗糖的百草枯(10 mmol/L)溶液16 h或羽化4 d的雌果蝇培养30 d后,显微镜下提取10~12条果蝇肠道于多聚甲醛中,常温固定30 min,DAPI染色10 min,甘油封片后荧光显微镜下观察并拍照,每组重复3次。
2.6 统计学处理采用Prism软件进行统计学分析,组间差异采用单因素方差分析。
3 结果 3.1 缓解果蝇氧化应激损伤的中药提取物的筛选结果本实验用百草枯或H2O2喂食果蝇,通过比较对照组和实验组果蝇的生存率来筛选具有缓解氧化应激损伤作用的中药提取物。结果表明,成体果蝇经百草枯处理6 d后,在50种中药提取物实验组中果蝇生存率比对照组生存率大于50%的有大黄、前胡、瓜蒌、党参、川楝子、红花、炙百合、川芎、菊花,共9种中药提取物(图 1-A)。另外,H2O2处理6 d后,实验组生存率是对照组2倍以上的有瓜蒌、木香、丹参、苏木、鸡血藤、草豆蔻、红花、川芎、菊花和骨碎补(图 1-B)。其中,无论喂食百草枯还是H2O2均能显著提高果蝇生存率的为瓜蒌、红花、川芎和菊花提取物。
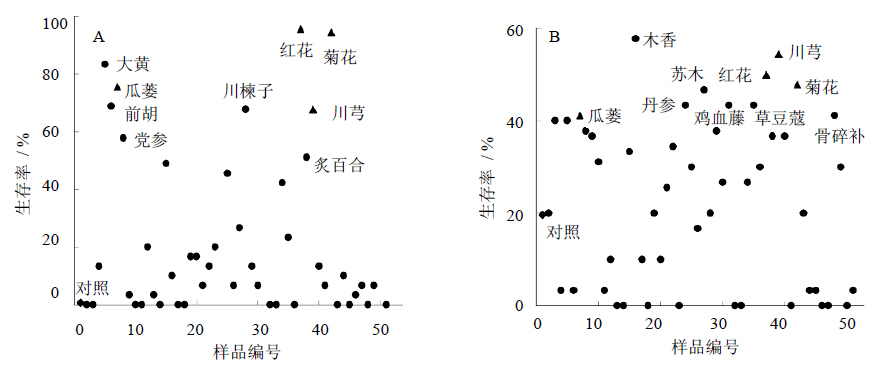 | 图 1 50种中药提取物对百草枯(A) 和H2O2 (B) 诱导氧化应激损伤果蝇生存率的影响 Fig. 1 Effectsof extracts from 50 kinds of CMM on oxidative-stress damage of D. melanogaster induced with Paraquat (A) and H2O2 (B) |
为了验证筛选出的4种中药提取物的抗氧化作用,分别喂食百草枯或H2O2,每组实验重复3次,其结果与筛选时得到的生存率相似。在喂食百草枯第6天,对照组生存率降到1.1%,而实验组(瓜蒌、红花、川芎和菊花)的生存率分别为75.5%、95.6%、67.7%和94.4%,与对照组相比分别提高了74.4%、94.5%、66.6%和93.3%(P<0.01、0.001,图 2-A和表 2)。另外,H2O2处理果蝇6 d后,对照组的生存率为16.7%,实验组(瓜蒌、红花、川芎和菊花)的生存率分别为41.1%、50%、54.4%和47.8%,比对照组分别提高了1.4、1.99、2.2和1.8倍(P<0.01、0.001,图 2-B和表 3)。这表明瓜蒌、红花、川芎和菊花提取物可缓解百草枯或H2O2诱导的氧化应激损伤,显著提高果蝇的生存率。
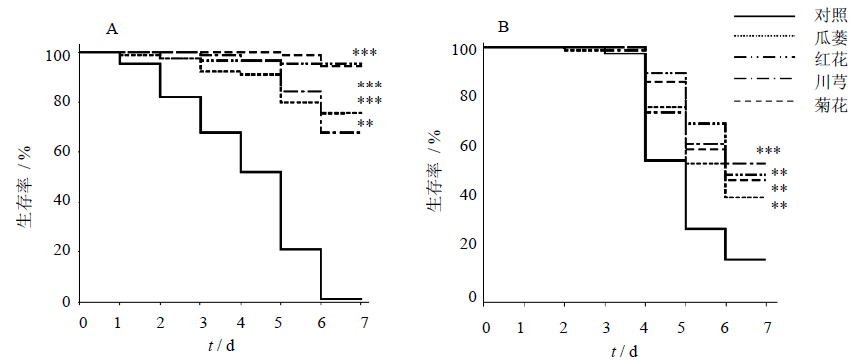 | 与对照组比较:**P<0.01 ***P<0.001,下同 **P < 0.01 ***P < 0.001 vs control group,same as below图 2 瓜蒌、红花、川芎和菊花提取物对百草枯 (A) 和H2O2 (B) 处理后果蝇生存率的影响 Fig. 2 Effectsof extracts from Trichosathis Fructus,Carthami Flos,Chuanxiong Rhizoma,and Chrysanthemi Flos on survival rate of D. melanogaster induced with Paraquat (A) and H2O2 (B) |
|
|
表 2 4种中药提取物缓解百草枯处理后果蝇的生存率 (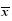 ±s,n=3)
Table 2 Relief of extracts from four kinds of CMM on survival rate of D. melanogaster after treated with Paraquat ( ±s,n=3)
Table 2 Relief of extracts from four kinds of CMM on survival rate of D. melanogaster after treated with Paraquat (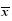 ±s,n=3) ±s,n=3)
|
|
|
表 3 4种中药提取物缓解H2O2处理后果蝇的生存率 (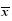 ±s,n=3)
Table 3 Relief of extracts from four kinds of CMM on survival rate of D. melanogaster after treated with H2O2 ( ±s,n=3)
Table 3 Relief of extracts from four kinds of CMM on survival rate of D. melanogaster after treated with H2O2 (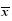 ±s,n=3) ±s,n=3)
|
正常生理条件下,机体抗氧化防御体系能保证细胞内ROS水平处于一个稳定状态,然而当机体受某些外源性物质入侵时,可能导致机体自由基代谢平衡失调、抗氧化体系紊乱等[14]。其中,ROS的过量产生会破坏线粒体中的DNA、蛋白及脂质分子,造成线粒体功能紊乱,进而引起机体衰老[15]。为了进一步探索瓜蒌、红花、川芎和菊花提取物对氧化应激损伤的缓解作用,分析了4种中药对果蝇寿命的影响。与对照组相比,瓜蒌提取物能够延长雌、雄果蝇寿命约2 d;红花提取物能延长雌果蝇寿命约5 d,但对雄果蝇寿命影响不显著;川芎提取物能延长雌果蝇寿命约4 d,但对雄果蝇寿命影响不显著;菊花提取物对果蝇寿命没有明显影响,见表 4。
|
|
表 4 4种中药提取物对果蝇寿命的影响 (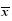 ±s,n=120)
Table 4 Effectsof extracts from four kinds of CMM on lifespan of D. Melanogaster ( ±s,n=120)
Table 4 Effectsof extracts from four kinds of CMM on lifespan of D. Melanogaster (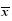 ±s,n=120) ±s,n=120)
|
果蝇喂食百草枯后可诱导肠道干细胞增殖,使得肠道上皮细胞中的肠道干细胞和成肠细胞数量显著增加[16],通过这些细胞的再生来修复由百草枯引起的肠道上皮细胞损伤。但肠道干细胞过度增殖会导致肠道中未分化的成肠细胞大量积累,破坏肠道稳态,进而对机体产生不利影响[17]。为了分析瓜蒌、红花、川芎和菊花提取物对果蝇肠道干细胞增殖及分化的影响,利用自身携带绿色荧光蛋白报告基因的esgGal4 UAS-GFP品系果蝇分析了果蝇肠道干细胞和成肠细胞的增殖。结果表明,百草枯处理后,喂食瓜蒌、红花、川芎和菊花的实验组果蝇中GFP阳性细胞(肠道干细胞和成肠细胞)数量均显著低于对照组,与对照组相比分别减少了47.1%、38.6%、31.3%和13.8%(P<0.01、0.001),见图 3。
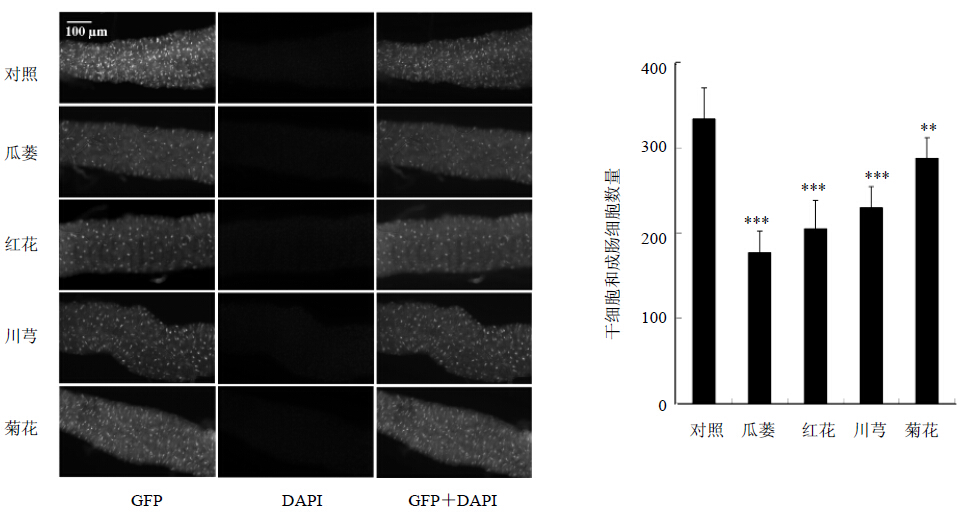 | 图 3 4种中药提取物对百草枯处理后果蝇肠道干细胞和成肠细胞数量的影响 (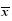 ±s,n=3)
Fig. 3 Effectsof extracts from four kinds of CMM on changes of numbers of ISC and EB in adult midgut of D. melanogaster after treated with Paraquat ( ±s,n=3)
Fig. 3 Effectsof extracts from four kinds of CMM on changes of numbers of ISC and EB in adult midgut of D. melanogaster after treated with Paraquat (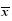 ±s,n=3) ±s,n=3)
|
成体果蝇中肠由肠道干细胞、成肠细胞、肠上皮细胞及内分泌细胞构成。随着果蝇年龄增长,老化的果蝇由于肠道干细胞过度增殖和错误分化使肠道上皮细胞退化,导致肠道发育异常和死亡率增加[17]。所以本实验进一步分析了4种中药提取物对老化果蝇肠道上皮细胞的影响。结果表明,喂食瓜蒌、红花、川芎和菊花的实验组GFP阳性细胞(肠道干细胞和成肠细胞)数量与对照组相比分别减少了30.2%、28.6%、41.9%和21.2%(P<0.001),见图 4。
 | 图 4 4种中药提取物对老化果蝇肠道干细胞和成肠细胞数量的影响 Fig. 4 Effects of extracts from four kinds of CMM on numbers of ISC and EB within adult midgut of D. melanogaster |
中药具有抗炎、抗氧化、抗肿瘤、抗病毒以及提高机体免疫力等作用[18,19]。果蝇作为重要的模式生物,其肠道结构、细胞构成及干细胞参与的信号转导途径与哺乳动物有很多相似之处[20]。所以,可以利用模式生物果蝇来研究调节肠道免疫相关的中药[21]。为了筛选具有抗氧化活性的中药,本研究建立果蝇氧化应激损伤模型,通过统计果蝇的生存率,从50种中药中筛选出具有缓解氧化应激损伤作用的中药。再通过分析果蝇寿命、肠道干细胞和
成肠细胞数量变化等来探讨中药的免疫调节功能。结果表明,在所筛选的50种中药中,瓜蒌、红花、川芎和菊花具有比较显著的缓解氧化应激损伤作用。主要表现在瓜蒌、红花、川芎和菊花提取物可以明显地提高百草枯和H2O2诱导后果蝇的生存率;其中,瓜蒌、红花和川芎能减少老化及百草枯诱导的肠道干细胞和成肠细胞数量,这可能是由于中药含有的抗氧化剂减少了机体自由基的产生[22,23,24],通过降低体内ROS水平,达到缓解氧化应激损伤、延缓机体衰老的作用。果蝇在中药培养基里生长状态与正常培养基相同,而且只喂食5%蔗糖和中药提取物时果蝇6 d内的生存率没有发生变化,这说明蔗糖和中药提取物对果蝇不造成任何损伤。研究发现菊花可提高小鼠体内抗氧化酶活力来抑制D-半乳糖所致脂质过氧化进而延缓机体衰老[25],具有抗氧化性。实验结果显示菊花虽然提高了百草枯和H2O2诱导后果蝇的生存率、减少了老化和百草枯诱导的肠道干细胞和成肠细胞数量,但对果蝇寿命没有明显作用。这是因为衰老是一个十分复杂的过程,线粒体氧化应激损伤只是衰老的主要原因,并不是唯一原因[15]。所以菊花可能不仅仅通过提高机体抗氧化酶活性来缓解老化,还可能通过其他途径。
综上所述,瓜蒌、红花、川芎和菊花可提高果蝇的肠道免疫功能、缓解氧化应激引起的损伤和延长寿命等,本研究为抗氧化活性中药的筛选提供借鉴,为中药的开发与利用提供新思路。
| [1] | Ji X Y, Tan B K, Zhu Y C, et al. Comparison of cardioprotective effects using ramipril and DanShen for the treatment of acute myocardial infarction in rats [J]. Life Sci, 2003, 73(11): 1413-1426. |
| [2] | 吴 青, 黄 娟, 罗兰欣, 等. 15种中草药提取物抗氧化活性的研究 [J]. 中国食品学报, 2006, 6(1): 284-288. |
| [3] | 任兴权. 食用植物油中抗氧化剂丁基羟基茴香醚 (BHA) 和2, 6-二叔丁基-4-甲基苯酚 (BHT) 的检测 [D]. 兰州: 兰州大学, 2013. |
| [4] | 成喜雨, 崔 馨, 刘春朝, 等. 中草药抗氧化活性研究进展 [J]. 天然产物研究与开发, 2006, 18(3): 514-518. |
| [5] | 王忠雷, 杨丽燕, 张小华, 等. 天然产物抗氧化活性成分研究进展 [J]. 药物评价研究, 2012, 35(5): 386-390. |
| [6] | 王晓宇, 杜国荣, 李 华. 抗氧化能力的体外测定方法研究进展 [J]. 食品与生物技术学报, 2012, 31(3): 247-252. |
| [7] | 赵 云, 单安山, 郭晓秋. 五味子乙醇提取物对肉仔鸡抗氧化功能和血液生化指标的影响 [J]. 安徽农业科学, 2012, 40(9): 5268-5270. |
| [8] | 高德富, 刘晓蕙, 樊剑鸣, 等. 黄芪提取物对小鼠生长性能、抗氧化及免疫功能的影响 [J]. 航空航天医学杂志, 2011, 22(2): 144-147. |
| [9] | Saunders R D, Boubriak I, Clancy D J, et al. Identification and characterization of a Drosophila ortholog of WRN exonuclease that is required to maintain genome integrity [J]. Aging Cell, 2008, 7(3): 418-425. |
| [10] | Brumby A M, Richardson H E. Using Drosophila melanogaster to map human cancer pathways [J]. Nat Rev Cancer, 2005, 5(8): 626-639. |
| [11] | Bus J S, Gibson J E. Paraquat: model for oxidant-initiated toxicity [J]. Environ Health Perspect, 1984, 55: 37-46. |
| [12] | Valko M, Rhodes C J, Moncol J, et al. Free radicals, metals and antioxidants in oxidative stress-induced cancer [J]. Chemico-Biological Interact, 2006, 160(1): 1-40. |
| [13] | 李文佳, 刘 强, 金丽华. 刺五加提取物对果蝇免疫功能的影响 [J]. 中草药, 2012, 43(10): 1997-2001. |
| [14] | 李建喜, 杨志强, 王学智. 活性氧自由基在动物机体内的生物学作用 [J]. 动物医学进展, 2006, 27(10): 33-36. |
| [15] | Sastre J, Pallardo F V, Vina J. The role of mitochondrial oxidative stress in aging [J]. Free Radical Biol Med, 2003, 35(1): 1-8. |
| [16] | Choi N H, Kim J G, Yang J D, et al. Age-related changes in Drosophila midgut are associated with PVF2, a PDGF/VEGF-like growth factor [J]. Aging Cell, 2008, 7(3): 318-334. |
| [17] | Biteau B, Hochmuth C E, Jasper H. JNK activity in somatic stem cells causes loss of tissue homeostasis in the aging Drosophila gut [J]. Cell Stem, 2008, 3(4): 442-455. |
| [18] | 李淑红, 王京仁, 成 钢, 等. 四种中草药对小鼠抗炎作用比较研究 [J]. 湖北农业科学, 2013, 52(4): 892-894. |
| [19] | 韩立丽, 王建发, 王凤龙, 等. 黄芪多糖对肠道免疫功能影响的研究进展 [J]. 中国畜牧兽医, 2009, 36(8): 133-135. |
| [20] | Wilson A A, Kotton D N. Another notch in stem cell biology: Drosophila intestinal stem cells and the specification of cell fates [J]. Bioessays, 2008, 30(2): 107-109. |
| [21] | 左占广, 朱彩霞, 鲁东立, 等. 红景天提高黑腹果蝇肠道免疫功能研究 [J]. 中草药, 2014, 45(5): 691-694. |
| [22] | 冯 涛, 阎婷婷, 阎国荣, 等. 红花提取物清除自由基能力的初步研究 [J]. 天津农学院学报, 2010, 17(1): 6-9. |
| [23] | 秦海燕, 王永胜, 索志荣. 川芎醇提物的体外抗氧化活性 [J]. 西南科技大学学报, 2010, 25(3): 19-21. |
| [24] | 孙 娟, 赵启韬, 黄臻辉, 等. 瓜蒌皮对急性心肌缺血大鼠的保护作用 [J]. 中药药理与临床, 2013, 29(3): 114-116. |
| [25] | 林久茂, 庄秀华, 王瑞国. 菊花对D-半乳糖衰老抗氧化作用 [J]. 福建中医药, 2002, 33(5): 44. |
 2014, Vol. 45
2014, Vol. 45


