反式肉桂酸(桂皮酸,trans-cinnamic acid,TCA)是樟科植物肉桂Cinnamomum cassia Presl的主要化学成分之一,具有抗菌、升白细胞、利胆和抗癌作用,体外可抑制黑色素瘤及肝癌细胞增殖和促进其分化,可间接结合于DNA上调控某些基因的表达,阻断肿瘤细胞的生长增殖且无胚胎毒性表现,临床用于治疗结核病[1]。TCA具有显著的抗氧化功效,作为一种天然口服的抗氧化剂,可清除机体的氧自由基,防止其攻击细胞膜、损伤细胞,具有延缓衰老,提高免疫力功效[2]。但是由于TCA水溶性差,口服生物利用度低,使其应用受到了限制。
为了提高难溶性药物的生物利用度,可以通过制备颗粒小、粒度分布均匀的微粉来解决,超细化是提高难溶药物生物利用度的一种有效途径[3]。药物微粉化技术主要包括球磨法、气流粉碎法、超临界流体技术和沉淀法等。机械粉碎法是目前广泛使用的药物微粉化方法,但机械粉碎法能耗大、效率低,并且产品粒度分布较宽[4,5,6]。采用超临界流体技术制备微粉存在着设备投资大、收率低及难以工业化等缺点[7,8,9,10]。
反溶剂重结晶法[11,12,13,14,15]是通过加入药物的不良溶剂改变其饱和溶解度而使药物颗粒重新结晶析出的过程,是制备微粉化药物的一种重要方法。与传统药物微粉化技术相比较,具有成本低、易操作及易工业化等优点而显现出良好的应用前景。目前,通过该方法已成功制备得到了多种难溶性口服药物[16,17,18,19]。本实验采用反溶剂重结晶法制备TCA超微细颗粒,主要改善TCA的水溶性、提高生物利用度和口服抗氧化力,通过单因素优化的方法得到分散性较好、粒度分布均匀的TCA超微细颗粒。原药和微粉的表征通过透射电镜(TEM)、激光粒度分析方法、傅里叶变换红外光谱(FTIR)、质谱(LC-MS)、X射线衍射(XRD)、差示扫描的CAL-orimetr Y(DSC)进行分析。通过HPLC测定TCA微粉的溶解度、溶出速率、质量分数。
1 仪器与材料78HW—1数显恒温磁力搅拌器,杭州仪表电机有限公司;美国布克海文高分辨率Zeta电位及粒度分析仪Zeta PALS;BS—110型电子分析天平,德国Sartorius公司;Quanta—200型扫描电镜(SEM),美国FEI公司;美国Nieolet公司出品的8700型傅里叶红外光谱仪;有机微孔滤膜(0.45 μm),上海新亚净化器件。
TCA,分子式为C9H8O2,相对分子质量为148.16,质量分数为≥99%,批号为C6004-100G,由美国西格玛奥德里奇公司提供;无水乙醇,由天津市天力化学试剂有限公司提供;去离子水为实验室自制;羟丙基甲基纤维素(HPMC),由阿拉丁试剂有限公司提供;聚山梨酯80,天津博迪化工有限公司;胃蛋白酶,国药集团化学试剂有限公司;乙腈为色谱级,其他试剂为分析纯。
2 方法与结果 2.1 反溶剂重结晶过程通过溶解度实验,选取乙醇作为溶剂、去离子水为反溶剂进行TCA的超微粉制备。将一定质量浓度的TCA乙醇溶液加入带有控温水浴的烧杯中,在数显恒温磁力搅拌器下控制搅拌速度,待温度稳定在预设值后,将一定体积的反溶剂一次性加入到TCA乙醇溶液中,瞬间形成乳白色的混悬液,达到预定沉积时间后,取1 mL混悬液用相同体积比的溶剂与反溶剂混合液稀释3倍,置于激光粒度仪中检测颗粒大小。同时将剩余混悬液用孔径为0.22 μm的有机微孔滤膜滤过,并用去离子水清洗3次以除去残留的乙醇。滤饼用水复溶,在-40 ℃的冰箱中预冻12 h,再置于冻干机器冻干48 h,即得到TCA微粉。
2.2 单因素优化通过预试验,本研究筛选5个对TCA微粉粒径影响较大的因素进行单因素试验,分别是药物质量浓度、溶剂与反溶剂比、沉积时间、表面活性剂用量、搅拌强度。以上各因素的水平设定如下:药物质量浓度(30、50、100、150、170 mg/mL);溶剂与反溶剂比分别为(1∶1、1∶2、1∶4、1∶6、1∶8);沉积时间(3、5、10、20、30 min);表面活性剂量(0.1%、0.2%、0.3%、0.4%、0.5%);搅拌强度(500、1 000、1 500、2 000、2 500 r/min)。按照沉积时间、药物质量浓度、溶剂与反溶剂比、表面活性剂用量和搅拌强度先后顺序逐渐考察各因素对TCA微粉粒径影响,每个因素的最优水平基于粒径最小原则进行选取。每个因素重复3次。
2.2.1 沉积时间对TCA粒径的影响在药物质量浓度、溶剂与反溶剂体积比、表面活性剂HPMC用量和搅拌强度分别为100 mg/mL、1∶4、0.3%、1 000 r/min的反应条件下,得到TCA纳米混悬剂的粒径。沉积时间为3、5、10、20、30 min时考察TCA-乙醇溶液的粒径大小,粒径分别为(187.5±0.9)、(216.2±1.6)、(171.8±1.5)、(171.1±1.2)、(160.2±1.8)nm。从以上数据可以看出,随着时间的变化,药物的平均粒径逐渐趋于平稳,当沉积时间达到30 min时,药物的平均粒径和10 min时相比,并无大的变化,考虑到最佳的时间条件,选用10 min作为制备药物的最佳沉积时间。0~5 min,由于微粉的制备过程是将反溶剂添加到溶剂中,整个混悬液的过饱和度逐渐变大,所以在0~5 min粒径会比较大,5~30 min,随着搅拌时间的加长,混悬液趋于稳定,过饱和度也增大到最大值,并且维持不变,从而导致粒径有所减小,并且最终维持不变。
2.2.2 药物质量浓度对TCA粒径的影响TCA-乙醇溶液质量浓度对颗粒的大小有很重要的影响。在10 min和1 000 r/min的反应条件下,将0.3%的HPMC水溶液按1∶4的体积比分别加入到质量浓度为30、50、100、150、170 mg/mL的TCA-乙醇溶液中,所得浆料颗粒粒径分别为(261.3±1.3)、(196.9±3.6)、(152.1±2.4)、(110.9±1.8)、(105.4±2.6)nm。采用30 mg/mL的质量浓度时,由于颗粒析出速度非常快,容易发生球状颗粒团聚现象,且产品粒度较大;当TCA-乙醇溶液的质量浓度增加到170 mg/mL时,析出沉淀较快,得到的TCA平均粒径较小,这说明药物质量浓度越高,在其他因素不变的情况下,过饱和度越大,粒径越小。由此可以看出随着质量浓度的增大,TCA-乙醇溶液呈现粒径逐渐减小的趋势,所以质量浓度定为170 mg/mL。
2.2.3 溶剂与反溶剂比对TCA粒径的影响在沉积时间为10 min,0.3% HPMC,搅拌转速为1 000 r/min下将反溶剂加入到质量浓度为170 mg/mL的TCA-乙醇溶液中,考察体积比对结晶过程的影响。实验采用1∶1、1∶2、1∶4、1∶6、1∶8体积比,结果颗粒粒径分别为(220.2±1.6)、(102.8±2.6)、(111.7±1.4)、(170.5±1.5)、(165.7±2.3)nm。从以上结果可以看出,当溶液反溶剂的体积比为1∶2时,平均粒径达到最小值,同时粒度分布均匀,但是此时的得率并不是最高,考虑到得率的问题,体积比为1∶4时,得率为94.12%,所以本实验选用1∶4作为最佳的体积比。
2.2.4 表面活性剂HPMC用量对TCA粒径的影响HPMC的用量对药物的平均粒径并无太大的影响。在10 min的沉积时间下,按照1∶4的体积比,把质量浓度为170 mg/mL的TCA-乙醇溶液加入到质量分数分别为0.1%、0.2%、0.3%、0.4%、0.5%的HPMC水溶液中,结果颗粒粒径分别为(112.4±0.8)、(136.2±0.5)、(91.17±0.3)、(105.9±0.4)、(119.7±0.6)nm,当HPMC质量分数为0.3%时,药物的平均粒径达到最小值。在将表面活性剂用量控制在0.1%~0.5%时,表面活性剂用量不是影响药物的粒径大小关键因素,但是加入表面活性剂可以得到分布均匀、形状规则的TCA微粉混悬液。
2.2.5 搅拌强度对TCA粒径的影响实验结果表明随着搅拌速度的增加,TCA-乙醇溶液的平均粒径逐渐减小,这说明搅拌强度对TCA-乙醇溶液的平均粒径影响很大。沉积时间为10 min,按1∶4的体积比,0.3% HPMC,将质量浓度为170 mg/mL的TCA-乙醇溶液加入水中,分别进行500、1 000、1 500、2 000、2 500 r/min 5个梯度的搅拌速度实验,结果颗粒粒径分别为(170.1±3.6)、(115.6±1.9)、(107.7±0.4)、(100.1±1.5)、(92.4±3.3)nm,结果搅拌转速为2 500 r/min时药物的平均粒径最小,可见随着搅拌转速的增大,产物颗粒尺寸逐渐减小,高搅拌转速下制备的颗粒要比低搅拌转速下所得颗粒小,并且粒度分布更窄,颗粒更加均匀。高速搅拌强化了液相间的微观混合效果,使溶液混合更加均匀,促使晶核快速生成,利于颗粒均匀生长,从而能够得到粒度分布较好的TCA微粉,因此选择搅拌转速在2 500 r/min。
2.2.6 最优化研究基于以上单因素试验,确定TCA反溶剂重结晶的最佳条件:沉积时间为10 min,TCA质量浓度为170 mg/mL,溶剂反溶剂体积比为1∶4,表面活性剂HPMC质量分数为0.3%,搅拌强度为2 500 r/min,在此条件下进行3次验证实验,所得微粉化TCA的粒径为130 nm。后续研究中的微粉化TCA均是该条件下制备所得。
2.3 TCA微粉表征 2.3.1 形态和粒径分析使用SEM检测原药的形貌粒径,将TCA原药直接放在铝盘表面的碳条上,检测之前用溅射镀膜机喷金4 min,制备好的样品用SEM(Quanta200,FEI,The Netherlands)进行检测。随机选择30个颗粒进行粒径检测,取其平均数则为原药的平均粒径。
使用TEM H—7650透射电子显微镜检测TCA微粉颗粒的形态。将得到的TCA混悬液8 μL直接滴在碳包覆的铜栅上,并在室温下干燥,采用TEM测定其形貌。微粉化TCA的粒径通过激光粒度仪进行测定,取3 mL纳米混悬液,样品用去离子水稀释到适当浓度放在比色皿内,于室温下采用Brookhaven公司的Zeta PALS型激光粒度仪进行检测。图 1-A展示了TCA原药的扫描电子显微镜图片,从图片上可以看出TCA原药的粒子是粒径为5~50 μm的长方体结构晶体。在图 1-B中显示,最优条件下通过反溶剂重结晶制备的微粉化TCA粒子形态是近球形的,同时从TCA的正态分布曲线(图 2)上也可以看出,通过实验得到了平均粒径为130 nm的TCA微粉,即制备后TCA的形态有了很大的变化,粒径更小,分布也更均匀,这与透射电镜测得的结果一致。
 | 图 1 TCA原药 (A) 和微粉 (B) 的扫描电镜图 Fig. 1 SEM images of raw TCA particles (A) and TCA nanoparticles (B) |
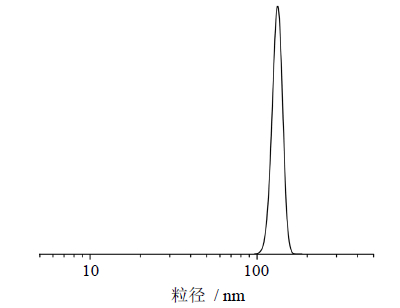 | 图 2 TCA微粉的粒径正态分布曲线图 Fig. 2 Size distribution and mean diameter of TCA nanoparticles suspension |
TCA样品与溴化钾粉末按1%混合稀释,然后用研钵充分将大颗粒物质研成细粉末,将样品压在样品盘上,在4 000~500 cm-1进行红外扫描分析,解析度为4 cm-1。将得到的TCA微粉、TCA含甘露醇的微粉以及原粉进行红外光谱的对比分析,结果如图 3所示,TCA原粉和微粉的红外吸收峰位置基本相同,说明反溶剂重结晶法所制得的微粉与原粉对比,化学结构基本没有变化。含甘露醇的TCA微粉与前两者不同的主要原因是冻干辅料甘露醇的特征吸收导致的。
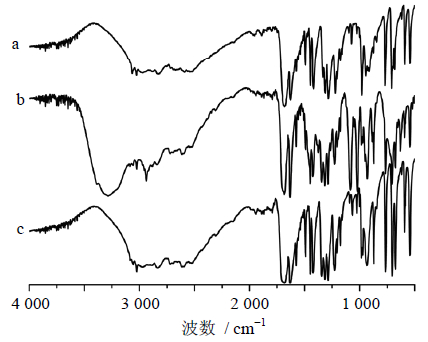 | a-TCA原粉 b-含甘露醇的TCA微粉 c-TCA微粉 a-raw TCA b-TCA nanoparticles with mannitol c-TCA nanoparticles without mannitol图 3 原药及微粉的FTIR图谱 Fig. 3 FTIR spectra of raw TCA and TCA nanoparticles |
运用API3000(AB,USA)质谱仪来分析TCA微粉的相对分子质量。把原药和微粉5 mg溶于10 mL甲醇溶液中,以10 000 r/min进行10 min离心,取上清进行检测。质谱仪在负离子模式下进行检测。图 4呈现了TCA的质谱图,从图 4可以得出TCA原药和微粉的相对分子质量分别是148.1和148.2,与文献报道的TCA相对分子质量148.16一致,二者的相对分子质量并没有发生变化,这一结果与FTIR结果吻合,由此可以判断通过反溶剂重结晶法得到的TCA微粉化学结构没有发生变化。
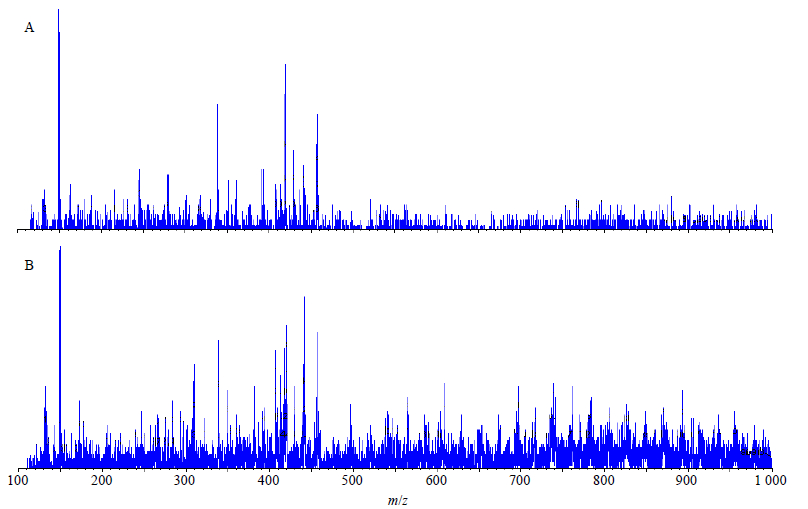 | 图 4 TCA原药 (A) 及微粉 (B) 的质谱图 Fig. 4 Mass spectrogram of raw TCA (A) and TCA nanoparticles (B) |
称取样品10 mg,使用X射线粉末衍射仪对TCA微粉的晶体结构进行分析。检测条件如下:扫描步长为0.02°,扫描范围5°~50°,电压40 kV,电流30 mA。图 5显示了原药、微粉化TCA和加甘露醇的超细TCA的X射线衍射对比检测结果,TCA原药有几种不同的峰分别在衍射角2θ为9.618°、18.710°、19.574°、22.730°、25.284°、27.314°、29.418°、31.860°、33.776°出现,这些峰的出现表明TCA原药是以晶体形式存在的。相反的是,与TCA原药对比,微粉化的TCA仅仅出现了几个很弱的峰2θ为5.560°、18.372°、16.982°,这些峰的消失或者减弱,说明两者的物理结构不同。这表明TCA粒子在经过反溶剂重结晶之后,呈现出低结晶态。低结晶态的药物粒子比结晶态的药物粒子具有较高的溶出速率和生物利用度,因此,会在较短的时间内发挥其自身的作用。
 | a-TCA原粉 b-含甘露醇的TCA微粉 c-TCA微粉 a-raw TCA b-TCA nanoparticles with mannitol c-TCA nanoparticles without mannitol图 5 原药及微粉的 XRD图谱 Fig. 5 XRD patterns of raw TCA and TCA nanoparticles |
称取TCA原药和微粉各5 mg,放入量热池内进行测试。分析检测条件:温度35~200 ℃,升温速度10 ℃/min。图 6显示了TCA原药和微粉、加甘露醇的超细TCA的DSC曲线图,TCA原药显示出熔点峰在134.7 ℃,而微粉化TCA的熔点峰出现在133.6 ℃,结果表明最优条件下的TCA粒子的熔点降低了1.1 ℃,这个证据表明了微粉化的TCA有很低的结晶度,这个结果和XRD图谱的结果是一致的。TCA微粉表面能的提高与表面原子的增多为表面原子提供了1个不完全的配位层。因此,TCA微粉的熔化不需要很多的能量,这也是超细微粒熔点下降的原因。
 | a-TCA原粉 b-含甘露醇的TCA微粉 c-TCA微粉 a-raw TCA b-TCA nanoparticles with mannitol c-TCA nanoparticles without mannitol图 6 原药及微粉的DSC图谱 Fig. 6 DSC curves of raw TCA and TCA nanoparticles |
使用美国Waters公司的Waters色谱仪器进行高效液相色谱分析。色谱柱为中国生产的Diamonsil C18反相柱(250 mm×4.6 mm,5 μm)。流动相为乙腈-0.1%磷酸水溶液(30∶70),柱温为室温,进样量为20 μL,体积流量为1 mL/min,检测波长为278 nm[20]。
2.3.7 药物纯度分析使用HPLC法对TCA原粉和微粉的质量分数进行分析对比。把0.5 mg的原粉和微粉溶于10 mL流动相当中,放入高速离心机中10 000 r/min离心10 min,取上清液20 μL直接进样进行检测,按照峰面积计算药物质量浓度并折算成质量分数。分析条件和“2.3.6”项相同,检测重复进行3次。通过高效液相色谱仪对经过反溶剂重结晶后的微粉进行质量分数检测,TCA原药的出峰时间是19.333 min,TCA微粉的出峰时间是19.958 min,根据标准曲线进行计算,回归方程Y=81 499 X+58 903,r=0.999 6,原粉的质量分数为99.0%,而微粉的质量分数则达到了99.8%,其原因可能是反溶剂结晶过程中因为同种分子聚集而引起质量分数的增加。
2.3.8 溶出度测试TCA的原药和微粉的溶出度用透析法来进行分析。搅拌速度和溶液温度分别为75 r/min和(37.0±0.5)℃,人工胃液作为溶解介质[21]。将含有5 mg TCA的原药和微粉加入到透析袋中,200 mL人工胃液为溶解介质,在2、5、10、20、30、45、60、90、120 min时取样5 mL,同时补以同体积等温溶出介质。将滤液离心取上清,直接进入HPLC系统,用于测定TCA质量浓度。分析条件和“2.3.6”项相同,检测重复进行3次。图 7呈现了最优条件下TCA原药和微粉的溶出曲线,微粉化的TCA较原药相比,溶出速率有了很大的提高。从图 7中可以看出,微粉化的TCA在120 min达到了86%的药物溶出,相同条件下的TCA原药仅达到了51.5%。由于微粉化TCA溶解度和溶出速率的增加,可以减小TCA的粒径,增加比表面积。因此,更低的结晶度和更小的药物颗粒比结晶的药物具有更高的溶解速度和生物利用度。由此也可以证明,它们可以在最短的时间内发挥生物活性。
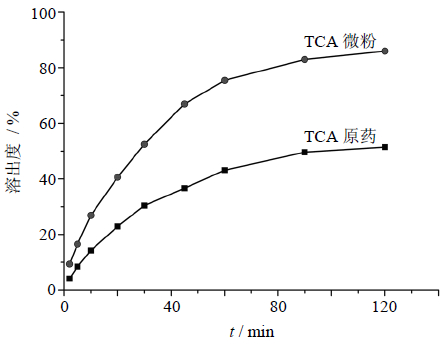 | 图 7 原药和微粉的溶出曲线图 Fig. 7 Dissolution profiles of raw TCA and TCA nanoparticles |
在本研究中,通过采用反溶剂重结晶法,改善TCA的水溶性差、溶出度低的缺点,得到微粉化的TCA。最终确定乙醇作为溶剂、去离子水和表面活性剂HPMC作为反溶剂是最佳组合。研究结果表明沉积时间为10 min,药物质量浓度为170 mg/mL,溶剂与反溶剂体积比为1∶4,HPMC用量为0.3%,搅拌强度为2 500 r/min,是制备微粉化TCA的最优工艺条件。药物质量浓度、搅拌强度对药物微粉化的影响比较大,沉积时间、体积比、HPMC的用量等因素也对TCA微粉化起着一定的作用。通过单因素分析方法,测得微粉平均粒径达到130 nm,与最初预测结果相近。表明单因素分析法寻求反溶剂重结晶制备TCA微粉的最佳工艺条件切实可行。TEM结果表明TCA由原来分布不均匀的长方形粒子,通过微粉化得到了分布均匀、颗粒较小的球形粒子。对FTIR和质谱的分析,说明微粉化的TCA化学结构未发生变化,XRD分析表明原药的晶体结构为结晶形,微粉化的TCA粒子的结晶度显著降低。在DSC的检测中,最优条件下的TCA粒子的熔点降低了1.1 ℃,这个证据表明了微粉化的TCA有较低的结晶度,这与XRD图谱是一致的。经过反溶剂重结晶之后TCA微粉的质量分数由99.0%提高至99.8%。与TCA原药对比,在溶解速率上微粉是原药的1.67倍。
本实验以难溶性药物TCA为研究对象,考察了反溶剂重结晶的实验方法的可行性,并确定了最优工艺条件,表征了微粉化药物的理化性质的各项指标及稳定性。以上实验结果为进一步开发TCA的药物新剂型奠定了研究基础,具有广阔的市场前景。
| [1] | 李利君, 黄文艺, 冯 君, 等. 非水毛细血管电泳/紫外检测法测定肉桂中的肉桂酸和肉桂醛 [J]. 分析测试学报, 2007, 26(2): 274-276. |
| [2] | 赵春贵, 张立伟, 王 晖. 肉桂酸及其衍生物抗氧化活性研究 [J]. 食品科学, 2005, 26(1): 218-226. |
| [3] | 陈芬儿, 余红霞, 万江陵. 沙丁胺醇硫酸盐的合成研究 [J]. 中国药物化学杂志, 1993, 5(3): 215-217. |
| [4] | 张汝冰, 刘宏英, 李凤生. 纳米技术在生物学和药学领域的应用 [J]. 现代化工, 1999, 19(7): 49-51. |
| [5] | 龙 涛, 皮振邦, 田熙科, 等. 超细阿奇霉素的制备及表征 [J]. 化工进展, 2005, 24(7): 763-766. |
| [6] | 杨 芳, 沈志刚, 陈建峰. 反溶剂重结晶法制备微粉化奈普生的研究 [J]. 北京化工大学学报, 2006, 33(3): 15-18. |
| [7] | 刘学武, 李志义, 夏远景, 等. 超临界反溶剂过程制备银杏叶提取物超细微粒 [J]. 高校化学工程学报, 2005, 19(4): 550-553. |
| [8] | Ruch F, Matijevic E. Preparation of micrometer size budesonide particle by precipitation [J]. J Colloid Interf Sci, 2000, 229(1): 207-211. |
| [9] | 谢玉洁, 王洁欣, 乐 园, 等. 反溶剂重结晶法制备阿奇霉素超细粉体 [J]. 北京化工大学学报, 2011, 38(3): 17-21. |
| [10] | 任夫健, 张同来, 于 伟. 药物微粉制备及防团聚技术 [J]. 现代化工, 2005, 25(10): 66-68. |
| [11] | 周敏毅, 陈建峰, 刘晓林. 用反溶剂重结晶法制备微粉化布洛芬的研究进展 [J]. 化工进展, 2003, 22(5): 524-527. |
| [12] | 杨 雁, 钟 杰. 头孢拉定微粉化 [J]. 北京化工大学学报, 2004, 31(5): 15-17. |
| [13] | Zhang J Y, Shen Z G, Zhong J, et al. Preparation of amorphous cefuroxime axetil nanoparticles by con-trolled nanoprecipitation method without surfactants [J]. Int J Pharm, 2006, 323(1/2): 153-160. |
| [14] | Wang Z, Chen J F, Le Y, et al. Preparation of ultrafine beclomethasone dipropionate drug powder by antisolvent precipitation [J]. Ind Eng Chem Res, 2007, 46(14): 4839-4845. |
| [15] | 周敏毅, 陈建峰, 刘晓林. 通过反溶剂重结晶法改善布洛芬的水溶性 [J]. 北京化工大学学报: 自然科学版, 2003, 30(4): 6-8. |
| [16] | Chen J F, Zhang J Y, Shen Z G, et al. Production and characterization of amorphous cefuroxime axetil drug nanoparticles with noveltechnology: high-gravity anti- solvent precipitation [J]. Ind Eng Chem Res, 2006, 45(25): 8723-8727. |
| [17] | Li X S, Wang J X, Shen Z G, et al. Preparation of uniform prednisolone microcrystals by a controlled micro- precipitation method [J]. Int J Pharm, 2007, 342(12): 26-32. |
| [18] | Zhao H, Wang J X, Wang Q A, et al. Controlled liquid antisolvent precipitation of hydrophobic pharmaceutical nanoparticles in microchannel reactor [J]. Ind Eng Chem Res, 2007, 46(24): 8229-8235. |
| [19] | 张纪尧, 沈志刚, 陈建峰. 通过冷冻干燥水溶胶制备微粉化的辛伐他汀 [J]. 高校化学工程学报, 2006, 20(5): 814-819. |
| [20] | 袁祥慧, 杨惠莲. 高效液相色谱法测定五苓片中肉桂酸含量 [J]. 中国药业, 2011, 20(9): 18-19. |
| [21] | 王 焱, 宋小玲, 陈银芳, 等. 龙胆总苷胃漂浮微丸制备及其体外释药特性研究 [J]. 中草药, 2012, 43(9): 1751-1755. |
 2014, Vol. 45
2014, Vol. 45


