随着高效分离和提取技术的发展,从植物中提取生物活性物质作为药物使用越来越受到重视。桦木酸(betulinic acid,BA)属于羽扇豆烷型五环三萜类物质,广泛分布于如鼠李科、桃金娘科和桦木科等多种植物中,其量普遍很低,以白桦树皮量较高。《本草纲目》中记载桦树皮可用于黄疽、乳痈、疥疮等疾病的治疗[1]。早在19世纪,人们就开始对白桦树进行研究,白桦树皮常被美国人放在茶和其他饮料中用来治疗胃肠道疾病腹泻和痢疾;白桦树汁对人体健康大有益处,有抗疲劳、止咳等药理作用,被欧洲人称为“天然啤酒”和“森林饮料”。俄罗斯自1843年以来一直对白桦树进行研究,树皮可提取烤胶、桦皮油,还可用于防腐膏等[2]。
20世纪90年代,Kim等[3]首先采用2步法从白桦树皮中提取到了BA,结构式见图 1。1995年发现BA对黑素瘤细胞具有极强的选择性细胞毒性[4],能抑制H9淋巴细胞中HIV的复制,其作用范围几乎影响病毒生命周期的每个环节[5]。由于BA具有优越的抗肿瘤和抗HIV活性,引起了人们对BA的广泛研究与关注。随后研究发现,BA具有免疫调节、抗氧化应激、抗菌、抗炎、抗寄生虫、抗溃疡及抗疟疾等多种较强的生物活性[2,3,4,5],因而受到国内外学者的广泛重视。本文就BA的药理作用进行详细阐述,旨在为BA的深入研究和开发利用提供参考。
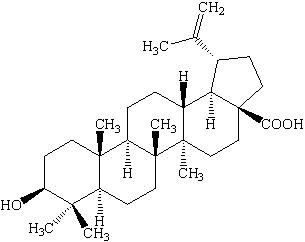 | 图 1 BA的化学结构式Fig. 1 Chemical structure of BA |
1 抗肿瘤
BA及其衍生物能选择性地作用于多种肿瘤细胞,而对正常细胞没有影响。最初研究认为:BA仅能选择性地诱导黑色素瘤细胞凋亡产生细胞毒性,而对乳腺癌(BC-1)、结肠癌(COL-2)、鳞状上皮癌(KB)、前列腺癌(LNCaP)和肺癌(LU-1)等细胞系没有活性[4]。随后研究证实BA具有广泛的抗癌活性,对神经母细胞瘤9个细胞系(SKNSH、IMR-5、NBL-S、NBAS5、LAN-5等)都有细胞毒性[6],还能诱导人恶性胶质瘤(LN-229,U87MG和T98G)细胞凋亡[7]。BA能抑制赘生性细胞系的生长,如卵巢癌(A2780、OVCAR-5和、IGROV-1)、肺癌(H460、POGB)、宫颈癌(A431)[8]等,还能诱导初级神经管细胞瘤(D283Med、MHH1MEB1)和胶质母细胞瘤(A172、U138MG、U373和SK14)细胞凋亡[9]。体外研究发现,BA诱导初级胶质母细胞瘤细胞凋亡率远远高于临床常用的抗肿瘤药长春新碱和亚硝基脲[10];BA的抗白血病活性(急性普通淋巴白血病、急性T淋巴细胞白血病、急性B淋巴细胞白血病、急性骨髓白血病)强于90%标准治疗方法,对于肿瘤的复发尤为有效,且不与任何细胞毒药物产生交叉耐药性[11],这可能与环境的pH值有关,BA在pH值较低(≤6.8)的环境下细胞毒性更强,因为肿瘤组织的pH值通常低于正常组织[12]。
Fulda等[13]报道,BA和抗肿瘤药联合使用,能协同诱导线粒体膜电位的降低以及细胞色素C和Smac基因从线粒体中的释放,从而激活半光天冬酶(caspase),引起细胞凋亡。BA具有与抗肿瘤药物协同诱导细胞凋亡、抑制幸存肿瘤细胞群落的作用。当BA与长春新碱联合用药时,抑制黑素瘤细胞的生长与转移;当BA与肿瘤坏死因子凋亡配体(tumor necrosis factor-related apoptosis ligand,TRAIL)合用时,能诱导成神经瘤细胞凋亡,但对人体正常的成纤维细胞没有影响[14]。BA对阿霉素处理的成神经管细胞瘤、成胶质细胞瘤以及黑素瘤细胞(Mel-Juso)仍然敏感,而且对辐射处理的癌细胞,BA能进一步抑制其生长,降低肿瘤细胞生存率[15]。值得注意的是,BA与许多细胞毒性化合物如多柔比星、紫杉醇、依托泊昔、放线菌素D联合用药,并表现协同作用,这可能与它们作用于不同的细胞周期有关。而且,对于不同的肿瘤细胞,BA和抗肿瘤药物也能协同诱导其凋亡,包括p53突变细胞、原发性肿瘤细胞。但对头颈癌细胞系,BA与顺铂没有协同作用[16]。由此可见,BA有望作为增效剂,用于肿瘤化学联合疗法,避免多药耐药性的产生,增强抗肿瘤药的治疗效果。
细胞凋亡具有典型的形态学变化,如染色质浓缩、核质致密凝集、DNA断裂、核固缩、细胞膜发泡以及caspase激活等。研究发现,BA是通过线粒体介导途径来诱导肿瘤细胞凋亡的,其诱导线粒体膜电位变化,产生活性氧分子,开启通透性孔道,从而引起线粒体凋亡因子的释放,caspases的激活,以及DNA片断的产生。BA诱导细胞凋亡,但并不依赖p53,也不依赖CD95/CD95L死亡受体[4,8,17]。BA使黑素瘤细胞(MEL-1-4)缩小,细胞膜发泡以及DNA断裂,还能使成神经细胞瘤、成神经管细胞瘤、成胶质细胞瘤以及尤文氏肉瘤细胞系核断裂,激活胶质瘤细胞caspase的活性,特别是caspase-3、8的活性。Zanon等[18]报道,BA使黑素瘤细胞(SK-Mel-5)caspase-2、3、8、9的活性增强,但Tan等[19]报道,BA并不引起黑素瘤细胞(UISO-Mel-1)caspase-3、8、9活性的变化。BA能非细胞特异性地抑制核转录因子(nuclear factor-kappa B,NF-κB)和核转录因子抑制蛋白(inhibitory protein of NF-κB,IκB)的活性,从而阻滞IKB的磷酸化和降解,也能抑制NF-κB依赖性受体基因的表达和NF-κB调节基因产物的产生[20]。而Kasperczyk等[21]报道,BA激活成神经细胞瘤(SHEP、SH-SY5Y)、成胶质细胞瘤(LN229、U373)和黑素瘤细胞(Mewo)NF-κB的活性,但这种诱导作用能被不同的化合物(蛋白酶抑制剂、抗氧化剂)所阻断,某些特异性的NF-κB抑制剂,特别是短暂或稳定表达IκBα超阻遏物的抑制剂,可选择性地使BA对某些成神经细胞瘤凋亡产生抑制作用,而对BA诱导的其他细胞凋亡没有影响。这说明BA对NF-κB的活性调控具有细胞特异性,因此,NF-κB抑制剂与BA联合用药时,不一定会产生好的治疗效果,对某些细胞而言,可能会产生相反的作用,这也为BA的联合用药提供一定的理论指导。当有致癌物或炎性物刺激时,BA干扰NF-κB的活性和基因表达调控[11,21],这可能是BA的抗炎作用和免疫调节作用的分子机制。
其他相关的研究如活性氧的产生、拓扑异构酶I的抑制、血管生成的抑制以及氨肽酶N活性的调节等[22],这些都在BA诱导肿瘤细胞凋亡过程中扮演着一定的角色。所有这些潜在的作用机制使得BA有望用来治疗耐药的肿瘤。
2 抗艾滋病目前公认的抗艾滋病的作用机制是抑制HIV-1逆转录酶或抑制蛋白酶的活性,而BA及其衍生物的作用机制是抑制病毒的穿入,阻止病毒吸附或抑制细胞膜的融合或阻止前体分裂为成熟的HIV蛋白,从而削弱病毒颗粒的感染性[5]。
BA抑制H9淋巴细胞中HIV复制的半数有效浓度(EC50)为1.4 μmol/L,是HIV与细胞膜的融合抑制剂。对BA进行结构修饰得到的双酯类化合物抗HIV-1的治疗指数分别为21 515和42 400,EC50分别为0.66和0.87 nmol/L[23],而临床上常用的一种抗艾滋病药,齐多夫定的治疗指数为33 333~41 622,EC50为15~45 nmol/L,这说明对BA进行结构修饰与改造,有希望获得活性高、毒性更低的抗HIV药物。
3 免疫调节作用免疫调节是三萜类物质最重要和最主要的生物活性,BA具有调节细胞免疫、体液免疫和非特异性免疫的功能。BA通过与T细胞相互作用提高人单核细胞来源的树突细胞的免疫力[24];激活巨噬细胞和调节Th-1细胞,从而提高小鼠的免疫力[25];抑制促炎酶和促炎因子的活性,显示很好的免疫调节作用[26];抑制IL-6的分泌,显示免疫调节作用[27]。体外研究发现,BA具有抗氧化和护肝作用[28]。Yi等[29]研究发现,BA能协同促进刀豆蛋白A(Con A)或脂多糖(LPS)诱导的小鼠脾脏T淋巴细胞或B淋巴细胞的增殖活性,能提高小鼠的免疫器官指数,提高胸腺淋巴细胞CD4+百分率,脾淋巴细胞的CD19+百分率以及CD4+/CD8+的百分比,表明BA从增强淋巴细胞活性和改变T、B淋巴细胞的数目或亚群,来提高机体的细胞免疫。BA增加绵羊红细胞(SRBC)免疫小鼠溶血空斑数,降低血清免疫球蛋白IgG和IgM的抗体滴度,提高血清溶菌酶量,表明BA作为抗原刺激物,活化的B细胞数量增多,功能增强,从而提高机体的体液免疫功能[30]。BA降低小鼠血清白细胞介素-2(IL-2)和IL-6的分泌量,略提高血清IL-10的水平,说明BA调控Th1/Th2类细胞因子。BA显著性地促进小鼠腹腔巨噬细胞增殖,显著增强腹腔巨噬细胞吞噬中性红的能力,提高腹腔巨噬细胞肿瘤坏死因子(TNF-α)水平,这表明BA能够刺激巨噬细胞,增强巨噬细胞的吞噬能力,提高非特异性免疫功能[31]。
4 抗氧化应激BA对正常细胞或机体具有保护作用,该保护作用与抗氧化应激有一定的关系。BA通过抗氧化应激、抗氮化应激和增加血流量,对小鼠缺血再灌注脑损伤具有保护作用[32],而对缺血再灌注肾损伤是通过抗氧化作用、抑制白细胞凋亡和改善肾功能发挥保护作用[33];还能调控细胞周期的调节蛋白,通过降低活性氧(ROS)的生成和NF-κB的活性,明显抑制高糖诱导的人主动脉平滑肌细胞和人脐静脉内皮细胞的增殖,对血管具有保护作用,能有效预防动脉粥样硬化[34]。BA通过抗氧化作用、抑制细胞因子的分泌等途径对甲醇致肝星状细胞损伤具有保护作用[35]。BA具有内皮依赖性舒张血管作用,该作用可能与激活一氧化氮合酶-一氧化氮(NOS-NO)通路有关,BA可以减轻过氧化氢诱导的大鼠胸主动脉内皮依赖性舒张功能降低,这可能与其降低血管内皮氧化应激,维持血管内皮NO活性有关[36]。BA抑制NF-κB p65核转位,使LPS致外周血单核细胞IL-6的分泌量减少,这种抑制作用可能与丝裂原激活的蛋白激酶(MAPK)和NF-κB通路间的关联物p38和细胞外信号调控激酶(ERK)有关[37]。同时研究发现,BA能抑制ERK通路和调控IκBα磷酸化,降低LPS致人外周血单核细胞环氧合酶-2(COX-2)表达和前列腺素E2的生成、ROS产生与乳酸脱氢酶的活性[38,39]。前期试验发现,BA具有促进淋巴细胞增殖,提高脾、胸腺以及腹腔巨噬细胞谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)的活性,降低丙二醛(MDA)的量,增强淋巴细胞的抗氧化能力[31];进一步研究发现,BA对地塞米松诱导的淋巴细胞凋亡具有干预作用,在一定程度上起到了预防性的保护作用。这可能与BA抑制氧化酶活性、自由基和脂质过氧化物产生,提高抗氧化能力有关,但保护作用机制还有待于深入研究与探讨。
5 抗炎、抗菌许多五环三萜类化合物都具有抗炎活性,BA对十四烷酰佛波醇乙酸酯(TPA)引起的小鼠皮炎和耳廓肿胀具有明显的抑制作用,对血清素(5-羟色胺)和角叉菜胶致大鼠足底肿胀也具有明显抑制作用(表 1)。研究发现,BA还能抑制COX-2的活性,其抑制率为40%。BA在较高浓度时,具有稳定的抗炎活性,其作用机制是抑制非神经原性途径。
| 表 1 BA的抗炎作用 Table 1 Anti-inflammatory properties of BA |
体外研究发现,BA抗大肠杆菌、枯草杆菌、金黄色葡萄球菌和表皮葡萄球菌等,1 000 g/disc浓度的BA抑制枯草杆菌的生长,其抑菌圈为18.8 mm2;对结核分支杆菌的最低抑菌浓度(MIC)值为32 μmol/L,对表皮葡萄球菌的MIC值为8~16 μg/mL。BA抗主要霉菌的几丁质复合酶II,其IC50为98.7 μg/mL[51]。研究发现,BA抑制霉菌生长的MIC为12~32 μg/mL,BA还具有抗大肠杆菌、肠球菌和金黄色葡萄球菌的作用[52]。但Stephane等[53]研究报道,BA抑菌的MIC≥256 mg/L,而且选择指数(SI=IC50/MIC)非常低,大约为0.005;Alakurtti等[54]研究发现,BA抑菌的MIC≥128 mg/L,证实BA抗菌活性较弱。BA属于羽扇烷五环三萜类物质,结构与藿烷五环三萜类相似,由于细菌膜上存在能生物合成藿烷五环三萜类的物质,这可能是BA抗菌活性较弱的合理解释[53]。基于以上研究说明,BA不是一个很有潜力的抗菌药物。
6 抗寄生虫Enwerem等[55]将蠕虫的悬液用BA处理,共同培养7 d,结果发现用醋酸乙酯提取的BA具有最强的抗寄生虫作用,其EC50为1×10-4,死亡率为98%,而常用抗蠕虫药哌嗪的死亡率为95%。
BA能作用于氯喹敏感菌株(T9-96)以及抗疟原虫(K1),在体外BA对KI和T9-96的IC50分别为19.6和25.9 μg/mL;抗恶性疟原虫的IC50为10.46 μg/mL,并对无性繁殖阶段(红细胞期)疟原虫作用更好。然而,体内实验发现,250 mg/kg BA对疟原虫仍没有显现出任何活性。近来又研究发现,BA的C-3和C-28衍生物在体外抗疟原虫的实验中显现出较强的活性[56]。
7 其他BA具有抗生殖器单纯疱疹病毒-1(HSV-1)[57]和抗艾柯病毒(ECH0-6)的作用[58]。
有文献报道,BA具有抗焦虑作用[59],而且有些抗焦虑药中含有BA组分,这可能跟BA脂溶性较高,能透过血脑屏障有关。
BA能抑制由低血压、心动过缓和胆碱引起的支气管收缩,这可能与Ca2+浓度变化有一定关系[60]。
研究发现,口服BA 1 h后,再用消炎痛和阿司匹林诱导胃黏膜损伤模型,作用24 h后,剖检发现BA能减轻胃黏膜损伤,这说明BA对胃肠黏膜具有保护作用[2]。
8 结语一些具有免疫调节、抗氧化应激、清除自由基作用的生物活性分子可望有效地调控机体的氧化应激,从而保障机体细胞内外环境的平衡和生理机能正常。BA是一种植物源性免疫调节剂与抗氧化剂,具有抗肿瘤、免疫调节、抗氧化应激、抗菌、抗炎、抗艾滋病等广泛的药理作用。综合BA的药理作用,BA发挥抗肿瘤作用是直接杀伤肿瘤细胞,还是通过提高机体的抗氧化应激的能力,增强机体的免疫功能达到杀伤肿瘤细胞,目前此问题仍不清楚,其作用机制尚不清楚,值得深入研究与探讨。对BA的免疫调节和抗氧化应激机制进一步研究,有望开发成新免疫调节剂和抗氧化剂,为深入开展氧化应激的理论研究和科学应用提供理论依据和新的探索途径。
| [1] | 李时珍. 本草纲目 [M]. 北京: 人民卫生出版社, 1978. |
| [2] | Flekhter O B, Nigmatullina L R, Baltina L A, et al. Synthesis of betulinic acid from betulin eatract and study of the antiviral and antiulcer activity of some related terpenoids [J]. Pharm Chem J, 2002, 36(9): 484-487. |
| [3] | Kim D S H L, Chen Z, Nguyen V T, et al. A concise semi-synthetic approach to betulinic acid from betulin [J]. Synth Commun, 1997, 27(9): 1607-1612. |
| [4] | Pisha E, Chai H, Lee I S, et al. Discovery of betulinic acid as a selective inhibitor of human melanoma that functions by induction of apoptosis [J]. Nat Med, 1995, 1(10): 1046-1051. |
| [5] | Mayaux J F, Bousseau A, Pauwels R, et al. Triterpene derivatives that block entry of human immunodeficiency virus type 1 into cells [J]. Pro Nat Acad Sci, 1994, 91(9): 3564-3568. |
| [6] | Schmidt M L, Kuzmanoff K L, Ling-Indeck L, et al. Betulinic acid induces apoptosis in human neuroblastoma cell lines [J]. Eur J Cancer, 1997, 33(12): 2007-2010. |
| [7] | Wick W, Grimmel C, Wagenknecht B, et al. Betulinic acid-induced apoptosis in glioma cells: a sequential requirement for new protein synthesis, formation of reactive oxygen species, and caspase processing [J]. J Pharmacol Exp Ther, 1999, 289(3): 1306-1312. |
| [8] | Zuco V, Supino R, Righetti S C, et al. Selective cytotoxicity of betulinic acid on tumor cell lines, but not on normal cells [J]. Cancer Lett, 2002, 175(1): 17-25. |
| [9] | Fulda S, Jeremias I, Steiner H H, et al. Betulinic acid: a new cytotoxic agent against malignant brain-tumor cells [J]. Int J Cancer, 1999, 82(3): 435-441. |
| [10] | Jeremias I, Steiner H H, Benner A, et al. Cell death induction by betulinic acid, ceramide and TRAIL in primary glioblastoma multiforme cells [J]. Acta Neurochir, 2006, 146(7): 721-729. |
| [11] | Ehrhardt H, Fulda S, Fuhrer M, et al. Betulinic acid-induced apoptosis in leukemia cells [J]. Leukemia, 2004, 18(8): 1406-1412. |
| [12] | Noda Y, Kaiya T, Kohda K, et al. Enhanced cytotoxicity of some triterpenes toward leukemia L1210 cells cultured in low pH media: possibility of a new mode of cell killing [J]. Chem Pharm Bull, 1997, 45(10): 1665-1670. |
| [13] | Fulda S, Scaffidi C, Susin S A, et al. Activation of mitochondria and release of mitochondrial apoptogenic factors by betulinic acid [J]. J Biol Chem, 1998, 273(51): 33942-33948. |
| [14] | Sawada N, Kataoka K, Kondo K, et al. Betulinic acid augments the inhibitory effects of vincristine on growth and lung metastasis of B16F10 melanoma cells in mice [J]. Br J Cancer, 2004, 90(8): 1672-1678. |
| [15] | Fulda S, Debatin K. Sensitization for anticancer drug-induced apoptosis by betulinic acid [J]. Neoplasia, 2005, 7(2): 162-170. |
| [16] | Eder-Czembirek C, Czembirek C, Erovic B M, et al. Combination of betulinic acid with cisplatin-different cytotoxic effects in two head and neck cancer cell lines [J]. Oncol Rep, 2005, 14(3): 667-671. |
| [17] | Fulda S, Friesen C, Los M, et al. Betulinic acid triggers CD95 (APO-1/Fas)- and p53-independent apoptosis via activation of caspases in neuroectodermal tumors [J]. Cancer Res, 1997, 57(21): 4956-4964. |
| [18] | Zanon M, Piris A, Bersani I, et al. Apoptosis protease activator protein-1 expression is dispensable for response of human melanoma cells to distinct proapoptotic agents [J]. Cancer Res, 2004, 64(20): 7386-7394. |
| [19] | Tan Y, Yu R, Pezzuto J M. Betulinic acid-induced programmed cell death in human melanoma cells involves mitogen-activated protein kinase activation [J]. Clin Cancer Res, 2003, 9(7): 2866-2875. |
| [20] | Takada Y, Aggarwal B B. Betulinic acid suppresses carcinogen-induced NF-kappa B activation through inhibition of I kappa B alpha kinase and p65 phosphorylation: Abrogation of cyclooxygenase-2 and matrix metalloprotease-9 [J]. J Immunol, 2003, 171(6): 3278-3286. |
| [21] | Kasperczyk H, La Ferla-Bruehl K, Westhoff M A, et al. Betulinic acid as new activator of NF-κB: Molecular mechanisms and implications for cancer therapy [J]. Oncogene, 2005, 24(46): 6945-6956. |
| [22] | Flekhter O B, Karachurina L T, Nigmatullina L R, et al. Synthesis and pharmacological activity of betulin dinicotinate [J]. Russ J Bioorg Chem, 2002, 28(6): 494-500. |
| [23] | Kashiwada Y, Chiyo J, Ikeshiro Y, et al. 3, 28-di-O- (dimethylsuccinyl)-betulin isomers as anti-HIV agents [J]. Bioorg Med Chem Lett, 2001, 11(2): 183-185. |
| [24] | Freydottir J, Sigurpalsson M B, Omarsdottir S, et al. Ethanol extract from birch bark (Betula pubescens) suppresses human dendritic cell mediated Th1 responses and directs it towards a Th17 regulatory response in vitro [J]. Immunol Lett, 2011, 136(1): 90-96. |
| [25] | Mishra T, Bhatia A. Augmentation of expression of immunocytes' functions by seed extract of Ziziphus mauritiana (Lamk.) [J]. J Ethnopharmacol, 2010, 127(2): 341-345. |
| [26] | Beninca J P, Dalmarco J B, Pizzolatti M G, et al. Analysis of the anti-inflammatory properties of Rosmarinus officinalis L. in mice [J]. Food Chem, 2011, 124(2): 468-475. |
| [27] | Saaby L, Jager A K, Moesby L, et al. Isolation of immunomodulatory triterpene acids from a standardized rose hip powder (Rosa canina L.) [J]. Phytother Res, 2011, 25(2): 195-201. |
| [28] | Hubert D J, Dawe A, Florence N T, et al. In vitro hepatoprotective and antioxidant activities of crude extract and isolated compounds from Ficus gnaphalocarpa [J]. Inflammopharmacology, 2011, 19(1): 35-43. |
| [29] | Yi J E, Obminska-Mrukowicz B, Yuan L Y, et al. Immunomodulatory effects of betulinic acid from the bark of white birch on mice [J]. J Vet Sci, 2010, 11(4): 305-313. |
| [30] | 易金娥, 袁莉芸, 文利新, 等. 桦木酸对小鼠淋巴细胞及巨噬细胞的影响分析 [J]. 畜牧兽医学报, 2011, 42(1): 124-130. |
| [31] | 易金娥, Obminska-Mrukowicz B, 杜金艳, 等. 桦木酸对巨噬细胞免疫功能和抗氧化作用的研究 [J]. 营养学报, 2010, 32(3): 281-285. |
| [32] | Lu Q, Xia N, Xu H, et al. Betulinic acid protects against cerebral ischemia-reperfusion injury in mice by reducing oxidative and nitrosative stress [J]. Nitric Oxide, 2011, 24(3): 132-138. |
| [33] | Eksioglu-Demiralp E, Kardas E R, Ozgul S, et al. Betulinic acid protects against ischemia / reperfusion- induced renal damage and inhibits leukocyte apoptosis [J]. Phytother Res, 2010, 24(3): 325-332. |
| [34] | Yoon J J, Lee Y J, Kim J S, et al. Betulinic acid inhibits high glucose-induced vascular smooth muscle cells proliferation and migration [J]. J Cell Biochem, 2010, 111(6): 1501-1511. |
| [35] | Szuster-Ciesielska A, Plewka K, Daniluk J, et al. Betulin and betulinic acid attenuate ethanol-induced liver stellate cell activation by inhibiting reactive oxygen species (ROS), cytokine (TNF-α, TGF-β) production and by influencing intracellular signaling [J]. Toxicology, 2011, 280(3): 152-163. |
| [36] | 傅佳寅, 夏满莉, 陆建锋, 等. 白桦脂酸改善氧化应激损伤大鼠血管的内皮依赖性舒张功能 [J]. 浙江大学学报: 医学版, 2010, 39(5): 523-529. |
| [37] | Yoon J J, Lee Y J, Kim J S, et al. Protective role of betulinic acid on TNF-alpha-induced cell adhesion molecules in vascular endothelial cells [J]. Biochem Biophys Res Commun, 2010, 391(1): 96-101. |
| [38] | Viji V, Shobha B, Kavitha S K, et al. Betulinic acid isolated from Bacopa monniera (L.) Wettst suppresses lipopolysaccharide stimulated interleukin-6 production through modulation of nuclear factor-kappa B in peripheral blood mononuclear cells [J]. Int Immunopharmacol, 2010, 10(8): 843-849. |
| [39] | Viji V, Helen A, Luxmi V R. Betulinic acid inhibits endotoxin-stimulated phosphorylation cascade and pro-inflammatory prostaglandin E (2) production in human peripheral blood mononuclear cells [J]. Br J Pharmacol, 2011, 162(6): 1291-1303. |
| [40] | Higa M, Ogihara K, Yogi S. Bioactive naphthoquinone derivatives from Diospyros maritime Blume [J]. Chem Pharm Bull, 1998, 46(7): 1189-1193. |
| [41] | Dunstan C A, Liu B, Welch C J, et al. Alphitol, a phenolic substance from Alphitonia zizyphoides which inhibits prostaglandin biosynthesis in vitro [J]. Phytochemistry, 1998, 48(3): 495-497. |
| [42] | Min B, Lee G I, Ha J Y, et al. Inhibitory effects of triterpenoids on interleukin- 8/CINC-1 induction in LPS-stimulated rat peritoneal macrophages [J]. Nat Prod Sci, 1996, 2(1): 48-55. |
| [43] | Ha J Y, Min K R, Kang S H, et al. Suppressive effects of triterpenoids on CINC-1 induction in interleukin-1b- stimulated rat fibroblast NRK-49F cells [J]. Arch Pharm Res, 1997, 20(3): 234- 238. |
| [44] | Mukherjee P K, Saha K, Das J, et al. Studies on the anti-inflammatory activity of rhizomes of Nelumbo nucifera [J]. Planta Med, 1997, 63(4): 367-369. |
| [45] | Manez S, Recio M C, Giner R M, et al. Effect of selected triterpenoids on chronic dermal inflammation [J]. Eur J Pharmacol, 1997, 334(1): 103-105. |
| [46] | Huguet A I, Recio M C, Manez S, et al. Effect of triterpenoids on the inflammation induced by protein kinaseCactivators, neuronally acting irritants and other agents [J]. Eur J Pharmacol, 2000, 410(1): 69-81. |
| [47] | Chang C W, Wang J P, Wu P P, et al. Terpenoids from Ocium basilicum [J]. Chin Pharm J, 1999, 51(2): 181-189. |
| [48] | Krogh R, Kroth R, Berti C, et al. Isolation and identification of compounds with antinociceptive action from Ipomoea pes-caprae (L.) R. Br [J]. Pharmazie, 1999, 54(6): 464-466. |
| [49] | Ryu S Y, Oak M H, Yoon S K, et al. Anti-allergic and anti-inflammatory triterpenes from the herb of Prunella vulgaris [J]. Planta Med, 2000, 66(4): 358-360. |
| [50] | Yamashita K, Lu H, Lu J, et al. Effects of three triterpenoids, lupeol, betulin, and betulinic acid on the stimulus-induced superoxide generation and tyrosyl phosphorylation of proteins in human neutrophils [J]. Clin Chim Acta, 2002, 325(1/2): 91-96. |
| [51] | Schuhly W, Heilmann J, Calis I, et al. New triterpenoids with antibacterial activity from Zizyphus joazeiro [J]. Planta Med, 1999, 65(8): 740-743. |
| [52] | Shai L, McGaw L J, Aderogba M, et al. Four pentacyclic triterpenoids with antifungal and antibacterial activity from Curtisia dentata (Burm. f) C. A. Sm. leaves [J]. J Ethnopharma, 2008, 119(2): 238-244. |
| [53] | Stephane F, Marion G, Josephine M, et al. Ursolic, oleanolic and betulinic acids: Antibacterial spectra and selectivity indexes [J]. J Ethnopharma, 2008, 120(2): 272-276. |
| [54] | Alakurtti S, Makela T, Koskimies S, et al. Pharmacological properties of the ubiquitous natural product betulin [J]. Eur J Pharm Sci, 2006, 29(1): 1-13. |
| [55] | Enwerem N M, Okogun J I, Wambebe C O, et al. Antihelmintic activity of the stem bark extracts of Berlina grandiflora and one of its active principles, betulinic acid [J]. Phytomedicine, 2001, 8(2): 112-114. |
| [56] | Steele J C P, Warhust D C, Kirby G C, et al. In vitro and in vivo evaluation of betulinic acid as an antimalarial [J]. Phytother Res, 1999, 13(2): 115-119. |
| [57] | Kanamoto T, Kashiwada Y, Kanbara K, et al. Anti-human immunodeficiency virus activity of YK-FH312 (a betulinic acid derivative), a novel compound blocking viral maturation [J]. Antimicrob Agents Chemther, 2001, 45(4): 1225-1230. |
| [58] | Hess S C, Brum R L, Honda N K, et al. Antibacterial activity and phytochemical analysis of Vochysia divergens (Vochysiaceae) [J]. J Ethnopharmacol, 1995, 47(2): 97-100. |
| [59] | Ruta M, Kristine S, Juris R, et al. Betulin binds to γ-aminobutyric acid receptors and exerts anticonvulsant action in mice [J]. Pharmacol Biochem Behav, 2008, 90(4): 712-716. |
| [60] | Channa S, Dar A, Yaqoob M, et al. Broncho-vasodilatory activity of fractions and pure constituents isolated from Bacopa monniera [J]. J Ethnopharmacol, 2003, 86(1): 27-33. |
 2014, Vol. 45
2014, Vol. 45


