2. 河南科技大学林学院, 河南 洛阳 471003
2. College of Forestry, Henan University of Science and Technology, Luoyang 471003, China
芍药Paeonia lactiflora Pall. 为芍药科芍药属芍药组多年生宿根草本植物,除具观赏价值外,芍药还有重要的药用价值,是我国传统常用中药材[1]。根据加工方式的差别,可将其分为赤芍和白芍,赤芍Paeoniae Rubra Radix为芍药或川赤芍Paeonia veitchii Lynch的干燥根,白芍Paeoniae Alba Radix为芍药栽培品种去皮水煮后的干燥根[2]。二者均含有芍药苷(paeoniflorin)、芍药内酯苷(albiflorin)、羟基芍药苷(oxypaeoniflorin)、苯甲酰芍药苷(benzoylpaeoniflorin)等双环单萜类蒎烯型化合物[3]。芍药苷是赤芍和白芍中具药用价值的主要药效成分,也是其质量指标成分[2],具有免疫调节、镇痛、镇静、解痉、保肝、扩张血管和抗炎等作用[4]。芍药苷在芍药各部位分布差异明显,在芍药根中富含芍药苷[5],根或根茎是《中国药典》2010年版中规定的能够加工为赤芍或白芍的原料[2]。研究表明芍药苷在芍药新鲜的叶和茎中已经存在,推测芍药苷在叶中就已合成,之后经茎运向根部[5]。对芍药苷的量与采收时期及采收部位关系的研究已较为深入[5,6],但由于芍药背景复杂,兼之其基础研究较为薄弱,芍药苷的生物合成及其分子调控机制还知之甚少,亟需应用现代分子生物学手段探明其机制。
肌动蛋白(Actin)是真核生物细胞中普遍存在的一种重要的蛋白质,构成细胞骨架中的微丝系统,参与真核生物细胞的许多重要的生命活动[7]。迄今为止,已相继从百合[8]、桑树[9]、刺五加[10]、芍药[11]等高等植物中克隆出Actin cDNA。Actin表达量大且基本恒定,因此在功能基因的表达分析时常作为内标基因,已应用于茶树[12]、黄瓜[13]、猕猴桃[14]、普通菜豆[15]等多种高等植物功能基因的表达分析研究中。尽管本课题组已经克隆了芍药Actin cDNA,但芍药Actin基因结构仍然未知,无法设计出跨越内含子的半定量RT-PCR扩增引物,从而避免由DNA污染而造成的RT-PCR扩增假阳性[16,17]。鉴于此,本研究克隆了芍药Actin基因组DNA序列并分析了基因结构,设计了一对RT-PCR扩增引物,其中上游引物跨越了芍药肌动蛋白第1个内含子序列,对Actin基因在芍药不同组织中的表达进行了半定量分析,评价了其作为内标基因的可行性,从而为下一步研究芍药重要功能基因的表达奠定了基础。 1 材料与试剂 1.1材料
芍药栽培品种“桃花飞雪”根、茎、叶、花等新鲜样品采自洛阳市土桥花木种苗有限公司,由卫志鹏业务经理进行品种鉴定,清洗后液氮保存带回实验室,立即置于-80℃冰箱备用;大肠杆菌DH5α菌株由本实验室提供。 1.2 试剂
高保真KOD-Plus DNA聚合酶购自日本TOYOBO公司;DNA凝胶回收试剂盒、克隆载体pMD18-T、质粒提取试剂盒、限制性内切酶BamH I和Hind III购自宝生物工程(大连)有限公司,其余试剂均为进口或国产分析纯。 2 方法 2.1 芍药总DNA提取
采用改良CTAB法提取芍药根基因组总DNA[18],将总DNA质量浓度调至50 ng/μL。 2.2 引物合成
基于本实验室克隆的芍药肌动蛋白cDNA序列(JX310002),利用Primer Premier 5.0软件设计一对特异性PCR扩增引物5’-CGCGGATCCATGGCCGATG-CTGAGGATATCC-3’和5’-CCCAAGCTTTTAAAA-GCACTTCCTGTGGACA-3’,上下游引物分别插入了BamH I和Hind III酶切位点,用于对克隆的阳性重组子进行双酶切鉴定,引物序列由北京华大基因研究中心合成。 2.3 芍药Actin基因的PCR扩增
50 μL PCR扩增体系中含5 μL 10×缓冲液、5 μL 2.0 mmol/L each dNTP、4 μL 25 mmol/L MgCl2、1.5 μL 10 pmol/μL上下游引物、2.5 μL DNA、1 μL KOD-Plus DNA聚合酶、29.5 μL ddH2O。PCR扩增程序为94 ℃预变性2 min,98 ℃ 变性10 s,55 ℃ 退火30 s,68 ℃ 延伸1 min,共35个循环。 2.4 芍药Actin基因PCR产物的回收、克隆
用DNA凝胶回收试剂盒纯化回收芍药Actin基因PCR产物,在对其3’末端加A[19]后与克隆载体pMD 18-T连接,连接产物转化大肠杆菌DH5α感受态细胞,过夜培养后进行菌落PCR初筛,质粒PCR筛选和BamH I和Hind III双酶切进一步鉴定,将阳性重组子送至北京华大基因研究中心测序。 2.5 芍药Actin基因结构分析
应用在线的Augustus软件[20](http://bioinf.uni-gre-ifswald. de/augustus/)对芍药Actin基因的外显子和内含子进行初步预测;应用在线的Blastn双序列比对软件对(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对芍药Actin cDNA序列(JX310002)和基因组DNA序列(KF363830)进行双序列比对,人工分析剪接位点供位、受位与识别序列等信息,分析芍药Actin的基因结构。 2.6 序列同源性分析及分子进化树构建
利用NCBI(http://www.ncbi.nlm.nih.gov/)Blastn程序在核苷酸水平上对芍药肌动蛋白进行序列同源性分析;使用MEGA 5.0软件构建分子系统进化树。 2.7 半定量RT-PCR表达分析
基于克隆的芍药肌动动蛋白基因组DNA序列(KF363830),设计一对特异性PCR扩增引物5’-GGAATGGTCAAGGCTGGTTT-3’及5’-TTCTC- TGTTGGCTTTGGGGT-3’用于半定量RT-PCR分析,其中上游引物跨越了芍药Actin基因的第1个内含子,引物序列由北京华大基因研究中心合成。
分别提取芍药“桃花飞雪”根、茎、叶、花等不同组织总RNA[21],以等量的RNA反转录为cDNA,取等量cDNA进行半定量RT-PCR扩增。PCR反应体系及PCR扩增程序参照本实验室的方法进行[11]。 3 结果与分析 3.1 芍药Actin基因的PCR扩增
以芍药“桃花飞雪”芍药基因组总DNA为模板,成功扩增出了大小约1 400 bp的PCR产物(图 1)。
 |
图 1 芍药Actin基因的PCR扩增产物
Fig. 1 PCR amplification products of Actin gene of P. lactiflora
1,2-Actin基因PCR产物 1,2-PCR products of Actin gene |
PCR产物经纯化回收、加A后与克隆载体pMD18-T连接,连接产物转化DH5α感受态细胞,菌落PCR初筛;挑取阳性重组子进行过夜培养,用Takara公司的小提质粒试剂盒提取质粒,质粒PCR鉴定结果表明扩增产物与预测大小相同(图 2),BamH I和Hind III双酶切鉴定结果表明酶切片段大小与预期结果一致(图 3),表明克隆成功,将鉴定的阳性重组子质粒送至北京华大基因研究中心进行测序。
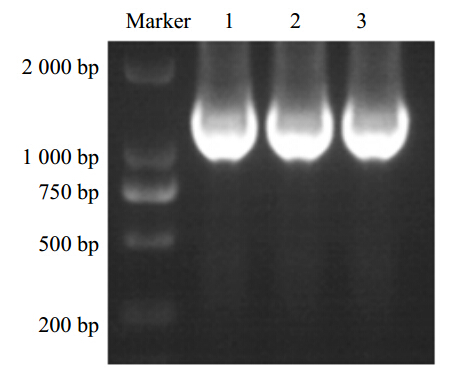 | 图 2 质粒PCR鉴定重组子Fig. 2 Characterization of recombinants by plasmid PCR
1~3-质粒PCR 产物 1—3-plasmid PCR products |
 | 图 3 双酶切鉴定重组子Fig. 3 Characterization of recombinant by double enzyme digestion
1-BamH I 和Hind III 双酶切产物 1-Double digestion products by BamH I and Hind III |
结果表明芍药Actin基因组DNA全长1 405 bp,Augustus在线分析及Blastn双序列分析结果表明芍药Actin基因共含4个外显子和3个内含子;4个外显子的核苷酸序列与本实验分离的芍药Actin cDNA序列(JX310002)完全一致;3个内含子中每个供位与受位共6个剪接位点均遵循高等真核生物5’端供位GU与3’端受位AG模式[22];4个外显子区域为1~60、172~565、650~1 263和1 340~1 405,3个内含子区域为61~171、566~649和1 264~1 339;共编码377个氨基酸(图 4),GenBank登录号为KF363830。
 | 图 4 芍药Actin基因结构及编码的氨基酸序列Fig. 4 Nucleotide sequences of Actin gene and its encoded amino acids in P. lactiflora |
Blastn分析结果表明芍药Actin基因组DNA序列(KF363830)与多种高等植物的Actin基因具有很高的同源性,其中与“红艳争辉”芍药的Actin基因(JN225878)同源性高达99%,二者外显子核苷酸序列仅有3个碱基的差异,但后者仅含有2个内含子,而缺失了长度为111 bp的第1个内含子;与来自拟南芥、桑、毛果杨、大豆、葡萄及棉属多种植物的Actin相似性达83%以上,表明高等植物的Actin在DNA水平上具有较高的保守性。应用MEGA5.0软件对同源性较高的近缘植物的肌动蛋白跨越起始密码子ATG和终止密码子TAA的编码区进行多序列比对并构建分子系统进化树(图 5),结果表明“桃花飞雪”芍药Actin基因与“红艳争辉”芍药Actin基因(JN225878)亲缘关系最近,与桑(Morus alba L.,HM623866)、葡萄(Vitis vinifera L.,AM465189)、大豆 [Glycine max (L.) Merrill,V00450] Actin基因具有相对较近的亲缘关系,与毛果杨(Populus trichocarpa Torr. & Gray,EF418792)、小果白刺(Nitraria sibirica Pall.,AB636284)、拟南芥 [Arabidopsis thaliana (L.) Heynh,ATU41998、ATU42007] Actin基因组成的小进化群体亲缘关系较远,但是由棉属多个物种包括黄褐棉(Gossypium mustelinum Miers ex Watt,JF722026、JF722027)、陆地棉(Gossypium hirsutum L.,JF722036、HQ142999)、海岛棉(Gossypium darwinii Watt,JF722029)、雷蒙德氏棉(Gossypium raimondii Ulbrich,HQ142996)、拟似棉(Gossypium barbadense L.,JF722034、HQ142997、HQ142998)、毛棉(Gossypium tomentosum Nuttall ex Seemann,JF722030、JF722031)、达尔文氏棉[Gossypium gossypioides (Ulbrich) Standley,JF722043]、哈克尼西棉 [Gossypium harknessii Brandegee,JF722039]、辣根棉 [Gossypium armourianum Kearn,JF722038]的Actin基因都相对集中地分布在小进化群中,说明棉属植物Actin基因之间的进化可能只是在少数核苷酸产生了突变。由于生理功能的重要性,Actin在自然选择过程中承受着巨大选择压力,因而核苷酸序列表现出高度保守[8]。
 | 图 5 Actin基因的分子系统进化树 Fig. 5 Molecular phylogenetic tree of Actin gene |
基于克隆的芍药肌动蛋白基因组DNA序列(KF363830)设计了一对半定量RT-PCR扩增引物,PCR扩增产物大小约为309个碱基;其中上游引物跨越了第1个内含子,可以有效防止由DNA污染而造成的RT-PCR扩增结果的假阳性。半定量RT-PCR分析表明,Actin基因在芍药根、茎、叶、花中的表达量一致(图 6);因此Actin基因能够作为芍药功能基因半定量RT-PCR或荧光定量PCR分析的内参基因。
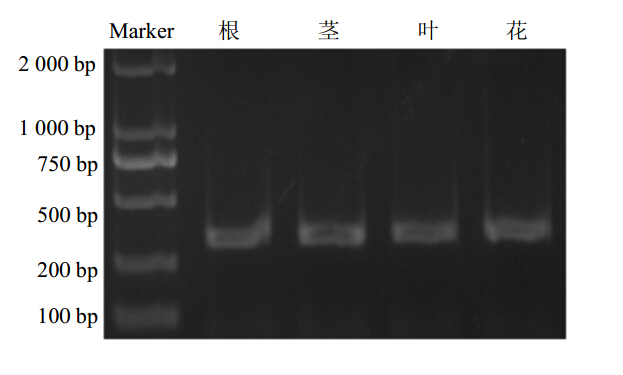 | 图 6 Actin基因在芍药不同组织中的表达Fig. 6 Expression levels of Actin in different organs |
芍药苷属于单萜糖苷,其生物合成通过位于细胞质中的甲羟戊酸(mevalonate pathway,MVA)途径[23]和位于质体中的脱氧木酮糖-5-磷酸途径(1-deoxy-D-xylulose-5-phosphate pathway,DXP)[24]或甲基赤藓醇-4-磷酸途径(methylerythritol-4-phos-
phate pathway,MEP)两个代谢途径独立合成。其代谢过程可分为中间体异戊烯基焦磷酸(isopentenylpyrophosphate,IPP,C5)及其双键异构体二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP,C5)的生成、直接前体物质的生成和萜类生成及修饰共3个阶段[25]。高等植物体内IPP形成后,即与其异构体DMAPP各1分子在牻牛儿基二磷酸合酶(geranyl diphosphate synthase,GPPS)的作用下经头尾缩合生成具C10骨架的牻牛儿基二磷酸(geranyl diphosphate,GPP);GPP 在单萜烯合酶(monoterpene synthase)作用下生成单萜烯(monoterpene,C10)[26,27],进一步在修饰酶的作用下生成芍药苷。在本研究中,本实验克隆了芍药Actin基因的基因组序列,分析了其基因结构,设计了跨越内含子的半定量RT-PCR引物,可以有效防止由DNA污染而造成的RT-PCR假阳性;半定量RT-PCR分析结果表明Actin基因可以作为芍药功能基因表达分析的内标基因。下一步本课题组将基于课题组已完成的芍药转录组测序数据,对参与芍药苷代谢的候选基因进行半定量和定量表达分析,以期为阐明芍药苷的代谢及分子调控奠定基础。
| [1] | 李嘉珏. 中国牡丹与芍药 [M]. 北京: 中国林业出版社, 1999. |
| [2] | 中国药典 [S]. 一部. 2010. |
| [3] | 李玉东, 刁 勇, 王立强. 芍药及其有效成分抗肿瘤作用的研究进展 [J]. 海峡药学, 2009, 21(12): 27-32. |
| [4] | 康晓飞, 郭先锋, 许世磊, 等. 三个观赏芍药芍药苷含量的动态变化研究 [J]. 北方园艺, 2011(5): 85-87. |
| [5] | 简在友, 俞敬波, 王文全. 芍药不同部位和不同采收期6个化学活性成分含量的比较 [J]. 药学学报, 2010, 45(4): 489-493. |
| [6] | 李越峰, 严兴科. 赤芍和白芍不同部位芍药苷和苯甲酸的含量分析研究 [J]. 时珍国医国药, 2012, 23(3): 519-520. |
| [7] | 陈 颖, 王 刚, 赵俊霞. 高等植物体内的肌动蛋白 [J]. 生物学通报, 2003, 38(1): 13-15. |
| [8] | 梁 云, 袁素霞, 冯慧颖, 等. 百合肌动蛋白基因lilyActin的克隆与表达分析 [J]. 园艺学报, 2013, 40(7): 1318-1326. |
| [9] | 李 军, 赵爱春, 王茜龄, 等. 三个桑树肌动蛋白基因的克隆与组织表达分析 [J]. 作物学报, 2011, 37(4): 641-649. |
| [10] | 邢朝斌, 龙月红, 修乐山, 等. 刺五加肌动蛋白基因的克隆和表达稳定性分析 [J]. 中草药, 2013, 44(13): 1819-1822. |
| [11] | 范丙友, 李 芳, 张文婷, 等. 芍药肌动蛋白基因的克隆及表达分析 [J]. 中草药, 2013, 44(15): 2136-2142. |
| [12] | 孙美莲, 王云生, 杨冬青, 等. 茶树实时荧光定量PCR分析中内参基因的选择 [J]. 植物学报, 2010, 45(5): 579-587. |
| [13] | 张婧妹, 茆振川, 刘 峰, 等. 黄瓜根结RDR 酶基因的分离与表达分析 [J]. 园艺学报, 2011, 38(10): 1911-1920. |
| [14] | 张 波, 徐昌杰, 陈昆松. 猕猴桃6个LOX基因家族成员实时定量PCR引物特异性的检测与应用 [J]. 中国生物化学与分子生物学报, 2008, 24(3): 262-267. |
| [15] | 陈吉宝, 景蕊莲, 毛新国, 等. 普通菜豆PvP5CS2基因对逆境胁迫的应答 [J]. 作物学报, 2008, 34(7): 1121-1127. |
| [16] | 焦莎莎, 刘 卡, 李 刚, 等. 绵羊MHC 区段3个预测基因的验证与表达分析 [J]. 遗传, 2011, 33(12): 1353-1358. |
| [17] | 李凤娥, 熊远著, 雷明刚, 等. 猪ESR mRNA在不同组织表达的定量研究 [J]. 华中农业大学学报, 2004, 23(5): 492-494. |
| [18] | Doyle J J, Doyle J L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue [J]. Phytochemical Bull, 1987, 19: 11-15. |
| [19] | 范丙友, 高水平, 侯小改, 等. Col生态型拟南芥AP3基因启动子克隆及植物表达载体构建 [J]. 基因组学与应用生物学, 2011, 30(1): 21-16. |
| [20] | Stanke M, Morgenstern B. AUGUSTUS: a web server for gene prediction in eukaryotes that allows user-defined constraints [J]. Nucleic Acids Res, 2005, 33: W465-W467. |
| [21] | Gasic K, Hernandez A, Korban S S. RNA extraction from different apple tissues rich in polyphenols and polysaccharides for cDNA library construction [J]. Plant Mol Biol Rep, 2004, 22: 437a-437g. |
| [22] | Reddy A. Alternative splicing of pre-messenger RNAs in plants in the genomic era [J]. Annu Rev Plant Biol, 2007, 58: 267-294. |
| [23] | Chappell J, Wolf F, Proulx J, et al. Is the reaction catalysed by 3-hydroxy-3-methylglutaryl coenzyme A reductase a rate-limiting step for isoprenoid biosynthesis in plants? [J] Plant Physiol, 1995, 109(4): 1337-1343. |
| [24] | Rohmer M, Knani M, Simonin P, et al. Isoprenoid biosynthesis in bacteria: a novel pathway for the early steps leading to isopentenyl diphosphate [J]. Biochem J, 1993, 295: 517-524. |
| [25] | Yuan Y, Yu J, Jiang C, et al. Functional diversity of genes for the biosynthesis of paeoniflorin and its derivatives in Paeonia [J]. Int J Mol Sci, 2013, 14: 18502-18519. |
| [26] | 张长波, 孙红霞, 巩中军, 等. 植物萜类化合物的天然合成途径及其相关合酶 [J]. 植物生理学通讯, 2007, 43(4): 779-786. |
| [27] | 王 莉, 史玲玲, 张艳霞, 等. 植物次生代谢物途径及其研究进展 [J]. 武汉植物学研究, 2007, 25(5): 500-508. |
 2014, Vol. 45
2014, Vol. 45


