2. 赣南医学院第一附属医院, 江西 赣州 341000
2. The First Affiliated Hospital of Gannan Medical University, Ganzhou 341000, China
苦参素(oxymatrine)是豆科植物苦参Sophora flavescents Ait. 的生物碱提取物,是苦参的主要药效成分,其中含氧化苦参碱高达98%,以往研究证实,苦参素具有调节免疫、抗炎、抑菌、抗心律失常、抗病毒、抗纤维化和抗肿瘤等多重功效[1,2,3,4]。目前关于苦参素治疗肝纤维化的研究较多,但是对于其治疗肝纤维化的分子机制方面的研究还比较少。本课题组在前期工作的基础上,选择肝星状细胞HSC-T6为研究模型,探讨不同质量浓度的苦参素对肝星状细胞凋亡、端粒酶及其催化亚单位端粒酶逆转录酶(rTERT)mRNA表达的影响,以初步探讨苦参素抑制肝星状细胞生长的作用机制,旨在为苦参素治疗肝纤维化提供新的理论依据。
1 材料 1.1 药品及试剂苦参素(含氧化苦参碱98%)购自武汉圣天宇科技有限公司,噻唑蓝(MTT)、硝酸银、焦碳酸二乙酯(DEPC)均购自美国Sigma公司;丙烯酰胺、N,N′-亚甲基丙烯酰胺、四甲基乙二胺(TEMED)购自华美公司;RT-PCR试剂盒购自MBI Fermentas公司;Trizol试剂购自Invitrogen公司;端粒酶活性检测试剂盒购自Roche公司;Annexin V-FITC Kit购自Gene Tech公司。
1.2 细胞株HSC-T6为SV40转染SD大鼠肝星状细胞而成为活化的肝星状细胞,购于中南大学湘雅中心实验室。
1.3 仪器MCO—175 CO2培养箱(日本Sanyo公司),IX71荧光倒置显微镜(日本Olympus公司),ABI9700型PCR扩增仪(美国ABI公司),XDS—1B型倒置生物显微镜(重庆光电仪器总公司),FACSCalibur流式细胞仪(美国Bectondickinson公司),InGenius LHR型凝胶成像分析系统(英国Syngene公司),酶标仪(美国Bio-TEK公司)。
2 方法 2.1 细胞培养将HSC-T6细胞接种于含100 U/mL青霉素、100 U/mL链霉素、10%胎牛血清的DMEM高糖培养液,在37 ℃、5% CO2及饱和湿度条件下培养,隔天换液,待细胞生长至密度为80%~90%时,开始传代。所有实验均采用对数生长期的细胞。
2.2 MTT比色法检测细胞生长抑制率HSC-T6细胞经胰酶消化,接种于96孔培养板,每孔100 μL培养液含2 000个细胞,培养24 h后弃培养液,每孔加入终质量浓度分别为2、4、6、8 mg/mL的苦参素培养液100 μL,对照组不加药,另设空白组(只加培养液,无细胞),每组8个复孔,重复4个批次,分别于培养后的24、48、72 h加入MTT(5 mg/L)10 μL,4 h后加入DMSO 150 μL/孔,避光振荡摇匀,以空白孔调零,在酶标仪上检测490 nm处的吸光度(A)值,计算细胞生长抑制率。
生长抑制率=1-A实验组 / A对照组
2.3 细胞凋亡的检测取1×108/L的细胞悬液接种于6孔培养板,每孔加细胞悬液2.0 mL,培养24 h后弃培养液,加入终质量浓度分别为2、4、8 mg/mL的苦参素新鲜培养液2.0 mL,同时设不加药物的对照组,培养24、48 h后收集细胞。采用Annexin V-PI双染色法检测细胞凋亡。用冷PBS洗涤细胞(4 ℃,500 r/min离心5 min),去除上清后用冷的结合缓冲液调整细胞数为1×108~1×109/L。取此细胞悬液100 μL,加入5 μL Annexin V-FITC溶液和2.5 μL碘化丙啶(PI)溶液。于冰上避光孵育10 min,加入150 μL冷的结合缓冲液。1 h内用流式细胞仪检测暴露在细胞表面的磷脂酰丝氨酸(PS),所有数据经WinMDI软件收集分析。
2.4 TRAP-PAGE银染法检测端粒酶活性细胞处理同“2.3”项,收集细胞(1×108/L)4 ℃,6 500 r/min离心5 min以形成细胞团。去除上清液,用PBS重悬细胞并重复离心步骤。加入200 μL裂解液重悬细胞小团,冰上预冷并充分混匀,于冰上孵育30 min。4 ℃,15 000 r/min离心20 min,将上清(约170 μL)移至另一洁净的Eppendorf管中,-80 ℃保存备用或即用。取上述提取液3 μL加入25 μL扩增液,用无菌三蒸水补足体积至50 μL,加40 μL灭菌石蜡油覆盖,在PCR扩增仪上运行,25 ℃、30 min引物延伸;94 ℃、5 min端粒酶灭活;扩增反应,94 ℃、30 s,50 ℃、30 s,72 ℃、90 s,30个循环,72 ℃平衡10 min。
取PCR反应产物10 μL,进行12%非变性聚丙烯酰胺凝胶电泳,电压180 V,1 h左右,银染。当出现相隔6 bp的梯形条带即为端粒酶活性阳性。InGenius LHR型凝胶成像分析系统分析,用各泳道灰度减阴性对照的灰度后与对照组灰度的比值作为端粒酶活性的相对值。
2.5 RT-PCR法检测端粒酶rTERT mRNA的表达细胞处理同“2.3”项,收集细胞,抽提总RNA:用不含小牛血清的DMEM高糖培养液洗涤收集的HSC-T6细胞2次,计数1×106个细胞,Eppendorf管离心沉淀后加Trizol试剂1 μL,抽提总RNA。cDNA链合成:按逆转录试剂盒说明书操作。终体积20 μL,其中总RNA 4 μL,随机引物1 μL,5×缓冲液4 μL,核糖核酸酶抑制剂(RNasin)1 μL,10 mmol/L dNTP 2 μL,逆转录酶(ReverTra Ace)1 μL,ddH2O 7 μL。PCR扩增仪上运行,30 ℃、10 min,42 ℃、20 min,99 ℃、5 min;-20 ℃保存。扩增引物rTERT(5’-GCTAAATCCCTCATTCCTACT-3’,5’-TTCACCCTCCACATCAGTT-3’)和GAPDH(5’- TCAGGTCATCACTATCGGCAAT-3’,5’-GGATGT- CAACGTCACACTTCATG-3’),引物由上海生工生物工程技术服务有限公司合成。
PCR反应体系终体积为50 μL,含10×缓冲液5 μL,Mg2+ 3 μL,dNTPs 1 μL,cDNA 2 μL,上下游引物各1.5 μL(20 μmo1/L),Taq酶2 μL,取10 μL扩增产物2%琼脂糖凝胶电泳(电压8 V/cm,电流20 mA,时间30 min),用InGenius LHR型凝胶成像分析系统分析,将各泳道灰度减去阴性对照后与GAPDH条带灰度的比值作为rTERT mRNA的相对活性值。
2.6 统计学分析数据均以x±s表示,用SPSS 18.0软件对数据进行统计分析,先进行方差齐性检验,如果方差齐性,进行单因素方差分析(ANVOA),认为双侧P<0.05为差异有统计学意义,其中两两比较选用最小显著差异法(LSD)。
3 结果 3.1 对HSC-T6细胞生长的抑制作用不同质量浓度苦参素分别作用HSC-T6细胞24、48、72 h,以生长抑制率为纵坐标,时间为横坐标绘制生长曲线,结果作用24、48、72 h的直线回归方程分别为Y=0.565 6-0.021 7 X(r2=0.985 9)、Y=0.857 2-0.040 9 X(r2=0.989 8)、Y=0.953 2-0.055 8 X(r2=0.989 7)。随着苦参素质量浓度的增加,细胞生长抑制率逐渐升高,表明苦参素对HSC-T6细胞生长的抑制作用有显著的浓度依赖性。作用24、48、72 h的IC50分别为12.95、10.41、8.36 mg/mL,结果见表 1。
| 表 1 苦参素对HSC-T6细胞生长的抑制作用 (x±s,n=4) Table 1 Inhibition of oxymatrine on growth of HSC-T6 cells (x±s,n=4) |
终质量浓度为2、4、8 mg/mL的苦参素与HSC-T6细胞共培养24 h后,Annexin V-PI双染色,流式细胞术检测细胞凋亡。结果显示,随着质量浓度的增加,苦参素诱导HSC-T6细胞凋亡的作用呈上升趋势,表明苦参素诱导HSC-T6细胞凋亡具有浓度依赖性,结果见表 2。
| 表 2 苦参素对HSC-T6细胞凋亡的影响 (x±s,n=4) Table 2 Effect of oxymatrine on apoptosis of HSC-T6 cells (x±s,n=4) |
不同质量浓度苦参素作用不同时间后,随着苦参素质量浓度的增加和共培养时间的延长,端粒酶活性的银染条带逐渐减弱。表明苦参素对HSC-T6细胞端粒酶活性的抑制作用与其作用质量浓度和时间有依赖关系,结果见表 3。
| 表 3 苦参素对HSC-T6细胞端粒酶活性的影响 (x±s,n=4) Table 3 Effect of oxymatrine on activity of telomerase in HSC-T6 cells (x±s,n=4) |
凝胶成像可见HSC-T6细胞rTERT mRNA表达随苦参素质量浓度的升高及作用时间的延长而减弱(图 1)。结果显示,相同的作用时间,4、6 mg/mL苦参素作用细胞后,rTERT mRNA的表达较对照组减弱(P<0.05);在相同质量浓度的苦参素作用下,48 h组的rTERT mRNA表达较24 h组减弱(P<0.05);表明苦参素对HSC-T6细胞rTERT mRNA表达的抑制作用呈浓度和时间依赖关系,结果见表 4。
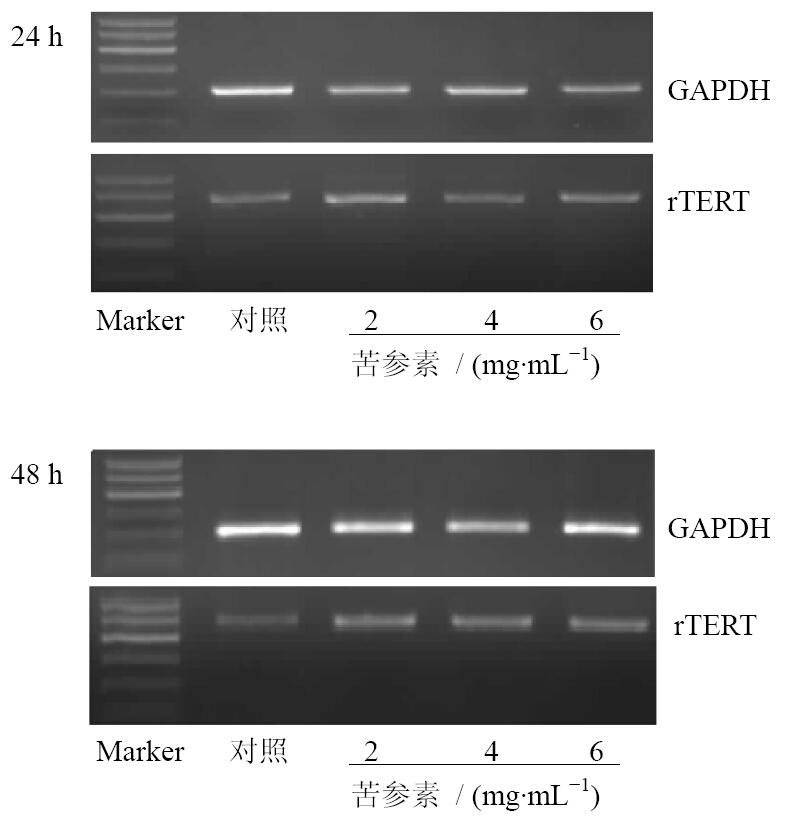
| 图 1 苦参素对HSC-T6细胞rTERT mRNA表达的影响 Fig.1 Effect of oxymatrine on rTERT mRNA expression of HSC-T6 cells |
| 表 4 苦参素对HSC-T6细胞rTERT mRNA相对表达量的影响 (x±s,n=4) Table 4 Effect of oxymatrine on relative expression of rTERT mRNA in HSC-T6 cells (x±s,n=4) |
肝星状细胞(HSCs)数量占肝脏细胞总数的15%,是肝脏纤维化过程中合成细胞外基质(ECM)的主要细胞类型。在肝脏受到损伤后肝细胞通过产生过氧化脂质以及释放一系列细胞因子,包括转化生长因子-β(TGF-β)、血小板衍生因子(PDGF)等,导致HSC被激活,活化的HSC(此时称为肌成纤维样细胞)合成ECM增加,并且成分也发生变化,从以合成I型胶原为主变为以合成致密的、不易降解的IV型胶原为主,从而导致ECM合成增加,降解减少,沉积在肝组织中,形成纤维化,甚至发展为肝硬化[5,6,7,8,9]。本研究显示,苦参素具有抑制HSC-T6细胞生长、诱导其凋亡的作用,该作用与苦参素抗肝纤维化药理作用相符[10]。有研究表明苦参素可以通过激活肝星状细胞的NGF/p75通路,下调核因子-κB(NF-κB)蛋白表达,上调Caspase-3蛋白表达,从而启动肝星状细胞的凋亡。
端粒的长度和端粒酶活性的调节对器官和组织的衰老、慢性疾病以及肿瘤的发生和进展起了关键作用。对肝脏而言,端粒的缩短限制了慢性肝病中肝细胞的再生,最终导致肝再生能力的耗竭和肝硬化及肝癌的形成。肝纤维化病变过程中,肝细胞端粒缩短,HSCs中的端粒却与之相反[11,12]。提示在肝纤维时HSCs端粒酶的活性较强。Schnabl等[13]发现激活的HSCs转染hTERT后,激活的HSCs会永生化,并且持续保持激活的表型。这就表明抑制HSCs内端粒酶的活性就很可能抑制HSCs的激活或生长,从而治疗肝纤维化。有研究发现,苦参素可抑制TGF-β1刺激的HSC-T6细胞内p38MAPK途径的激活,明显降低p38磷酸化水平;抑制TGF-β1刺激的HSC-T6细胞内TβRI、Smad2、Smad3蛋白的表达,上调Smad7的表达。苦参素可以通过抑制JAK/STAT途径的激活,降低炎症因子TNF-α和IL-6的表达,对抗败血症模型小鼠的肺损伤。在CCl4诱导的纤维化大鼠中,苦参素可以抑制Smad4的表达,抑制Kuffer细胞活化,并抑制旁分泌对肝星状细胞的刺激[3,14]。本研究发现HSC-T6与苦参素随着培养的浓度的增加,共培养时间的延长,端粒酶活性的银染条带也逐渐减弱直至消失,HSC-T6细胞端粒酶活性的抑制与苦参素的作用浓度和时间有依赖关系,且苦参素对HSC-T6细胞rTERT mRNA表达的抑制作用呈浓度和时间依赖关系,提示苦参素可作为一种有效的HSC-T6细胞端粒酶活性抑制剂,提示苦参素可能通过抑制端粒酶活性及其亚单位rTERT mRNA表达并最终诱导HSC-T6细胞凋亡。
| [1] | 张鸣号, 王秀玉, 何沿虹. 氧化苦参碱对感染性休克大鼠心肌组织细胞因子的影响 [J]. 中草药, 2012, 43(11): 2242-2246. |
| [2] | 缪永杰, 王君芬. 复方苦参注射液在晚期肿瘤患者联合化疗中的临床观察 [J]. 中草药, 2010, 41(3): 449-451. |
| [3] | 邓子煜. 苦参素抗大鼠肝纤维化作用及其分子机制 [D]. 合肥: 安徽医科大学, 2009. |
| [4] | 冯国梁. 苦参素的治疗作用研究进展 [J]. 疾病监测与控制, 2010, 4(4): 210-211. |
| [5] | Gressner A M. Transdifferentiation of hepatic stellate cells (Ito cells) to myofibroblasts: a key event in hepatic fibrogenesis [J]. Kidney Int Suppl, 1996, 54: S39-S45. |
| [6] | Faouzi S, Burckhardt B E, Hanson J C, et al. Anti-fas induces hepatic chemokines and promotes inflammation by an NF kappa-β-independence caspase-3-dependent pathway [J]. Biol Chem, 2001, 276(52): 49077-49082. |
| [7] | Begriche K, Igoudjil A, Pessayre D, et al. Mitochondrial dysfunction in NASH: causes, consequences and possible means to prevent it [J]. Mitochondrial, 2006, 6(1): 1-28. |
| [8] | Zhao G, Zhang Z Q, Zhang B, et al. Down-regulation of tTG expression by RNAi inhibits HSC proliferation and attenuates liver fibrosis [J]. Int J Clin Exp Pathol, 2011, 112(1): 233-243. |
| [9] | Brunati A M, Tibaldi E, Carraro A, et al. Cross-talk between PDGF and S1P signalling elucidates the inhibitory effect and potential antifibrotic action of the immunomodulator FTY720 in activated HSC-cultures [J]. Biochim Biophys Acta, 2008, 1783(3): 347-359. |
| [10] | 翁山耕, 胡雨云, 田雄英, 等. 苦参碱诱导大鼠肝星状细胞凋亡的体外研究 [J]. 福建医科大学学报, 2009, 43(6): 443-446. |
| [11] | Wiemann S U, Satyanarayana A, Tsahuridu M, et al. Hepatocyte telomere shortening and senescence are general markers of human liver cirrhosis [J]. Faseb J, 2002, 16(9): 935-942. |
| [12] | Autexier C, Lue N F. The structure and function of telomerase reverse transcriptase [J]. Annu Rev Biochem, 2006, 75: 493-517. |
| [13] | Schnabl B, Choi Y H, Olsen J C, et al. Immortal activated human hepatic stellate cells generated by ectopic telomerase expression [J]. Lab Invest, 2002, 82(3): 323-333. |
| [14] | Hu Y Y. Pay attention to the study on active antiliver fibrosis components of Chinese herbal medicine [J]. Chin J Integr Med, 2012, 18(3): 1-5. |
 2014, Vol. 45
2014, Vol. 45


