2. 江苏大学药学院, 江苏 镇江 212013
2. Department of Pharmaceutics, Jiangsu University, Zhenjiang 212013, China
我国拥有丰富、种类繁多的壮骨中药资源,中药成分相比化学药副作用小,但其具有复杂的药用形式,除单体化合物外,有效部位、提取物等均为由大量化学成分构成的复杂成分体系,为壮骨中药药效筛选带来了很多困难。斑马鱼与哺乳动物骨骼生长发育的分子机制高度相似,而且近年来越来越多的调节哺乳动物骨骼发育关键基因的同源基因在斑马鱼基因组中被发现[1],为建立斑马鱼骨质疏松、骨关节炎等模型提供了生理及遗传学依据[2,3]。本课题组用地塞米松和泼尼松龙诱导并建立斑马鱼骨质疏松模型,并用其验证依替膦酸二钠(etidronate disodium,Eti)、鲑鱼降钙素的抗骨质疏松活性[4,5]。该模型具有在体化、微板化,简单、高效的特点,其能否有效用于中药抗骨质疏松活性筛选,相关实验支持具有重要意义。
淫羊藿Epimedii Folium是一种传统知名的补肾壮骨中药,现代研究表明其对骨质疏松症的防治疗效确切,其中淫羊藿黄酮类成分是主要壮骨成分[6,7,8]。本研究选择朝鲜淫羊藿为代表中药,以泼尼松龙诱导的斑马鱼骨质疏松模型评价朝鲜淫羊藿提取物及其大孔树脂分离不同部位的抗骨质疏松活性,以探讨该模型用于中药抗骨质疏松活性筛选的合理性与适用性。
1 材料与仪器朝鲜淫羊藿(亳州市千草药业饮片厂提供,批号20080829),经南京中医药大学吴德康教授鉴定为朝鲜淫羊藿Epimedium koreanum Nakai的干燥叶;淫羊藿苷(中国食品药品检定研究院,批号110737-200415);朝藿定A、B、C和宝藿苷I(自制[9,10],经HPLC检测质量分数均≥98%);泼尼松龙(苏州亚科化学试剂股份有限公司,批号YK2012020101);依替膦酸二钠(中国食品药品检定研究院,批号 101174-201001);二甲基亚砜(DMSO,国药集团化学试剂有限公司,批号20120331);多聚甲醛(成都市科龙化工试剂厂,批号20100504);间氨基苯甲酸乙酯甲磺酸盐(MS-222,Acros Organics,批号A0288328);茜素红S(郑州四季化工产品有限公司,批号Sj20110806);D-101大孔吸附树脂(天津农药股份有限公司树脂分公司);水为Milli-Q system高纯水(Millipore,Bedford,MA,美国);乙腈为色谱纯(德国Merck公司),其余试剂均为分析纯。
ZEISS荧光倒置显微镜AxioVision Rel 4.8(蔡司光学仪器国际贸易有限公司);生化培养箱SPX—80(宁波海曙赛褔实验仪器厂);Image Pro Plus 6.0专业图像分析软件(美国Media Cybernetics公司);Agilent 1100型系列高效液相色谱仪(美国安捷伦公司)。
斑马鱼成鱼由南京大学模式动物研究所提供,来自德国tuebingen品系。
2 方法 2.1 药物溶液的配制2 500 μmol/L泼尼松龙储备液配制:精密称取泼尼松龙9.13 mg,加入DMSO 1.5 mL,用培养基[4]稀释并定容至10 mL,即得。
25 μmol/L泼尼松龙溶液配制:取2 500 μmol/L泼尼松龙储备液0.5 mL,加入适量DMSO后,用培养基稀释并定容至50 mL,得25 μmol/L泼尼松龙溶液。
朝鲜淫羊藿总提取物(以下简称总提物):称取朝鲜淫羊藿药材100 g,用80%乙醇提取2次,每次3 h,滤过合并提取液,回收乙醇并浓缩至100 mL,即得到生药1 g/mL总提物,备用。临用前配制成含25 μmol/L泼尼松龙的生药0.1、1.0、10.0、100.0 μg/mL的总提物溶液,各溶液均含0.5% DMSO。
总提物的大孔树脂分离部位(以下简称分离部位)制备:取适量D-101树脂装柱,先用95%乙醇冲洗,再用纯水冲洗至无醇味,上样5 mL总提物(相当于5 g生药),依次用水及30%、50%、70%、90%乙醇洗脱,每个梯度冲5个柱体积,分别接收各部分的溶液,浓缩至无醇味。临用前,将水及30%、50%、70%、90%乙醇洗脱部位分别用培养基配制成含25 μmol/L泼尼松龙的1.0、10.0、100.0、1 000.0 μg/mL溶液(质量浓度以生药计),各溶液均含0.5% DMSO。
2.2 总提物及分离部位的色谱分析色谱条件:Zorbax Extend-C18色谱柱(250 mm×4.6 mm,5 μm,Agilent)和C18预柱(12.5 mm×4.6mm,5 μm);流动相为乙腈(A)-水(B),梯度洗脱程序:0~10 min,10%~23% A;10~35 min 23%~26% A;35~65 min,26%~48% A;65~80 min,48%~80% A;80~85 min,80%~100% A;85~90 min,100% A;进样量20 μL;柱温25 ℃;体积流量1.0 mL/min;检测波长272 nm;运行时间90 min。
总提物及分离部位供试液:取“2.1”项下1.0 g/mL的总提物适量以及水和30%、50%、70%、90%乙醇分离部位,用90%甲醇分别配制成相当于生药0.01 g/mL的供试液,进样20 μL进行色谱分析。
2.3 朝鲜淫羊藿对泼尼松龙诱导的斑马鱼骨质疏松防治作用取受精后4 d斑马鱼幼鱼置24孔板,随机分为对照组(0.5% DMSO),泼尼松龙(25 μmol/L)模型组,含25 μmol/L泼尼松龙的依替膦酸二钠阳性对照组,含25 μmol/L泼尼松龙的总提物(生药0.1、1.0、10.0、100.0 μg/mL)组,含25 μmol/L泼尼松龙的水和30%、50%、70%、90%乙醇分离部位(生药1.0、10.0、100.0、1 000.0 μg/mL)组,每组设3个孔,每孔6条幼鱼。28.5 ℃恒温培养,每天换药,培养至受精后9 d,将各组斑马鱼用MS-222麻醉处死,多聚甲醛固定后进行茜素红染色,用ZEISS荧光倒置显微镜采集图像,用专业图像处理软件Image Pro Plus 6.0计算骨骼染色面积和累积光密度,进行骨矿化定量分析。
2.4 数据分析统计分析应用SPSS 16.0软件,数据以x±s表示,采用One-Way ANOVA分析。各组间两两比较采用LSD法,P<0.05为有统计学差异。
3 结果与分析 3.1 HPLC色谱分析结果总提物及分离部位的HPLC色谱图见图 1。根据已知文献结合部分对照品对照[11,12],推测30%乙醇部位以非黄酮类成分为主,如木脂素类及9,10-二氢菲类成分,50%乙醇洗脱部位以二糖和三糖的黄酮苷类成分为主,如朝藿定A、朝藿定B、朝藿定C和淫羊藿苷,70%乙醇部位以单糖和二糖的黄酮苷类为主,如宝藿苷I,90%乙醇部位则以单糖的黄酮苷类为主。
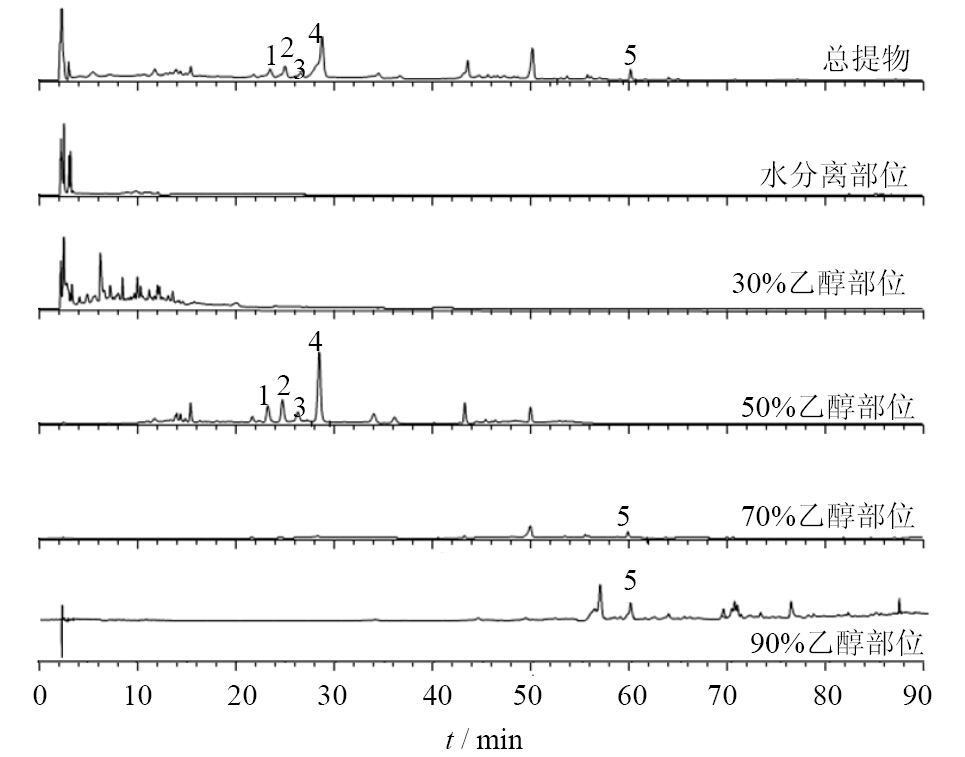
|
图 1 朝鲜淫羊藿总提物及分离部位HPLC色谱图
Fig.1 HPLC of total extract and parts from E. koreanum
1-朝藿定A 2-朝藿定B 3-朝藿定C 4-淫羊藿苷 5-宝藿苷I
1-epimendin A 2-epimendin B 3-epimendin C 4-icariin 5-baohuoside I |
各组受精后9 d斑马鱼的腹面头骨茜素红染色的显微成像图见图 2。从图中可以看出模型组较对照组斑马鱼头骨茜素红染色矿化面积显著减少,说明泼尼松龙成功诱导斑马鱼骨质疏松;依替膦酸二钠组较模型组斑马鱼头骨茜素红染色矿化面积显著增多,依替膦酸二钠作为阳性药物可对抗泼尼松龙诱导的斑马鱼骨质疏松。

| 图 2 各组受精后9 d斑马鱼幼鱼的腹面头骨茜素红染色的显微成像图 Fig.2 Whole-mount preparations of ventral skull of zebrafish larva at 9 d post fertilization by alizarin red staining |
总提物组斑马鱼头骨茜素红染色矿化面积与模型组比较相对增加。由定量分析结果(图 3)可见,与模型组比较,总提物100.0 μg/mL时,斑马鱼头骨染色面积之和及累积光密度显著升高(P<0.05),提示100.0 μg/mL总提物可对抗泼尼松龙诱导的斑马鱼骨质疏松。
3.3 分离部位对泼尼松龙诱导斑马鱼骨质疏松的防治作用从图 2中可以看出除水分离部位组外,30%、50%、70%、90%乙醇分离部位组斑马鱼头骨矿化面积及累积光密度较模型组相对增加。
各组斑马鱼受精后9 d腹面头骨茜素红染色的矿化面积之和及累积光密度值见图 3。可以看出30%乙醇部位1.0 μg/mL组的累积光密度值、50%乙醇部位10.0、1 000.0 μg/mL组矿化面积之和及累积光密度值、70%乙醇部位100.0 μg/mL组矿化面积之和及累积光密度值、90%乙醇部位100.0 μg/mL组矿化面积之和及累积光密度值与模型组相比具有显著性差异(P<0.05);30%乙醇部位10.0 μg/mL组的累积光密度值、50%乙醇部位100.0 μg/mL组矿化面积之和及累积光密度值、70%乙醇部位10.0 μg/mL组矿化面积之和及累积光密度值、90%乙醇部位1 000.0 μg/mL组矿化面积之和及累积光密度值与模型组相比具有极显著性差异(P<0.01、0.001)。结果提示除了水洗部位外,30%、50%、70%、90%乙醇分离部位均可阻止泼尼松龙诱导的斑马鱼骨质疏松。
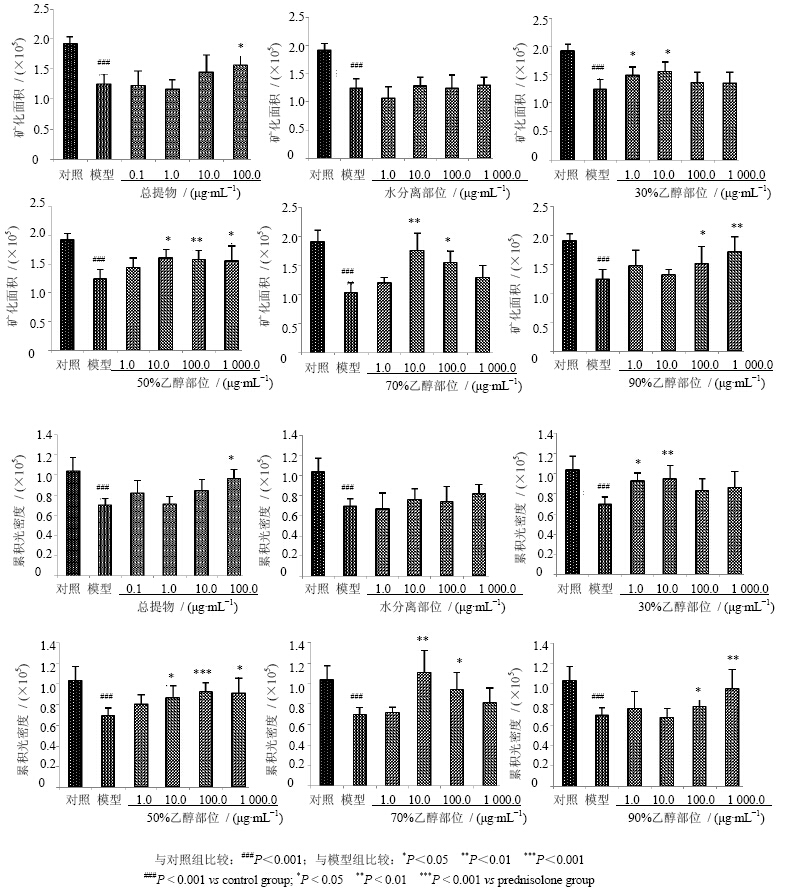
|
图 3 朝鲜淫羊藿总提物和分离部位对斑马鱼幼鱼头骨茜素红染色面积之和及累积光密度的影响 (x±s,n=5)
Fig.3 Effect of total extract and separate fractions of E. koreanum on alizarin red staining area and integrated optical density of zebrafish larvae skull (x±s,n=5)
与对照组比较:###P<0.001;与模型组比较:P<0.05 **P<0.01 ***P<0.001
###P < 0.001 vs control group; P < 0.05 **P < 0.01 ***P < 0.001 vs prednisolone group |
本实验以前期研究[5]为基础,用25 μmol/L泼尼松龙诱导斑马鱼骨质疏松。并用该模型评价了传统壮骨中药朝鲜淫羊藿总提物的抗骨质疏松活性,结果与现有大鼠骨质疏松模型和细胞模型报道的结论具一致性[13,14];在此基础上,进一步应用该模型评价了朝鲜淫羊藿总提物的大孔树脂分离不同部位的抗骨质疏松活性,结果表明,除了水洗脱部位无活性外,30%、50%、70%、90%乙醇分离部位均有一定的抗骨质疏松活性,30%乙醇部位以非黄酮类成分为主,50%、70%、90%乙醇分离部位主要含黄酮类成分,提示朝鲜淫羊藿抗骨质疏松活性成分主要为黄酮类成分,尚含其他如木脂素类及9,10-二氢菲类等少量成分,这与最新的朝鲜淫羊藿活性部位筛选报道结论具一致性[15],说明斑马鱼模型用于中药抗骨质疏松活性筛选具可行性与合理性。
目前,利用斑马鱼作为整体动物药效筛选模型已成为斑马鱼研究的热点之一。斑马鱼幼鱼骨骼发育具有骨形成和骨吸收的完整体系,用泼尼松龙诱导的斑马鱼骨质疏松模型实现在体化、微板化。该模型克服传统哺乳动物骨质疏松模型耗时长、效率差、灵敏度低、用药量大的缺陷,避免原代骨细胞模型条件苛刻度,操作复杂,作用环节单一等不足,为抗骨质疏松中药的活性筛选提供简单、高效新方法。
| [1] | Li N, Felber K, Elks P, et al. Tracking gene expression during zebrafish osteoblast differentiation [J]. Dev Dyn, 2009, 238(2): 459-466. |
| [2] | Fleming A, Sato M, Goldsmith P. High-throughput in vivo screening for bone anabolic compounds with zebrafish [J]. J Biomol Screen, 2005, 10(8): 823-831. |
| [3] | Kim S N, Bae S J, Kwak H B, et al. In vitro and in vivo osteogenic activity of licochalcone A [J]. Amino Acids, 2012, 42(4): 1455-1465. |
| [4] | 韦英杰, 王长梅, 蔡雪婷, 等. 地塞米松影响骨骼发育的斑马鱼模型的建立 [J]. 药学学报, 2013, 48(2): 255-260. |
| [5] | 王长梅, 韦英杰, 贾晓斌, 等. 泼尼松龙诱导斑马鱼骨质疏松模型的建立 [J]. 世界科学技术-中医药现代化, 2013, 15(3): 509-514. |
| [6] | Wei H, Zi L L, Yuan L C, et al. Effect of icariin on bone formation during distraction osteogenesis in the rabbit mandible [J]. Int J Oral Maxillofac Surg, 2011, 40(4): 413-418. |
| [7] | Zhang G, Wang X L, Sheng H, et al. Constitutional flavonoids derived from Epimedium dose-dependently reduce incidence of steroid-associated osteonecrosis not via direct action by themselves on potential cellular targets [J]. PLoS One, 2009, 4(7): e6419. |
| [8] | 杨 丽, 朱晓峰, 王攀攀, 等. 淫羊藿水提取物对大鼠骨髓间充质干细胞骨向分化的影响及其机制 [J]. 中草药, 2013, 44(22): 3182-3187. |
| [9] | 崔 莉, 孙 娥, 王静静, 等. 中压制备系统联合自动纯化系统制备淫羊藿中的朝藿定A, B, C 对照品 [J]. 南京中医药大学学报, 2013, 29(1): 60-62. |
| [10] | 蒋艳荣, 张振海, 孙 娥, 等. 酶解淫羊藿总黄酮制备宝藿苷I [J]. 中国医院药学杂志, 2013, 33(4): 260-263. |
| [11] | 朱粉霞, 赵永刚, 贾晓斌, 等. 淫羊藿炮制前后UPLC-PDA-MS的指纹图谱研究 [J]. 化学学报, 2012, 70(5): 635-642. |
| [12] | 吕 磊, 张 海, 赵 亮, 等. RRLC-TOF/MS快速鉴别中药淫羊藿中43种化学成分 [J]. 第二军医大学学报, 2011, 32(3): 306-310. |
| [13] | Peng S, Zhang G, He Y, et al. Epimedium-derived flavonoids promote osteoblastogenesis and suppress adipogenesis in bone marrow stromal cells while exerting an anabolic effect on osteoporotic bone [J]. Bone, 2009, 45(3): 534-544. |
| [14] | 裴玉岩, 张海亮, 刘继光, 等. 淫羊藿对骨质疏松大鼠下颌骨骨量变化的影响 [J]. 医药论坛杂志, 2010(11): 57-59. |
| [15] | 江 芳. 朝鲜淫羊藿中抗骨质疏松活性成分的研究 [D]. 沈阳: 沈阳药科大学, 2008. |
 2014, Vol. 45
2014, Vol. 45


