2. 中国科学院生态环境研究中心 环境化学与生态毒理国家重点实验室, 北京 100085;
3. 太原理工大学化学化工学院, 山西 太原 030024;
4. 河北科技大学, 河北 石家庄 050018
2. State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China;
3. Chemistry and Chemical Engineering of Taiyuan University of Technology, Taiyuan 030024, China;
4. Hebei University of Science and Technology, Shijiazhuang 050018, China
大黄酚具有止咳、抗衰老、抗癌、降血糖等多种功效[1],但是由于大黄酚溶解度低、易氧化、对胃肠道刺激大,不能长时间保存,使其临床应用受到限制[2]。近年来,为了提高大黄酚生物利用度研究开发了很多新制剂,如大黄酚环糊精包合物[3]、大黄酚纳米囊[4]、大黄酚脂质体[5,6]、大黄酚冻干脂质体[7]等。研究结果表明,脂质体是大黄酚较理想的药物载体[8,9],但是普通的脂质体多数以混悬液形式存在,长时间放置容易分层和凝聚沉降,还会发生磷脂的氧化分解、药物渗漏等问题[10]。将大黄酚制成固体粉末状的前体脂质体,使用前水合为脂质体混悬液,不仅易于保存,还可以有效提高制剂的稳定性,避免上述问题。本实验采用载体沉积法,通过筛选合适的载体,制备出稳定性好的大黄酚前体脂质体,并对其进行质量评价,为进一步推动大黄酚临床应用提供研究基础。 1 仪器与材料
TU—1810紫外可见分光光度计,北京普析通用仪器有限责任公司;RE52—99型旋转蒸发仪,上海亚荣生化仪器厂;SU—05低速离心机,安徽中科中佳科学仪器有限公司;H—7650型透射电子显微镜,日立HITACHI公司;CX—250超声波清洗器,北京医疗设备工厂;ALC—210.4电子天平,赛多利斯科学仪器(北京)有限公司;Delsa Nano型Zeta电位及粒度分析仪,美国Beckman Coulter公司。
大黄酚对照品,中国食品药品检定研究院,批号110796-200716,质量分数≥98%;大黄酚样品(质量分数为98%),西安小草植物科技有限公司,批号XC20130903;卵磷脂(PC),北京华清美恒天然产物技术开发有限公司,批号20130308;胆固醇(CH,批号76C10150)、PEG 2000、维生素E,北京鼎国生物技术有限责任公司;甘露醇,天津市风船化学试剂科技有限公司;山梨醇,天津市大茂化学试剂厂;氯化钠,天津市北方天医化学试剂厂;乳糖,天津市标准科技有限公司;色谱纯甲醇,天津市永大化学试剂开发中心;无水乙醇等均为国产分析纯。 2 方法与结果 2.1 大黄酚前体脂质体的制备工艺 [6,11]
称取处方量的卵磷脂、胆固醇、大黄酚、维生素E以及PEG 2000,溶于无水乙醇中,形成澄清溶液。另称取适量过80目筛的载体,置于500 mL茄形瓶中,预热5 min,然后分批次加入适量的类脂质溶液,在一定温度下恒温水浴减压蒸发至干。将制得品置于真空干燥器中干燥12 h,过40目筛,密闭于西林瓶中,冰箱4 ℃保存。临用前,取大黄酚前体脂质体粉末加入注射用水水合,振摇15 min溶解,即得前体脂质体混悬液。 2.2 前体脂质体包封率的测定
按本课题组前期研究建立的低速离心法[12]进行测定。测定过程简述如下:取待测的大黄酚前体脂质体样品,加注射用水水化,振摇至全部溶解,转移至25 mL量瓶中,定容,混合均匀。精密量取2.0 mL溶液置于离心管中,在1 000 r/min、20 s/次的条件下离心6次,弃去上层清液。精密移取5.0 mL甲醇溶解沉淀,以甲醇做参比测定吸光度,计算游离大黄酚的量,计算包封率。每个样品平行测定3次,取其平均值。
包封率=1-W游离 / W总
W游离为游离大黄酚的质量,W总为总大黄酚的质量 2.3 影响前体脂质体制备因素的考察
预试验发现载体种类、载脂比、药脂比和胆固醇用量是影响大黄酚前脂质体包封率的主要因素。制备工艺中各因素对产品质量均有重要影响,故首先通过单因素确定主要影响因素,然后采用正交试验设计优化处方,以期确定大黄酚前体脂质体的最佳制备条件。 2.3.1 不同载体对包封率的影响
固定处方及工艺中的其他因素,分别选用山梨醇、甘露醇、氯化钠、乳糖为载体,制备大黄酚前体脂质体,测定包封率,结果分别为79.46%、71.35%、51.21%、57.43%。结果显示载体为山梨醇时,制备的脂质体包封率高、稳定性好。 2.3.2 水浴温度对包封率的影响
固定其他因素,考察水浴温度分别为30、35、40、45、50 ℃,制备大黄酚前体脂质体,测定包封率,结果分别为68.60%、71.47%、74.38%、69.42%、65.53%。结果表明水浴温度为40 ℃时,可以制得包封率较高的脂质体。 2.3.3 载脂比对包封率的影响
固定其他因素,使处方中载体-卵磷脂的比例分别为20∶1、25∶1、30∶1、35∶1、40∶1,制备大黄酚前体脂质体,测定包封率,结果分别为72.16%、73.90%、79.45%、78.90%、77.33%。结果表明载脂比为30∶1时,可以制得包封率高、稳定性好的脂质体。 2.3.4 药脂比对包封率的影响
固定其他因素,使处方中药物-卵磷脂的比例分别为1∶8、1∶10、1∶12、1∶14、1∶16,制备大黄酚前体脂质体,测定包封率,结果分别为52.23%、79.44%、82.53%、74.63%、65.56%。结果表明药脂比为1∶12时,脂质体包封率最高。 2.3.5 胆固醇用量对包封率的影响
固定其他因素,使处方中胆固醇-卵磷脂的比例分别为1∶2、1∶3、1∶4、1∶5、1∶6,制备大黄酚前体脂质体,测定包封率,结果分别为76.92%、81.19%、78.62%、79.41%、72.48%。结果表明,胆固醇与卵磷脂的最佳质量比为1∶3时,制备的大黄酚前体脂质体包封率最高。 2.4 正交试验优化
在单因素考察试验基础上,以包封率为指标,对处方中水浴温度(A)、载脂比(B)、胆固醇-卵磷脂比(C)、药脂比(D)4个因素进行优选,以期得到稳定性好、包封率较高的前体脂质体处方和制备条件。选用L9(34) 正交表安排试验,制备前体脂质体,测定包封率。试验设计及结果见表 1,方差分析见表 2。
| 表 1L9(34) 正交试验设计及结果 Table.1 Design and results of L9(34) orthogonal test |
| 表 2 方差分析 Table 2 Analysis of varianc |
从直观分析和方差分析可知各因素均无显著性差异,各因素的影响大小为B>D>C>A。载药量为2.0 mg时,最佳处方为A2B3C3D2,即温度为40 ℃,载脂比为40∶1,胆固醇-卵磷脂比为1∶5,药脂比为1∶12。 2.5 验证试验
按上述最优处方制备3批大黄酚前体脂质体,测定其包封率分别为82.41%、86.45%、85.22%。由测定结果可知该处方和制备条件稳定可行。 2.6 大黄酚前体脂质体的质量评价 2.6.1 外观 最终制得的大黄酚前体脂质体为黄色固体粉末,分散性好,长时间放置不团聚。 2.6.2 脂质体形态、粒径和Zeta电位的测定
取适量的大黄酚前体脂质体加注射水水合,稀释一定倍数,将稀释后的大黄酚前体脂质体重组液,点样于铜网上,静置70 s,吸干周边多余水分,用1%的磷钨酸负染,用滤纸吸干染液,然后用透射电子显微镜(TEM)观察并拍照,脂质体轮廓清晰,呈圆形或椭圆形,为单室或多室脂质体,见图 1。用Delsa Nano型Zeta电位及粒度分析仪测定所制备的脂质体粒径分布及Zeta电位,结果见图 2,平均粒径为(593.4±14.2)nm,Zeta电位为(-54.35±0.88)mV,表明水合后的大黄酚脂质体溶液稳定。
 | 图 1 大黄酚前体脂质体 TEM 照片Fig. 1 TEM photograph of chrysophanol proliposomes |
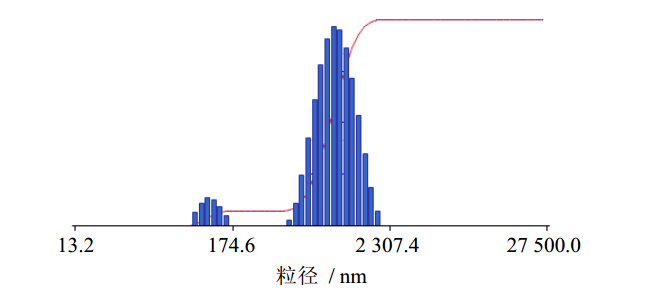 | 图 2大黄酚前体脂质体粒径分布图Fig. 2 Particle size distribution of chrysophanol proliposomes |
取验证试验制备的大黄酚前体脂质体,4 ℃低温保存,每隔5天测定其渗透率。脂质体溶液15 d渗漏率仅为1.05%,所制备的脂质体较为稳定,不易渗漏。 3 讨论
大黄酚为脂溶性、易氧化药物,普通方法制备的前体脂质体包封率较低。故本实验采用载体沉积法制备大黄酚前体脂质体,并在单因素试验的基础上,采用正交试验设计对大黄酚前体脂质体的制备处方进行了优化研究,得到了最优处方和制备条件。
实验结果表明,载体种类对前体脂质体的包封率有很大影响,这主要是由于前体脂质体是将磷脂吸附在水溶性载体如甘露醇、氯化钠、山梨醇等上制成前体脂质体,磷脂遇水溶胀,载体溶解形成多层脂质体,其中载体的颗粒大小直接影响脂质体的大小和均匀性。山梨醇的表面为多孔径结构,比表面积大,不易湿结成团,流动性好,负载磷脂能力强,因而对药物的包封效果好;甘露醇也有多孔径结构,但吸湿性强,使药物前体脂质体在制备过程中部分湿结成团,流动性降低;氯化钠晶体表面无孔径结构,负载磷脂能力差,其结果不理想。
载体沉积法制备的大黄酚前体脂质体为黄色的干燥粉末或颗粒状固体,流动性良好,同时其制备方法简单,包封率较高为(84.69±2.29)%,质量可控易于生产。大黄酚前体脂质体可用来压片和装胶囊,因此不仅增加了药物的稳定性,而且便于贮存和运输,较好地解决了大黄酚临床应用中的一些问题,具体药效学方面有待于进一步研究。
| [1] | 张丹丹. 大黄的临床药理研究 [J]. 中国中医药现代远程教育, 2011, 9(17): 69-70. |
| [2] | 赵晓倩, 张丹参, 师方圆, 等. 3种大黄酚制剂在兔血浆中的药动力学研究 [J]. 中国药理学通报, 2011, 27(12): 1753-1757. |
| [3] | 郑晓霞, 张丹参, 黄红娜, 等. 大黄酚-羟丙基-β-环糊精包合物的工艺优选及鉴定 [J]. 中成药, 2010, 32(9): 1518-1521. |
| [4] | 黄红娜, 张丹参, 郑晓霞, 等. 大黄酚聚氰基丙烯酸丁酯纳米囊的制备工艺及质量评价 [J]. 中草药, 2010, 41(4): 547-550. |
| [5] | 王永利, 张明媚, 李维爽, 等. 大黄酚脂质体的制备工艺研究 [J]. 中国新药杂志, 2011, 20(9): 825-832. |
| [6] | 王永利, 王立华, 李维爽, 等. 大黄酚脂质体的制备及其质量评价 [J]. 中草药, 2011, 42(6): 1119-1121. |
| [7] | 王永利, 王立华, 张江伟, 等. 大黄酚冻干脂质体的制备工艺研究 [J]. 中草药, 2013, 44(8): 960-964. |
| [8] | 赵晓倩, 师方园, 朱成琳, 等. 3种大黄酚制剂的稳定性及体外释放度 [J]. 中国药理学与毒理学杂志, 2012, 26(3): 457. |
| [9] | 朱成琳, 张丹参, 宋金艳, 等. 三种大黄酚制剂在小鼠体内的组织分布研究 [J]. 中国药学杂志, 2012, 47(11): 898-902. |
| [10] | 邓英杰. 脂质体技术 [M]. 北京: 人民卫生出版社, 2007. |
| [11] | 郑稳生, 王璐璐, 张宇佳, 等. 多柔比星前体脂质体制备工艺筛选及质量考察 [J]. 中国药师, 2012, 15(8): 1130-1134. |
| [12] | 王永利, 王立华, 夏明华, 等. 低速离心法测定大黄酚脂质体包封率 [J]. 河北北方学院学报, 2012, 28(6): 30-35. |
 2014, Vol. 45
2014, Vol. 45


