2. 吉林农业大学, 吉林 长春 130118;
3. 江西城市职业学院, 江西 南昌 330004
2. Jilin Agricultural University, Changchun 130118, China;
3. Jiangxi City University, Nanchang 330004, China
防风又名屏风、风肉、茴芸、茴草,是伞形科植物防风Saponikovia cata (Turcz.) Sehischk的根[1]。味辛、甘、温;可解表祛风、胜湿,止痉;用于感冒头痛、风湿痹痛、风疹瘙痒、破伤风。防风主产于我国黑龙江、吉林、辽宁、河北、内蒙古和山东等地,喜阳光充足、凉爽的气候条件,忌高温、雨涝及土壤过湿,较耐寒、耐旱,在风积沙土、草甸沙土和草原黑钙土种植,主根发达,侧根少,皮部棕黄色,商品质量好。
目前对防风的化学成分、药理作用、配伍及临床应用的研究进行较多,如在化学成分中对香豆素、色原酮、聚乙炔类、有机酸类[2]、多糖类[3]、挥发油成分,在药理方面对抗肿瘤[4]、增强免疫功能的作用[5],配伍及临床应用方面都进行了详细的研究。
随着防风需求量增加,野生防风产量和品质的下降,使近年人工栽培面积不断扩大,而人工栽培的防风,由于土地疏松,肥、水充足,生长量大,有大量的营养物质积累,便出现未熟抽薹现象,抽薹早期防风根部木质化,品质降低,晚期根部腐烂,失去了药用价值,因此人工栽培防风抽薹是影响防风的质量和产量的关键因素,而对于防风抽薹是否与内源激素有关的研究还未见报道。本实验通过测定中药防风在抽薹前后内源激素生长素(IAA),赤霉素(GA),脱落酸(ABA)等量的动态变化,找出中药防风早期抽薹与内源激素量的变化关系,为进一步研究防风早期抽薹的机制提供理论依据,为抑制或解决中药防风的早期抽薹现象扩宽解决途径提供参考,从而提高防风的品质和产量。 1 材料、仪器与试药 1.1 材料
材料为吉林农业大学生态园区防风GAP基地的二年生防风,由张连学教授鉴定为正品防风Saponikovia cata (Turcz.) Sehischk。采集时间为2008年5月20日至2009年8月18日,每10天采集1次,前5次采集的样品均为未抽薹防风,后5次采集的样品均为抽薹防风。为了保证实验条件的一致性,每次采集样品时间均为15:20~15:50。 1.2 仪器与试药
Waters2695高效液相色谱仪、RE—52AA旋转蒸发器、KQ—250B超声波清洗仪、TGL—20LM高速冷冻离心机、UV—754紫外可见分光光度计。IAA、GA和ABA对照品(质量分数均为99.8 %)均购自于Sigma公司,甲醇和乙腈为色谱纯,其他试剂均为分析纯。 2 方法 2.1 色谱条件
色谱柱:CentuySILC18ODS反相柱(250 mm×4.6 mm,5 μm);柱温:35 ℃;检测波长为254 nm;体积流量0.7 mL/min;流动相为甲醇-乙腈-0.7%乙酸40∶15∶45。 2.2 对照品储备液的制备
分别精密称定IAA、GA、ABA 3种对照品各3 mg,置于10 mL量瓶中,用甲醇定容。超声溶解,静置备用。 2.3 标准曲线的绘制
精密吸取上述储备液,用甲醇分别制成0.300、0.600、0.900、1.50、3.00 mg/mL 5个不同质量浓度的对照品溶液,在按“2.1”项色谱条件进行分析,以对照品溶液的质量浓度为横坐标,峰面积为纵坐标,进行回归分析得标准回归方程,分别为IAA:Y=0.009 1 X-0.833 2(r=0.999 9);GA:Y=0.092 1 X-12.879(r=0.999 8);ABA:Y=0.039 9 X-1.051 2(r=0.999 6)。结果表明IAA、GA和ABA在0.3~6.0 mg/mL内线性关系良好。 2.4 3种内源激素的测定
精密称定防风根、茎、叶样品各2 g,研细,加10 mL冰甲醇(80%),转入100 mL三角瓶中,加80%冰甲醇20 mL超声震荡2 h(低于4 ℃),过滤,滤渣中加80%冰甲醇20 mL,摇匀,置-20 ℃冰箱中12 h,过滤,合并滤液,于-20 ℃冰箱放置12 h,取滤液10 mL上Seppar C18小柱,用20 mL乙腈洗脱,收集洗脱液,过0.45 μm微孔滤膜,滤液备用[6,7]。在“2.1”项色谱条件下取滤液1 μL进样分析,记录峰面积。将所得的峰面积代入相应的回归方程,计算质量浓度,进而得出3种内源激素(GA、IAA、ABA)的量。每种样品设3个平行,取平均值。 3 结果与分析 3.1 防风抽薹前后IAA量的动态变化
防风在抽薹前后根、茎、叶中IAA的量变化趋势基本相同,即抽薹前IAA的量呈缓慢上升趋势,抽薹后IAA的量急剧下降,且抽薹前防风IAA的量均高于抽薹后。通过对数据分析表明,防风在抽薹前后根、茎、叶中IAA的量出现最高点的时间略有差异,根和茎的IAA量达到最高是在6月29日,分别是45.2和55.45 ng/g,叶的IAA量达到最高(46.69 ng/g)是在6月19日;到8月18日后根、茎、叶IAA的量达到最低18.23、24.36、17.44 ng/g,其中叶的IAA量最低,见图 1。
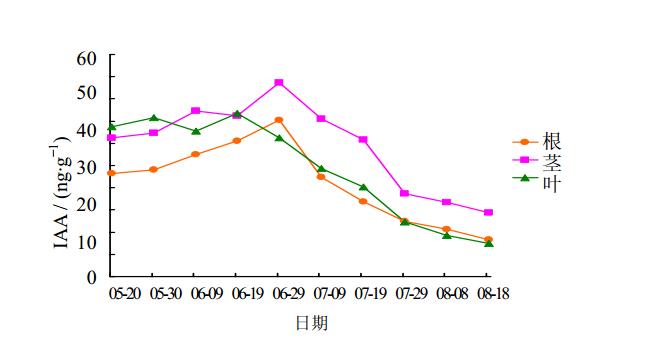 | 图 1 防风抽薹前后根、茎、叶中IAA的量Fig.1 Contents of IAA in roots,stems,and leaves of S.cata before and after bolting |
防风在抽薹前后根、茎、叶中GA的量变化趋势基本相同,即抽薹前GA的量缓慢上升,抽薹后GA的量急剧下降。通过对数据分析表明:防风在抽薹前后根、茎、叶中GA的量出现最高点的时间基本相同,即在6月29日根、茎、叶中GA的量最高,分别是6.21、6.83、6.02 ng/g,且抽薹前防风GA的量均高于抽薹后;到8月18日后根、茎、叶GA的量达到最低,分别是1.30、1.98、1.43 ng/g,其中根的GA量最低,见图 2。
 | 图 2 防风抽薹前后根、茎、叶中GA量Fig. 2 Contents of GA in roots,stems,and leaves of S. cata before and after bolting |
防风在抽薹前后根、茎、叶中ABA的量变化趋势基本相同,即抽薹前(6月29日前)ABA的量虽略有起伏,但基本保持在同一水平,抽薹后(7月9日后)ABA的量急剧上升,明显高于抽薹前。通过对数据分析表明:在8月18日根、茎、叶ABA的量已经达到1 812、2 236、2 198 ng/g,其中茎的ABA量最高,见图 3。
 | 图 3 防风抽薹前后根、茎、叶中ABA量Fig. 3 Contents of ABA in roots,stems,and leaves of S.cata before and after bolting |
通过对防风抽薹前后3种激素IAA、GA、ABA量变化测定表明:防风抽薹前后内源激素IAA、GA、ABA量变化显著,即抽薹前IAA和GA的量均高于抽薹后,而ABA的量抽薹前明显低于抽薹后。由此可见,防风内源激素量的变化与防风抽薹有一定的关系,进而可以初步推断:防风内源激素量的变化导致了防风的早期抽薹,同时也为进一步研究防风早期抽薹机制提供一定的理论依据。 4 讨论
曾有报道指出,合理密植,适当增加育苗和定植的密度,使植株相互遮荫,减少光照强度,控制防风的快速生长,抑制花芽的分化、抽薹。在这种环境下生长,叶片稀少、瘦小,制造的营养只能维持正常的生活所需,或少有结余供缓慢生长,使防风无力抽薹开花结实[8]。这也就是说明利用各种逆境条件,促进植物体内ABA量的增加,从而抑制植物体内IAA、GA的量[9]。这与本实验研究IAA、GA、ABA 3种激素之间的相互关系较为一致。因此,防风的早期抽薹与IAA、GA、ABA 3种激素量可能有着直接的关系。
在本实验中,采用高效液相色谱法测定防风中IAA、GA、ABA 3种激素的量,准确、分析速度快、稳定、可靠,但测定时经常见到多种内源激素分离差,峰性不良及严重拖尾现象,因此选择合适流动相、体积流量、柱温等色谱条件是十分关键的。由于内源激素在植物体内量很低,一定要在同等条件下快速采集样品,在提取和测定的过程中,严格遵守实验步骤,尽量减少误差。
| [1] | 中国药典 [S].一部.2010. |
| [2] | 孙晶波, 郜玉钢, 张秋菊, 等.HPLC法同时测定陇西地区防风中色原酮和香豆素类成分 [J].中草药, 2013, 44(24): 3557-3560. |
| [3] | 李江, 陆蕴如, 张桂燕.防风多糖的研究 [J].中草药, 1999, 30(9): 652-653. |
| [4] | 李莉, 周勇, 张丽, 等.防风多糖增强巨噬细胞抗肿瘤作用的实验研究 [J].北京中医药大学学报, 1999, 22(3): 38-40. |
| [5] | 马学清, 周勇, 严宣佐, 等.中药多糖的免疫增强作用 [J].中国实验临床免疫学杂志, 1996, 8(2): 40-43. |
| [6] | 王若仲, 曹庸.亚种间杂交稻内源激素的高效液相色谱测定法 [J].色谱, 2002, 20(2): 148-150. |
| [7] | 丁静.植物内源激素的提取分离和生物鉴定 [J].植物生理学通讯, 1979(2): 27-50. |
| [8] | Morillon R, Chrispeels M J.The role of ABA and the transpiration stream in the regulation of the osmotic water permeability of leaf cells [J].Proc Natl Acad Sci USA.2001, 98(24): 14138-14143. |
| [9] | lvma B, Magdalcna T, Ivelin P.Effect of 5-azacytidine on callus induction andplantregeneration potential in anther culture of wheat (Triticum aestivum I.) l [J].Plant Physiol, 2004, 30(1/2): 45-50. |
 2014, Vol. 45
2014, Vol. 45


