2. 甘肃省高校中(藏)药化学与质量研究省级重点实验室, 甘肃 兰州 730000;
3. 兰州大学草地农业科技学院, 甘肃 兰州 730020
2. Key Laboratory of Chemistry and Quality for Traditional Chinese Medicines of the College of Gansu Province, Lanzhou 730000, China;
3. College of Pastoral Agricultural Science and Technology, Lanzhou University, Lanzhou 730020, China
挥发油(volatile oil)又称精油(essential oil),是当归Angelica sinensis (Oliv.) Diels活性成分的重要组分之一,其量约占当归总成分的0.62%[1]。现代药理研究表明,当归挥发油能松弛子宫平滑肌、降低血压、改善心肌缺血、抗心律失常,并且具有平喘、抑制中枢神经系统、提高机体免疫功能及抗炎镇痛等作用[2]。萜类(terpenoids)是构成当归挥发油的主要组分之一[3]。近年来,随着生物化学、生物信息学、分子生物学等学科的不断发展,有关萜类物质生物合成途径已基本阐明[4]。萜类物质通常存在2个相对独立的合成途径,即位于细胞质中的甲羟戊酸(mevalonate,MVA)途径和位于质体中的2-C-甲基-D-赤藓糖醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate,MEP)途径[5]。MVA途径是在动物和酵母中首先发现的萜类合成途径,主要合成甾醇、倍半萜、三萜等,而MEP途径是在高等植物中质体中主要合成单萜、二萜等物质的途径[6,7]。MEP途径初始物丙酮酸(pyruvate)和3-磷酸甘油醛(D-GAP)在1-脱氧-D-木酮糖-5-磷酸合酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)的作用下转化成1-脱氧-D-木酮糖-5-磷酸(DXP)。DXP在1-脱氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase,DXR)及还原型辅酶 II(NADPH)的催化下分子重排形成MEP。MEP在4-二磷酸胞苷 - 2-C-甲基-D-赤藓糖醇合成酶(4-diphosphocytidyl-2-C-methyl-D-erythritol synthase,CMS)等一系列酶的催化反应下转化成萜类合成的前体物质异戊基焦磷酸(IPP)和二甲烯丙基焦磷酸(DMAPP)[8]。
甘肃是当归主产区,年栽培面积和总产量都占全国90%以上,目前对当归的研究主要集中在栽培耕作方式和药效药理等方面,在基因层次的研究鲜有报道。为了阐明当归药材道地性的分子生物学基础,需要对当归主要药效物质的生物合成途径和基因调控进行探索。在MEP途径中DXS虽然是第一步催化反应的酶,但其催化产物DXP同时也是维生素B1和维生素B6生物合成的前体物质,因此催化DXP转化为MEP的DXR才是IPP合成的关键酶[9]。DXR已成为当前的研究热点[10,11,12,13,14,15],但有关当归藁本内酯合成关键基因DXR及其表达规律的研究尚未见报道。本研究首次克隆当归DXR保守区序列;并对其进行序列分析,以及对当归DXR的组织特异性表达进行分析,以期为当归DXR的全长克隆及研究其在当归中萜类物质的生物合成与调节中的作用提供理论基础。 1 材料
当归植株于2013年8月采自甘肃岷县茶埠镇试验基地(海拔2 780 m,东经104°06′,北纬34°29′),经甘肃中医学院王引权教授鉴定为伞形科当归属植物当归Angelica sinensis (Oliv.) Diels。田间挖取当归全株,将其冷冻于装有干冰的泡沫箱中,于当天带至实验室后迅速用去离子水冲洗干净,将根、茎、叶分离后液氮迅速冷冻,保藏于-80 ℃超低温冰箱,供作RNA提取材料。大肠杆菌菌株Escherichia coli DH5α由本实验室保存。
所用的分子生物学试剂主要包括:RNA提取试剂十六烷基三甲基溴化铵(CTAB)、LiCl和聚乙烯吡咯烷酮360(PVP-360,Sigma公司),cDNA合成试剂盒(TaKaRa,大连),Ex Taq DNA Polymerase(TaKaRa,大连)、PCR产物回收试剂盒(TransGen,北京)、PCR产物克隆试剂盒(Promega,美国),DNA Marker(TransGen,北京),SYBR Green荧光定量试剂盒(Promega,美国),其他生化试剂均为进口或国产分析纯产品。 2 方法 2.1 引物设计与合成
通过对GenBank中拟南芥Arabidopsis thaliana(L.) Heynh.(Accession:NM_001203671)、丹参Salvia miltiorrhiza Bunge(Accession:FJ476255)、薄荷Mentha piperita Linn. (Accession:AF116825)、金鱼草Antirrhinum majus L.(Accession:AY770406)和美丽帽柱木Mitragyna speciosaKorth.(Accession:JQ038374)等植物DXR编码基因CDS序列进行同源比对,找出高度保守区段,按照相似性高和简并性低的原则,利用Primer 6.0生物软件设计一对简并引物(P1、P2),用于扩增当归DXR片段,推测目的片段长度为564 bp。P1:5’-GGCTCCATTGGVACTCAGAC-3’,P2:5’-CTT-CAGAGCATCBGCTACTTT-3’,其中V=G、A、C,B=G、T、C。
参照克隆并测序的当归DXR片段序列,利用Primer 6.0生物软件设计出一对用于DXR荧光定量PCR检测的特异引物(P3、P4),扩增长度为112 bp。P3:5’-GCCGATTCAGAGCATTCTGC-3’,P4:5’-TCCACAGGCAAGTCCCTAAA-3’。参照当归Actin片段序列[16],设计出一对荧光定量PCR内参基因检测的特异引物(P5、P6),扩增长度为109 bp。P5:5’-TGGTATTGTGCTGGATTCTGGT-3’,P6:5’-TGAGATCACCACCAGCAAGG-3’。以上所有引物均由生工生物工程(上海)股份有限公司合成。 2.2 总RNA的提取
当归根、茎及叶组织总RNA的提取参照文献方法进行[17],并略作修改。实验中所用到玻璃容器、离心管和去离子水在RNA提取前均用焦炭酸二乙酯(DEPC)处理,以变性灭活RNase。具体操作步骤如下:取1 g材料置于含液氮和少量石英砂的研钵中充分研磨成粉末状。取约1/10的粉末转入内含0.9 mL 65 ℃预热的提取缓冲液的离心管中,提取缓冲液成分包括100 mmol/L Tris-Cl、2% CTAB、2% PVP-360、30 mmol/L EDTA、1.5 mol/L的NaCl和2%的β-巯基乙醇。充分振荡混匀后置于65 ℃水浴锅孵育20 min,期间每5分钟充分振荡1次。冷却至室温后,加等体积氯仿-异戊醇(24∶1),剧烈振荡30 s,12 000×g、4 ℃离心10 min。水相转入另一离心管,加约1/3体积10 mol/L的LiCl,混匀后置-20 ℃冰箱30 min。12 000×g、4 ℃离心10 min,沉淀溶解于0.5 mL无RNase的去离子水,加0.5 mL水饱和酚抽提1次,再加入等体积氯仿-异戊醇(24∶1)抽提1次,12 000×g、4 ℃离心10 min。水相转入另一离心管,加1/10体积3 mol/L pH 5.4的醋酸钠,再加1体积预冷的异丙醇,置-20 ℃冰箱30 min。12 000×g、< span lang="EN-US" style='letter-spacing:.1pt' xml:lang="EN-US">4 ℃离心10 min,沉淀悬浮于500 μL 无RNase的去离子水配制的70%乙醇。12 000×g、4 ℃离心10 min,弃去上清液,沉淀干燥后溶于50 μL无RNase的去离子水。
将提取到的总RNA在使用和保存之前进行检测,使用分光光度计(Thermo BioMate 3,美国),根据吸光度(A)值测定所提总RNA的纯度(A260/A280在1.8~2.0,说明RNA无污染)及浓度;并依照测定出的RNA浓度确定下一步实验中合成cDNA所需模板的用量,未使用的RNA保存于-80 ℃超低温冰箱;采用非变性琼脂糖凝胶电泳方法判断总RNA的完整性。 2.3 cDNA模板合成和PCR扩增
按照试剂盒说明书,以当归叶片总RNA合成cDNA,然后以cDNA为模板进行PCR反应。反应体系是在200 μL PCR管中加入下列组分:无菌去离子水35.8 μL、MgCl2(25 mmol/L)5 μL、10×PCR缓冲液5 μL、dNTP(2 mmol/L)1.2 μL、正反向引物(10 μmol/L)1 μL、cDNA 0.5 μL和Taq DNA polymerase(5 U/μL)0.5 μL,总体积为50 μL。反应程序:95 ℃预变性3 min;95 ℃变性30 s、56 ℃退火30 s、72 ℃延伸60 s,30个循环;最后72 ℃延伸10 min,4 ℃结束,PCR扩增产物进行1.5%琼脂糖凝胶电泳,用凝胶-化学发光成像系统(Bio-Rad CHEMI DOC XRS,美国)检测。目的片段回收和纯化按照回收试剂盒说明书进行。 2.4 阳性克隆的筛选、鉴定及测序
DNA片段与T载体连接体系包括:T4 DNA连接酶的2×连接缓冲液5 μL、pGEM-T Easy载体0.5 μL、纯化的PCR产物1.2 μL(加入量以PCR产物-载体物质的量比1∶1估算)、T4 DNA连接酶0.8 μL,无菌去离子水补充至10 μL,4 ℃连接过夜。连接产物全部加入到100 μL置于冰上的感受态E. coli DH5α细胞中,冰浴20 min;42 ℃热激50 s;冰浴2 min。加入900 μL平衡至室温的液体LB培养基,摇菌1.5 h(37 ℃,150 r/min)。取100 μL菌液涂布于含有氨苄青霉素的LB固体培养基上,37 ℃培养过夜。次日挑选单菌落,进行菌落PCR检测,阳性克隆接种于含氨苄青霉素的液体培养基培养(37 ℃,150 r/min),培养过夜后装入菌种保藏管送生工生物工程(上海)有限公司测序。 2.5 序列的生物信息学分析
利用NCBI网站Blast工具进行基因序列同源性比对,序列的翻译和氨基酸序列同源性比对及作图等在DNAMAN 6.0生物软件中进行,序列保守区分析在NCBI网站Conserved Domain Database (CDD)中进行。 2.6 DXR在当归植株组织中的特异表达
采用实时荧光定量PCR(Bio-Rad CFX96,美国)测定DXR在当归植株组织中的特异表达。分别称取约0.1 g当归根、茎、叶组织提取总RNA,每个组织重复3次,然后用分光光度计测定浓度,计算并量取总RNA约100 ng。按试剂盒说明书进行cDNA的第一链合成,将cDNA用无菌去离子水稀释至30 μL后取1 μL cDNA作为模板进行荧光定量PCR,每个cDNA模板做3管重复。反应体系:在200 μL PCR管中加入无菌去离子水7.4 μL、2×qPCR mix 10 μL、正反向引物(10 μmol/L)0.8 μL、cDN A 1 μL,总体积为20 μL。反应程序:95 ℃预变性3 min;95 ℃变性15 s、60 ℃退火30 s、72 ℃延伸30 s,40个循环。荧光采集时间在72 ℃延伸步骤,扩增完成后利用PCR仪自带的程序进行溶解曲线测定。求取3个平行管的平均Ct值,采用2-ΔΔCt分析方法对DXR进行相对定量表达分析。 2.7 统计与分析
所有数据采用SPSS 16.0软件进行统计和分析。根、茎、叶间DXR相对表达量差异性利用ANOVA分析,数据通过LSD检验。 3 结果与分析 3.1 总RNA的提取及检测
采用非变性琼脂糖凝胶电泳法对当归不同组织总RNA进行检测,结果显示:28 S rRNA和18 S rRNA条带清晰,没有其他杂质条带(图 1),说明提取的叶片总RNA的完整性较好;经分光光度计测定A260/A280平均值为1.98,表明总RNA的纯度较高,可用于cDNA制备和PCR扩增。
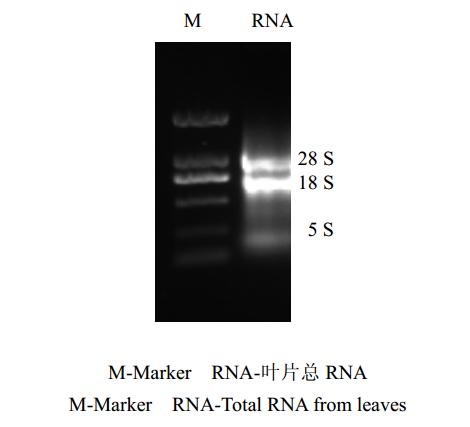 | 图 1 叶片总RNA非变性琼脂糖凝胶电泳Fig.1 Nondenaturing agrose gel electrophoresis of total RNA from leaves |
以当归叶片总RNA反转录所得到的第一链cDNA为模板,用DXR简并引物P1和P2进行PCR扩增。经检测,扩增产物在500~750 bp处有一条亮带(图 2),与目的片段大小基本一致,推测为DXR片段,需要进一步测序鉴定。
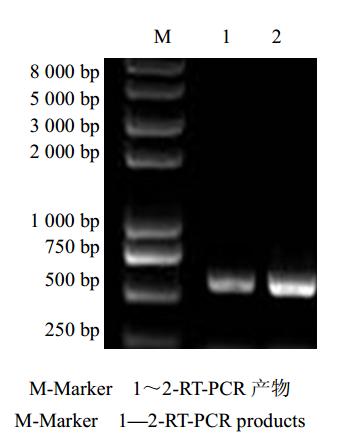 | 图 2 RT-PCR产物琼脂糖凝胶电泳Fig. 2 Agrose gel electrophoresis of RT-PCR products |
将回收纯化的目的片段连接到pGEM-T Easy克隆载体上,转化Escherichia coli DH5α,从转化的平板上随机挑取5个克隆并进行菌落PCR扩增,经检测1~5号克隆扩增出大小约为500~750 bp的亮条带,与RT-PCR结果一致,可能为阳性克隆,然后将阳性克隆进行菌液培养并进行测序,测得一段长度为564 bp的序列,将该基因序列在NCBI网站的GenBank数据库中注册,登陆号为KJ000259。 3.4 序列分析
对克隆得到的基因片段进行初步的序列分析,其编码187个氨基酸(图 3)。Blast比对结果显示该序列与NCBI基因库中海岛棉Gossypium barbadense L. 等6个植物物种DXR核苷酸序列的相似性在80%以上(表 1),将推测的当归的DXR片段的氨基酸序列和其他植物DXR的氨基酸序列进行多重比较,结果发现完全一致的氨基酸多达150个,占总氨基酸数的80%,其与海岛棉、杭白菊Chrysanthemum morifolium (Ramat.) Tzvel.、黄花蒿Artemisia annua L.、紫茎泽兰Ageratina adenophora (Spreng.) King & H. Rob.、杜仲Eucommia ulmoides Oliv. 和蓖麻Ricinus communis L. 的氨基酸序列相似性分别为92.02%、86.17%、86.17%、85.64%、90.96%和88.83%(图 4),这表明本实验所克隆到的基因片段为当归DXR片段,并将其命名为AsDXR,将所编码的肽段命名为AsDXR。进一步对AsDXR进行保守结构域分析,结果显示其为DXR的保守区域,1~120 AA为DXP_reductoisom蛋白超家族(cl03657)序列区域,130~187 AA为部分DXP_redisom_蛋白超家族(pcl07165)序列区域,这2个保守结构域均在NADPH的存在下催化DXP转化成MEP,为DXR的功能结构域[7]。
 | 图 3 当归DXR片段的核苷酸序列及推测的氨基酸序列Fig. 3 Nucleic acid sequence and deduced amino acid sequence of DXR fragment from A. sinensis |
| 表 1 当归与部分植物DXR片段核苷酸序列相似性比对 Table 1 Similarity companison of DXR fragment nucleic acid sequences in A. sinensis and other plant species |
 | 图 4 当归与部分植物DXR片段氨基酸序列相似性多重比较 Fig. 4 Multiple comparison of amino acid sequence of DXR fragment in A. sinensis and other plant species |
总RNA的非变性琼脂糖凝胶电泳结果表明,根、茎、叶组织中总RNA的28 S条带和18 S条带亮度相当(图 5),说明反转录总RNA浓度基本相同。实时荧光定量PCR扩增曲线显示,对Actin和DXR的扩增效率良好,Ct值在21~28;熔点曲线分析也充分表示扩增曲线有良好的特异性,表现为单峰,无非特异性荧光峰,Actin和DXR的熔点曲线峰值分别出现在86和84 ℃。将荧光定量PCR的产物进行琼脂糖凝胶电泳检测,结果显示扩增条带大小约为110 bp,与目的片段大小一致,无引物二聚体条带。
 | 图 5 当归根、茎、叶总RNA非变性琼脂糖凝胶电泳 Fig. 5 Nondenaturing agrose gel electrophoresis of total RNA from roots,stems and leaves of A. sinensis |
采用2-ΔΔCt方法分析当归根、茎、叶组织中DXR相对表达量,结果显示DXR在植株各组织中均有表达,但以叶片中表达量最高,分别是茎和根中表达量的2.5倍和3.2倍,差异性达到显著水平(P<0.01),而茎和根中表达量相当(图 6)。 4 讨论
MEP途径是植物萜类合成的一条重要途径。许多研究表明,DXR是调控MEP途径的关键代谢酶,对植物半萜、单萜、双萜和类胡萝卜素及其衍生物的生物合成具有重要影响[4,5]。由于当归挥发油的组分和量与萜类化合物的生物合成密切相关,因此深入研究当归DXR基因功能及其调控具有重要意义。本研究通过同源比对设计简并引物利用RT-PCR方法,首次从当归叶片中扩增出MEP途径关键酶基因AsDXR。通过同源性比对,表明AsDXR与海岛棉、杭白菊、黄花蒿、紫茎泽兰、杜仲、蓖麻的同源性达80%以上,由此可以推断AsDXR片段就是当归DXR酶的cDNA片段。通过对AsDXR进行保守结构域分析,显示该序列为当归DXR的保守区域,其包含着DXP_reductoisom 和DXP_redisom两个蛋白超家族序列,因此AsDXR是高等植物DXR家族的新成员,具有较高的保守性。当归DXR可能参与到当归MEP萜类的生物合成途径,但其是否只有一个基因家族,表达产物的亚细胞定位、结构及特性等功能还有待于进一步研究。
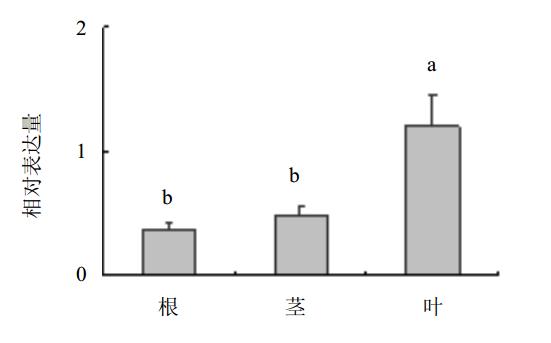 | 图 6 DXR在当归根、茎、叶中的相对表达量Fig. 6 Relative expression levels of DXR in roots,stems,and leaves of A. sinensis不同小写字母代表显著性差异 P<0.01 Different lower-case letters represent significant difference P < 0.01 |
通过RT-qPCR方法对DXR在当归叶、茎和根组织中的表达分析发现,DXR在当归叶、茎和根组织中均有表达,但表达水平有明显差异,其中以叶片中的表达量最高。这可能与MEP途径是定位于质体中的萜类代谢途径和当归叶中含有丰富的叶绿体、叶绿素、类胡萝卜素有关[18]。未来的研究方向应该是进一步对当归DXR编码基因全长克隆,深入研究其功能和当归阶段发育过程中的组织表达;同时应探讨当归DXR过量表达和敲除对萜类合成的效应,以及重要胁迫因子对其表达的调控效应,为揭示当归药材品质形成及种质遗传改良提供新的研究思路。
| [1] | 丁毅.炮制对当归挥发油及多糖的影响 [J].时珍国医国药, 2004, 15(8): 496-497. |
| [2] | 杜俊蓉, 白波, 余彦, 等.当归挥发油研究新进展 [J].中国中药杂志, 2005, 30(18): 1400-1406. |
| [3] | 裴媛, 谭初兵, 徐为人, 等.当归苯酞类和萜类成分作用的虚拟评价 [J].中草药, 2010, 41(6): 938-941. |
| [4] | Yu F, Utsumi R.Diversity, regulation, and genetic manipulation of plant mono-and sesquiterpenoid biosynthesis [J].Cell Mol Life Sci, 2009, 66(18): 3043-3052. |
| [5] | Vranová E, Coman D, Gruissem W.Network analysis of the MVA and MEP pathways for isoprenoid synthesis [J].Annu Rev Plant Biol, 2013, 64: 665-700. |
| [6] | Eisenreich W, Rohdich F, Bacher A.Deoxyxylulose phosphate pathway to terpenoids [J].Trends Plant Sci, 2001, 6(2): 78-84. |
| [7] | Rohmer M.The discovery of a mevalonate-independent pathway for isoprenoid biosynthesis in bacteria, algae and higher plants [J].Nat Prod Rep, 1999, 16(5): 565-574. |
| [8] | Roelofs A J, Jauhiainen M, Mönkkönen H, et al.Peripheral blood monocytes are responsible for γ δ T cell activation induced by zoledronic acid through accumulation of IPP/DMAPP [J].Br J Haematol, 2009, 144(2): 245-250. |
| [9] | Takahashi S, Kuzuyama T, Watanabe H, et al.A 1-deoxy-D-xylulose-5-phosphate reductoisomerase catalyzing the formation of 2-C-methyl-D-erythritol-4-phosphate in an alternative nonmevalonate pathway for terpenoid biosynthesis [J].Proc Natl Acad Sci USA, 1998, 95(17): 9879-9884. |
| [10] | Souret F F, Weathers P J, Wobbe K K.The mevalonate- |
| [11] | Yan X, Zhang L, Wang J, et al.Molecular characterization and expression of 1-deoxy-D-xylulose-5-phosphate reductoisomerase (DXR) gene from Salvia miltiorrhiza [J].Acta Physiol Plant, 2009, 31(5): 1015-1022. |
| [12] | Dudareva N, Andersson S, Orlova I, et al.The nonmevalonate pathway supports both monoterpene and sesquiterpene formation in snapdragon flowers [J].Proc Natl Acad Sci USA, 2005, 102(3): 933-938. |
| [13] | Kim S M, Kuzuyama T, Chang Y J, et al.Identification of class 2 1-deoxy-D-xylulose-5-phosphate synthase and 1-deoxy-D-xylulose-5-phosphate reductoisomerase genes from Ginkgo biloba and their transcription in embryo culture with respect to ginkgolide biosynthesis [J].Planta Med, 2006, 72(03): 234-240. |
| [14] | Veau B, Courtois M, Oudin A, et al.Cloning and expression of cDNAs encoding two enzymes of the MEP pathway in Catharanthus roseus [J].Biochim Biophys Acta, 2000, 1517(1): 159-163. |
| [15] | Wungsintaweekul J, Sirisuntipong T, Kongduang D, et al.Transcription profiles analysis of genes encoding 1-deoxy-D-xylulose-5-phosphate synthase and 2-C-methyl-D-erythritol-4-phosphate synthase in plaunotol biosynthesis from Croton stellatopilosus [J].Biol Pharm Bull, 2008, 31(5): 852-856. |
| [16] | 吴永娜, 胡静, 王引权, 等.当归肌动蛋白基因片段的克隆及序列分析 [J].中草药, 2012, 43(12): 2485-2489. |
| [17] | Pandit S S, Mitra S S, Giri A P, et al.A quick method for isolating RNA from raw and ripe fleshy fruits as well as for co-isolating DNA and RNA from polysaccharide and polyphenol-rich leaf tissues [J].J Plant Biol, 2007, 50(1): 60-64. |
| [18] | 王惠珍, 张新慧, 李应东, 等.轮作与连作当归光合特性和挥发油的比较 [J].草业学报, 2011, 20(1): 69-74. |
 2014, Vol. 45
2014, Vol. 45


