2. 中山大学, 广东 广州 510275
2. Zhongshan University, Guangzhou 510275, China
静电纺丝(eletrospninning)是一种利用高分子溶液或熔体在强电场作用下形成的喷射流进行纺丝的工艺,是目前制备纳米纤维的一个重要方法。这一技术的关键在于使高分子溶液或熔体在高压静电力的作用下被牵拉成丝,溶剂挥发或熔体冷却凝固后得到纤维状产物,因此这一过程又称为静电纺丝,简称电纺[1]。静电纺丝微纳米纤维具有直径小、比表面积大等优点,能减短药物的扩散距离、促进药物完全释放和提高药效,且根据负载方式及使用材料的不同,对所含药物可实现速释、缓释或受控释放[2],因此近年来利用电纺技术制备载药纤维受到了广泛关注。
丹参素是从丹参中提取的一种水溶性的有效成分,有着广泛的药理作用,包括舒张血管、保护心肌细胞、抗炎、抗氧化[3]等。但由于丹参素结构上带有的多酚羟基的结构,其在碱性条件下极易发生自氧化[4],同时研究还发现丹参素生物利用度低[5],使其在体内应用受到一定的限制。聚己内酯(polycaprolactone,PCL)是一种聚酯类高分子材料,是美国FDA批准的可用于体内的一种合成类的高分子材料[6,7],具有优良的生物相容性、生物降解性以及良好的渗透性,被用作药物控释载体以及与骨相连的软组织的缝合线[8]。近年来,已有文献报道利用PCL负载生长因子[9]、活性蛋白[10]或者是药物[11],通过静电纺丝技术制备各种组织工程支架,但未见丹参素-聚己内酯(DSS-PCL)纳米纤维支架的相关报道。通过将丹参素直接负载到支架上可以避免体内转运过程中的被氧化的风险,将支架直接植入到病灶部位也可以使丹参素直接发挥作用,而避免生物利用度差的问题。本实验将丹参素和PCL通过静电纺丝技术制备载有丹参素的纳米纤维支架,并系统考察了所得载药支架的形貌、药物的释放规律和安全性。
1 仪器和材料TL—01型静电纺丝仪,深圳通力威纳有限公司;TU1900紫外分光光度计,北京普析仪器有限公司;JSM—6330F扫描电镜,日本日立有限公司;Synergy 2多功能酶标仪,美国Biotek有限公司;PCL,相对分子质量50 000,Sigma公司;丹参素钠,相对分子质量220.16,质量分数99%,广州市药检所,批号090843-201309;L929小鼠成纤维细胞,由广东医学院提供。
2 方法和结果 2.1 载药纳米纤维支架的优选及制备 2.1.1 溶剂的选择分别选用二氯甲烷(CH2Cl2)、N,N-二甲基甲酰胺(DMF)及CH2Cl2-DMF混合溶剂为溶剂,考察材料及药物在溶剂中的溶解及载药纳米纤维的制备情况。选用不同质量分数电纺时,PCL的使用质量分数固定为10%。本实验中首先选择了CH2Cl2作为溶剂进行电纺。PCL在CH2Cl2中有良好的溶解性,在浓度为10%的条件下,成功制备得到了PCL纳米纤维,结果如图 1-A所示。但丹参素很难溶解在CH2Cl2中,当把药物加入到CH2Cl2中进行电纺,发现电纺得到的纤维直径极细,同时存在大量的“串珠”(图 1-B),说明丹参素加入后极大地影响了PCL溶液的电纺性。为了保证丹参素的溶解,以DMF为溶剂进行了实验,丹参素能够顺利地溶解在DMF中,但PCL在DMF中溶解度差,无法电纺。当混合溶剂CH2Cl2-DMF(9∶1)时,电纺得到的纤维形貌得到极大改善,结果如图 1-C所示,仅有少量“串珠”存在,且纤维直径变大。当CH2Cl2-DMF(8∶2)时,PCL和丹参素都能够顺利地溶解到溶剂中,同时电纺时也能够顺利地电纺得到纳米纤维(图 1-A、B)。
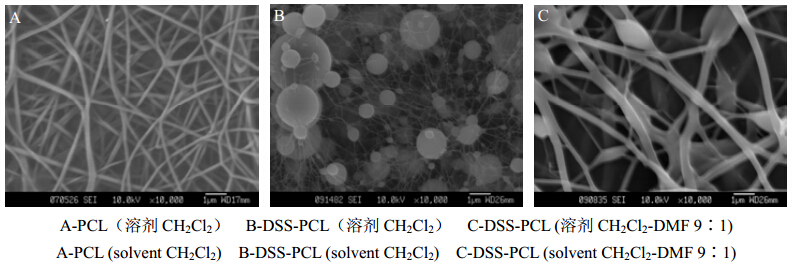 | 图 1 不同溶剂条件下制备的PCL纳米纤维扫描电镜照片Fig. 1 SEM pictures of PCL nanofiber prepared by different solvents |
2.1.2 PCL质量分数的选择
根据“2.1.1”实验确定最佳溶剂后,分别将PCL的质量分数设定为8%、10%、12%,考察在不同质量分数条件下纳米纤维的制备情况。发现当质量分数在8%时,电纺所得的纤维形貌均匀,但孔隙较小,不利于药物的释放扩散(图 2-A)。而当材料质量分数为12%时,所得纤维有融合的现象(图 2-B),因此本实验选择了以CH2Cl2-DMF(8∶2),在这一混合溶剂中,以PCL质量分数为10%进行电纺(图 2-C)。
 | 图 2 不同PCL质量分数条件下制备的纳米纤维扫描电镜照片Fig. 2 SEM pictures of PCL nanofiber prepared at different concentration |
2.1.3 优化条件下载药纳米纤维的制备
称取PCL 1 g 2份,溶于10 mL CH2Cl2-DMF(8∶2)混合溶剂中,溶解完全后分别加入丹参素5 mg和10 mg,于静电纺丝仪中进行电纺,所得纤维膜分别命名为DSS-PCL-1和DSS-PCL-2。电纺过程如下:用5 mL注射器吸取,于20 kV的电压,3 μm/min推进速度的条件下进行电纺,纺丝所用针头为9号针头,用平板接收器进行收集,针头距离接收器的最近距离为15 cm。所有实验在室温条件下进行。
2.2 载药纳米纤维支架的形貌观察采用扫描电镜(SEM)观察电纺纤维膜表面,观察前进行表面喷金处理,电压15 kV。采用Image Pro Plus 6软件对纤维直径进行测量。由图 3的电镜图可以看到,载有不同丹参素量的PCL纳米纤维支架中,纤维的分布非常均匀,没有观察到药物的结晶分布在纤维表面。由图 4的纤维直径的分布图可知,载药纤维DSS-PCL-1直径分布在50~400 nm,平均直径为210 nm,而DSS-PCL-2直径分布在100~400 nm,平均直径为190 nm,二者的平均直径相差不大。
 | 图 3 载药纳米纤维支架扫描电镜图Fig. 3 SEM pictures of drug-loaded nanofiber scaffold |
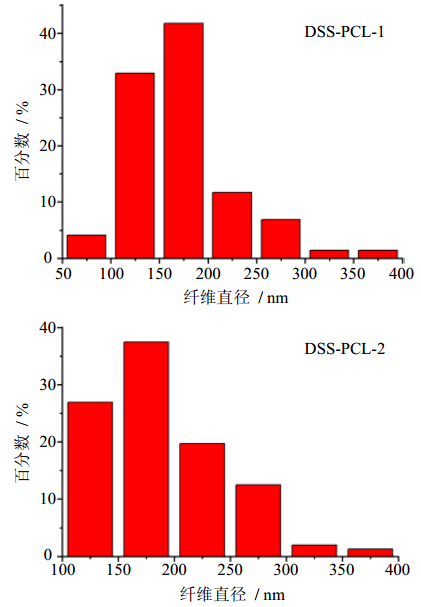 | 图 4 载药纳米纤维支架纤维直径分布图Fig. 4 Diameter distribution of drug-loaded nanofiber scaffold |
2.3 载药纳米纤维支架中丹参素的释放考察
分别称取DSS-PCL-1和DSS-PCL-2载药纳米纤维支架各0.1 g,加入pH 7.4的PBS缓冲液20 mL,在37 ℃水浴中进行释放。分别在设定的时间点取3 mL释放液,同时用PH 7.4的PBS缓冲液补足取出量。每个样品取3个重复样品进行测定。以时间为横坐标,药物的累积释放率为纵坐标作图,结果如图 5所示。图 5给出了载药纳米纤维支架在37 ℃,pH 7.4条件下,7 d内的释放规律,由图 5可以看出,负载有不同量的纳米纤维中药物的释放规律比较相似,都有一个24 h快速释放和随后的一个缓慢释放的过程。
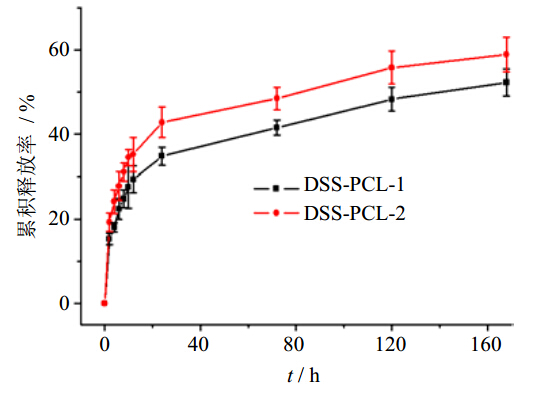 | 图 5 载药纳米纤维支架丹参素的累积释放率Fig. 5 Cumulative release rate of Danshensu from drug-loaded nanofiber scaffold |
2.4 分析方法建立 2.4.1 丹参素标准曲线的绘制
丹参素定量测定方法参考文献进行[12]:精密称取丹参素钠对照品10 mg,溶于10 mL甲醇中。分别精密吸取对照品溶液0.1、0.2、0.5、0.7、0.8、1.0 mL于10 mL量瓶中,加水稀释至刻度,摇匀,得到含丹参素10.2、20.4、51.0、71.4、81.6、102.0 μg/mL系列对照品溶液。分别于紫外分光光度计中测定280 nm处吸光度(A)值,以A值为横坐标(X),以质量浓度为纵坐标(Y),绘制标准曲线,线性回归得方程Y=10 271 X+8.242,r=0.999 9,线性范围为10.2~102.0 μg/mL。
2.4.2 精密度试验精密吸取丹参素低、中、高质量浓度(10.2、51.0、102.0 μg/mL)对照品溶液3 mL,分别于1 d内测定5次,连续测定3 d,记录A值,计算日内及日间精密度。日内精密度RSD分别为0.92%、1.15%、1.67%(n=5),日间精密度RSD分别为1.07%、0.88%、0.92%(n=3),符合方法学要求。
2.4.3 稳定性试验取样品溶液3 mL,分别在0、0.5、1、2、4、7、10 h进样,记录A值。结果表明,峰面积RSD为1.42%,表明在10 h 内样品溶液稳定性良好。
2.4.4 重复性试验精密吸取同一批丹参素-纳米纤维释放液的供试品溶液3 mL,连续测定5次,测定A值,RSD为2.10%(n=5)。
2.4.5 回收率试验精密量取5份已测定的丹参素-纳米纤维释放液的供试品溶液2.5 mL,加入含10.2 μg/mL丹参素的对照品溶液0.5 mL,摇匀制成5份供试液,分别测定A值,计算回收率,丹参素的平均回收率为(101.2±0.97)%,RSD为1.37%。
2.4.6 样品测定精密量取按“2.3”项下制备的丹参素-纳米纤维释放液3 mL,微孔滤膜滤过,重复测定5次,用紫外分光光度计测定280 nm处丹参素的A值,通过标准曲线计算样品中丹参素的量。
2.5 载药纳米纤维的安全性考察 2.5.1 细胞存活率将纳米纤维膜剪成1 cm2大小,紫外灭菌过夜,置于24孔培养板中。将L929小鼠成纤维细胞以104个/孔的密度接种到纤维样品上,加400 μL DMEM(包含10%牛血清蛋白,50 U/mL青霉素和50 U/mL链霉素),于37 ℃、CO2培养箱中进行培养。培养液每2天更换1次。细胞培养1、3、5、7 d后,分别通过MTT法测定细胞的增殖率。分别将20 μL的MTT溶液(5 mg/mL)加入到培养基中,37 ℃、5% CO2孵育4 h。生成的结晶用200 μL DMSO溶解15 min,用多功能酶标仪测量570 nm处的A值。每个时间点重复3孔,以不加纳米纤维孔为对照。结果如图 6所示,由图可以看出,不论是不载药的PCL纳米纤维还是负载有丹参素的纳米纤维,细胞的存活率都维持在90%以上,说明PCL纳米纤维不会影响细胞的生长。
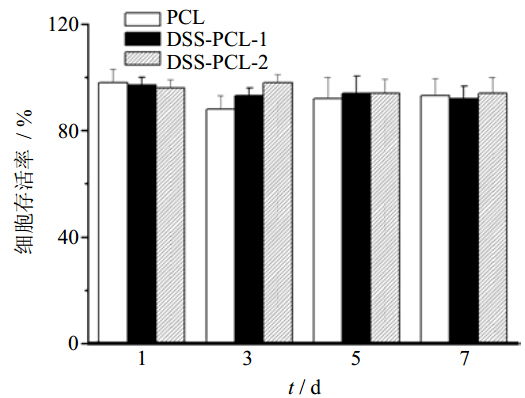 | 图 6 纳米纤维对L929小鼠成纤维细胞存活率的影响Fig. 6 Effect of nanofibers on viability of fibroblast cell in L929 mice |
2.5.2 血液相容性
通过参考文献方法测定样品的溶血率[13]:将0.1 mL加有抗凝剂肝素钠的血液(血液来自昆明小鼠)加入5 mL PBS中,同时加入不同量的PCL、DSS-PCL-1和DSS-PCL-2纳米纤维膜,同时制备100%溶血的阳性对照溶液(将5 mL PBS换成5 mL 0.1% Na2CO3溶液)和0%溶血的阴性对照溶液(5 mL PBS),各组样品分别在37 ℃下孵育1 h,孵育结束后,500 r/min离心5 min,通过紫外分光光度计测定溶液在545 nm处的A值,通过下列公式计算溶血率。材料的溶血率同样是对材料安全性评价的重要指标,随后对纳米纤维的溶血性进行了检测,结果如图 7所示,由图可以看出,各组纳米纤维的溶血率都低于5%,说明材料对红细胞均无明显影响,安全性高。
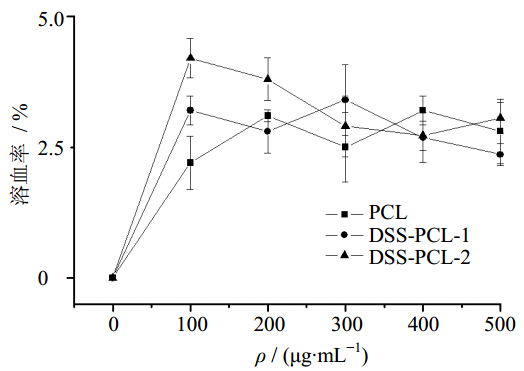 | 图 7 纳米纤维的溶血率Fig. 7 Hemolysis of nanofiber |
溶血率=(A样品-A阴性对照) / A阳性对照
3 讨论要想成功制备得到载药的纳米纤维,溶剂的选择至关重要,理想的溶剂要同时兼顾到材料和药物的溶解。本实验先后选择了CH2Cl2、DMF及CH2Cl2和DMF的混合溶剂进行电纺,最终确定以CH2Cl2- DMF(8∶2)为电纺溶剂,在这一溶剂体系下,PCL和丹参素能够同时溶解,而且电纺得到的纤维均匀平滑,说明这一溶剂体系非常理想。
纤维的直径受到多方面条件的影响,包括电纺溶液的浓度,材料的相对分子质量,所使用的电压及流速等[1]。对于同一材料来说,溶液浓度越高,黏度越大,得到的纤维直径也可能越大。本实验采用的材料浓度为10%,由电镜图观察得到的纤维直径都非常的平滑、均匀,说明这一浓度条件下制得的纤维比较理想。药物的加入有可能会带来溶液离子强度的变化,从而对纤维的形貌造成影响,本实验中观察到的载药纤维也都平整无结节,说明溶剂体系的选择是合理的。从测得的纤维直径来看,加入的药物对纤维直径影响不大。
以往文献报道[1]的载药纳米纤维支架中药物的释放都有一个初期的爆释和随后的一个缓慢释放的过程,这和本实验中观察到的2组载药纤维支架的药物释放规律相符。初期的爆释是由最外层的药物释放造成的,由于纳米纤维的比表面积非常大,初期的释放非常迅速。后期的释放机制主要是扩散,纤维支架中和释放介质中药物的浓度差是释放的主要动力,对于疏水性的材料,这一过程比较缓慢。
静电纺丝技术制备的聚合纳米纤维支架,由于结构上细胞外基质有很高的相似性,因此可以模拟细胞外基质结构,促进细胞的生长,同时还可以负载并缓释多种生物活性分子,使其发挥“生物模板”的功能[13]。本实验中观察到PCL及负载了丹参素后的纳米纤维对细胞的存活率并没有明显影响。如可以利用丹参素在心血管等方面的药理活性,这一载药纳米纤维支架在临床使用中将有广阔的应用前景,这也是本课题组后期的工作中将要深入研究的。
| [1] | Sill T J, von Recum H A.Electrospinning: applications in drug delivery and tissue engineering [J].Biomaterials, 2008, 29(13): 1989-2006. |
| [2] | Huang Z M, Zhang Y Z, Kotaki M, et al.A review on polymer nanofibers by electrospinning and their applications in nanocomposites [J].Composit Sci Technol, 2003, 63(15): 2223-2253. |
| [3] | 张名娟.丹参素的药理作用研究 [J].北方药学, 2012, 9(3): 106-107. |
| [4] | 徐元超, 杨屹, 杜立波, 等.丹参素自氧化与促氧化机理 [J].物理化学学报, 2010, 26(7): 1737-1741. |
| [5] | 潘德城, 孙婷婷, 孙勇兵, 等.单向灌流法研究丹参中丹参素和原儿茶醛大鼠肠吸收特性 [J].中草药, 2011, 42(5): 944-950. |
| [6] | 陈亮, 彭鄂军, 吴柏霖, 等.静电纺丝聚乳酸/聚己内酯共混纤维支架与兔脂肪源干细胞的体外生物相容性研究 [J].华中科技大学学报: 医学版, 2011, 40(5): 513-516. |
| [7] | 杨延慧, 严涵, 康晓梅, 等.聚己内酯的应用研究进展 [J].化工新型材料, 2012, 39(12): 13-15. |
| [8] | 於秋霞, 朱光明, 梁国正.聚ε-己内酯的合成, 性能及应用进展 [J].高分子材料科学与工程, 2004, 20(5): 37-40. |
| [9] | Choi J S, Leong K W, Yoo H S.In vivo wound healing of diabetic ulcers using electrospun nanofibers immobilized with human epidermal growth factor (EGF) [J].Biomaterials, 2008, 29(5): 587-596. |
| [10] | Liao I C, Chew S Y, Leong K W.Aligned core-shell nanofibers delivering bioactive proteins [J].Nanomedicine, 2006, 1(4): 465-471. |
| [11] | Martins A, Duarte A R C, Faria S, et al.Osteogenic induction of hBMSCs by electrospun scaffolds with dexamethasone release functionality [J].Biomaterials, 2010, 31(22): 5875-5885. |
| [12] | 林坚涛, 吴铁, 廖艳, 等.高效液相色谱法测定复方丹参提取液中丹参素含量 [J].中南药学, 2007, 5(1): 22-24. |
| [13] | Zhang R, Ma P X.Synthetic nano-fibrillar extracellular matrices with predesigned macroporous architectures [J].J Biomed Mater Res, 2000, 52(2): 430-438. |
 2014, Vol. 45
2014, Vol. 45


