2. 哈尔滨商业大学 生命科学与环境科学研究中心, 黑龙江 哈尔滨 150076;
3. 海南医学院药学院, 海南 海口 571101
2. Research Center on Life Sciences and Environmental Sciences, Harbin University of Commerce, Harbin 150076, China;
3. School of Pharmaceutical Science, Hainan Medical University, Haikou 571101, China
山楝Aphanamixis polystachya (Wall.) R. N. Parker为楝科(Meliaceae)山楝属Aphanamixis Bl.的乔木,生长在低海拔地区的杂木林中,主要分布于广西、广东、海南等省[1],具有显著的抗肿瘤和抗菌活性[2]。国内外学者从山楝中分离得到一些具有昆虫拒食活性的柠檬苦素[3,4,5,6,7,8]和倍半萜类化合物[9],以及其他的一些次生代谢产物[10,11,12,13,14,15]。本课题组从山楝茎皮的95%乙醇提取物中分离得到一些新的二萜类化合物[16,17],进一步分离又得到3个链状二萜,分别鉴定为 (2Z,6E,10E)-12,14,15-三羟基-3,7,11,15-四甲基十六碳三烯酸甲酯 [(2Z,6E,10E)- methyl 12,14,15-trihydroxy-3,7,11,15-tetramethyl-
hexadeca-2,6,10-trienoate,1)、melidianolic acid A(2)、陵水暗罗素H(nemoralisin H,3)。化合物1为未见文献报道的新化合物,命名为山楝定(aphanamidin);化合物2为首次从该属植物中分离得到,化合物3为首次从该植物中分离得到。
1 仪器与材料Bruker AVШ 600型核磁共振波谱仪(德国Bruker公司);LTQ-Obitrap XL质谱仪(美国Thermo Fisher公司);Perkin-Elmer 341旋光仪(美国Perkin-Elmer公司);Shimadzu UV2550紫外可见分光光度计(日本岛津公司);JASCO J—815圆二色光谱仪(日本JASCO公司);FTIR—8400S红外光谱仪(日本岛津公司);LUMTECH半制备型高效液相色谱仪(德国KNAUER公司);ZORAX SB-phenyl半制备色谱柱(250 mm×10 mm,5 μm)(美国Agilent公司);薄层色谱用硅胶GF254和柱色谱用硅胶(青岛海洋化工有限公司);Sephadex LH-20凝胶为Pharmacia公司产品;常规试剂均为分析纯。
山楝于2013年8月采于海南屯昌县,由海南医学院药学院田建平教授鉴定为楝科山楝属植物山楝Aphanamixis polystachya (Wall.) R. N. Parker。
2 提取与分离山楝茎皮3.0 kg,粉碎,用10倍量的95%乙醇加热回流提取3次,每次2 h,提取液减压回收溶剂后得浸膏80.3 g,分散于水中,依次用石油醚(2 L)和氯仿(2 L)分别萃取3次,回收溶剂后得到氯仿萃取物35.7 g。氯仿萃取物经硅胶(100~200目)柱色谱,石油醚-醋酸乙酯(100∶0→0∶100)梯度洗脱,合并相同组分,得到为6个流分(Fr. A~F)。流分Fr. D(1.7 g)经硅胶柱色谱,石油醚-丙酮(50∶1→0∶100)梯度洗脱,再经半制备型高效液相色谱分离纯化得到化合物1(2.3 mg);流分Fr. E(2.1 g)经Sephadex LH-20柱色谱,氯仿-甲醇(1∶1)洗脱,得到3个流分(Fr. E1~E3)。Fr. E2(175 mg) 经半制备型高效液相色谱分离纯化得到化合物2(3.2 mg)。流分Fr. F (1.9 g)经过反相中压色谱,甲醇- 水(50∶50→0∶100)梯度洗脱,得到4个流分Fr. F1~F4。Fr. F3(180 mg)经半制备型高效液相色谱分离纯化,得到化合物3(4.5 mg)。
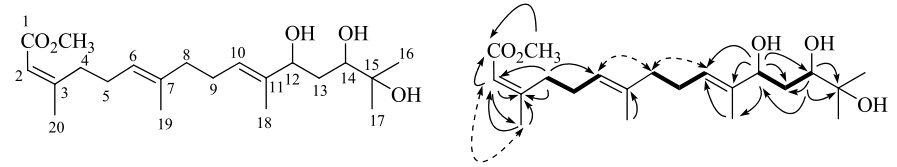
3 结构鉴定化合物1:无色油状物,10%硫酸-乙醇溶液显紫红色。[α]25D -26.0° (c 0.1,MeOH)。IR光谱给出羟基(3 407 cm-1)和酯羰基(1 707 cm-1)特征吸收峰。HR-ESI-MS m/z: 391.245 5 [M+Na]+(C21H36O5Na,计算值391.246 0),从而确定分子式为C21H36O5。1H-NMR (600 MHz,CD3OD) 谱(表 1)低场区给出3个烯氢信号δH5.68 (1H,s),5.43 (1H,t,J = 6.6 Hz) 和5.19 (1H,t,J = 6.6 Hz),2个连氧次甲基质子信号δH 4.21 (1H,t,J = 6.6 Hz) 和3.29 (1H,dd,J = 10.8,1.2 Hz),1个甲氧基信号δ 3.65 (3H,s);高场区给出5个甲基单峰信号δH 1.12 (3H,s),1.15 (3H,s),1.61 (3H,s),1.64 (3H,s) 和1.90 (3H,s)。13C-NMR (150 MHz,CD3OD) 谱中给出21个碳信号,高场区给出5个甲基信号δC 11.2,16.3,25.2,25.6和25.9,5个亚甲基信号δC 27.5,27.9,34.5,37.1和40.6,2个连氧亚甲基信号δC 78.2和78.3,1个连氧季碳信号δC73.6,1个甲氧基信号δC 51.4。低场区给出3组烯碳信号δC162.4,137.9,136.9,128.2,125.0和116.9,1个羰基信号δC 168.6。根据以上数据,推测化合物1为无环链状二萜类化合物,并与melidianolic acid A(2)具有相同的骨架。将1和2的NMR数据比较发现,化合物1除了比2多1个甲氧基外,在碳谱中,C-10~13及C-18数据相差较大,C-12的化学位移由2中的δC 36.6向低场位移到1中的δC78.2;而在氢谱中,C-12位的亚甲基质子由2中的δH 2.06 (1H,t,J = 6.6 Hz) 和δH 2.25 (1H,m) 变为1中的次甲基质子δH 4.21 (1H,t,J = 6.6 Hz),化学位移和耦合常数的变化均提示化合物1结构中C-12位连有羟基。在HMBC谱(图 1)中,甲氧基质子信号δH3.65和C-1 (δC 168.6) 存在远程相关,而C-12上的质子信号与C-10 (δC 128.2),C-11 (δC 137.9),C-13 (δC 37.1),C-14 (δC 78.3) 和C-18 (δC 11.2) 存在远程相关,从而确证了化合物1中的甲氧基连在羰基上,羟基位于C-12。化合物1的双键构型是通过与2比较和NOESY相关确定的。在NOESY图谱(图 1)中,H-2与20-CH3,H-6与H-8以及H-10与H-12存在NOE效应,从而可以确定6位和10位的双键为反式以及2位的双键为顺式。C-12和C-14的绝对构型未能确定。结合HSQC、HMBC、NOESY谱图,并参考文献报道[18,19,20]确定化合物1为 (2Z,6E,10E)-12,14,15-三羟基-3,7,11,15-四甲基十六碳三烯酸甲酯,为新化合物,命名为山楝定,其NMR信号归属见表 1。
|
图 1 化合物1的结构及1H-1H COSY (━)、HMBC (→) 和NOESY (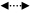 ) 相关
Fig.1 Structures and 1H-1H COSY (━),HMBC (→) and NOESY ( ) 相关
Fig.1 Structures and 1H-1H COSY (━),HMBC (→) and NOESY ( ) correlations of compound 1 ) correlations of compound 1
|
| 表 1 化合物1的1H-NMR (600 MHz,CD3OD)、13C-NMR(150 MHz,CD3OD) 数据和HMBC相关 Table 1 1H-NMR (600 MHz,CD3OD),13C-NMR (150 MHz,CD3OD) dataand HMBC correlations of compound 1 |
化合物2:无色油状物。1H-NMR (600 MHz,CD3OD) 和13C-NMR (150 MHz,CD3OD) 数据见表 2。
| 表 2 化合物2和3的1H-NMR (600 MHz,CD3OD)和13C-NMR数据 (150 MHz,CD3OD) Table 2 1H-NMR (600 MHz,CD3OD) and 13C-NMR (150 MHz,CD3OD)dataof compounds 2 and 3 |
以上数据与文献报道基本一致[20],故鉴定化合物2为melidianolic acid A。
化合物3:无色油状物。1H-NMR (600 MHz,CD3OD) 和13C-NMR (150 MHz,CD3OD) 数据见表 2。以上数据与文献报道基本一致[21],故鉴定化合物3为陵水暗罗素H。
| [1] | 中国科学院中国植物志编辑委员会.中国植物志 [M].北京: 科学出版社, 1997. |
| [2] | Chan L L, George S, Ahmad I, et al.Cytotoxicity effects of Amoora rohituka and chittagonga on breast and pancreatic cancer cells [J].Evid Based Complement Alternat Med, 2011, 2011: 1-8. |
| [3] | ZhangY, Wang J S, Wang X B, et al.Limonoids from the fruits of Aphanamixis polystachya (Meliaceae) and their biological activities [J].J Agric Food Chem, 2013, 61(9): 2171-2182. |
| [4] | Cai J Y, Zhang Y, Luo S H, et al.Aphanamixoid A, a potent defensive limonoid, with a new carbon skeleton from Aphanamixis polystachya [J].Org Lett, 2012, 14(10): 2524-2527. |
| [5] | Wang J S, Zhang Y, Wang X B, et al.Aphanalides A—H, ring A-seco limonoids from the seeds of Aphanamixis polystachya [J].Tetrahedron, 2012, 68(21): 3963-3971. |
| [6] | Zhang Y, Wang J S, Wang X B, et al.Aphapolynins A and B, two new limonoids from the fruits of Aphanamixis polystachya [J].Tetrahedron Lett, 2011, 52(20): 2590-2593. |
| [7] | Yang S P, Chen D H, Liao S G, et al.Aphanamolide A, a new limonid from Aphanamixis polystachya [J].Org Lett, 2011, 13(1): 150-153. |
| [8] | Mulholland D S, Naidoo N.Limonoids from Aphanamixis polystacha [J].Phytochemistry, 1999, 51(7): 927-930. |
| [9] | Chowdhury R, Hasan C M, Rashid M A.Guaiane sesquiterpenes from Amoora rohituka [J].Phytochemistry, 2003, 62 (8): 1213-1216. |
| [10] | Chandrasekharan S, Chakraborty T.Aphanamixol, a diterpene alcohol from Aphanamixis polystacha (Wall) Parker [J].J Indian Chem Soc, 1968, 45: 208-210. |
| [11] | Jain S A, Srivastava S K.8-C-methyl-quercetin-3-O- β-D-xylopyranoside, a new flavone glycoside from the roots of Amoora rohituka [J].J Nat Prod, 1985, 48(2): 299-301. |
| [12] | Sadhu S K, Phattanawasin P, Choudhuri S, et al.A new lignan from Aphanamixis polystachya [J].J Nat Med, 2006, 60(4): 258-260. |
| [13] | Harmon A D, Weiss U, Silverton J V.The structure of rohitukine, the main alkaloid of Amoora rohituka (syn.Aphanamixis polystachya) (Meliaceae) [J].Tetrahedron Lett, 1979, 20(8): 721-724. |
| [14] | Bhatt S K, Saxena V K, Nigam S S.A new saponin from seeds of Amoora rohituka [J].Phytochemistry, 1981, 20(7): 1749-1750. |
| [15] | Daulatabad C D, Jamkhandi S A M.A keto fatty acid from Amoora rohituka [J].Phytochemistry, 1997, 46(1): 155-156. |
| [16] | Wu H F, Zhang X P, Wang Y, et al.Four new diterpenes from Aphanamixis polystachya [J].Fitoterapia, 2013, 90: 126-131. |
| [17] | Zhang X P, Tan Y F, Li Y B, et al.Aphanamixins A–F, acyclic diterpenoids from the stem bark of Aphanamixis polystachya [J].Chem Pharm Bull, 2014, 62(5): 494-498. |
| [18] | Wu S Q, Xu N Y, Zhang J, et al.Three new acyclic diterpenoids from Eupatorium lindleyanum DC [J].J Asian Nat Prod Res, 2012, 14(7): 652-656. |
| [19] | He X F, Wang X N, Fan C Q, et al.Chemical constituents of Polyalthia nemoralis [J].Helv Chim Acta, 2007, 90(4): 783-791. |
| [20] | Astulla A, Hirasawa Y, Rahman A, et al.Melidianolic acid A and B, new antimalarial acyclic diterpenes from Aphanamixis grandifolia [J].Nat Prod Commun, 2011, 6(3): 323-326. |
| [21] | Zhang H Y, Yuan C M, Cao M M, et al.New acyclic diterpenoids from the fruits of Aphanamixis grandifolia and structure revision of nemoralisin B [J].Phytochem Lett, 2014, 8: 81-85. |
 2014, Vol. 45
2014, Vol. 45


