2. 北京市中医养生学重点实验室, 北京 100029;
3. 教育部中医养生学重点实验室, 北京 100029
2. Beijing Key Laboratory of Health-cultivation, Beijing 100029, China;
3. Health-cultivation Laboratory, Ministry of Education, Beijing 100029, China
分离纯化在药学研究中具有重要的作用。传统分离纯化手段主要是采用柱色谱(column chromatography,CC),但CC在使用过程中操作比较繁琐,装柱所需硅胶量大,不可连续加样洗脱,无法实现在线监测等。少量样品可以采用制备薄层色谱(preparative thin-layer chromatography,PTLC)分离纯化,但PTLC存在展开时间长,分离完成后需刮板提取,提取过程中易引入杂质等缺点。为克服这些缺点,离心薄层色谱(centrifugal thin-layer chromatography,CTLC)应运而生。
CTLC又称旋转薄层色谱,是在PTLC基础上发展起来的一种色谱技术。与传统的PTLC和CC相比,CTLC具有诸多优势。CTLC的分离操作可以实现自动化,铺板所需硅胶量较少,涂层涂料不仅可以是硅胶、氧化铝等吸附剂,还可以是离子交换凝胶、葡萄糖凝胶等,CTLC的薄层板可以重复使用。CTLC可以实现连续加样、梯度洗脱、在线监测等操作,具有仪器简单、操作简便、分离效果好等优点。该技术最初应用在药物合成中,对合成产物进行分离纯化。随着技术的发展,有学者将其与其他色谱技术联用,用于对成分复杂的天然产物的分离纯化,如萜类、生物碱、黄酮类、苯丙素类及其他成分。本文将着重介绍CTLC的参数优化研究及其在药物合成和天然产物分离纯化中的应用。
1 离心薄层色谱 1.1 基本原理CTLC建立在经典的薄层色谱基础上,根据样品在固定相和流动相之间吸附和分配作用的不同,利用离心力,加速流动相的流动,使样品之间的比移值的差值(ΔRf)变大,从而提高样品的分离效率。其原理见图 1。样品和流动相通过管路加至薄层板中央的空白处,在离心力的推动下,流动相流经薄层板表面,样品在固定相与流动相之间不断地进行吸附与解吸附,在薄层板上形成多个同心的样品环。根据不同成分在薄层板上展开时Rf值的不同,实现样品的分离纯化。
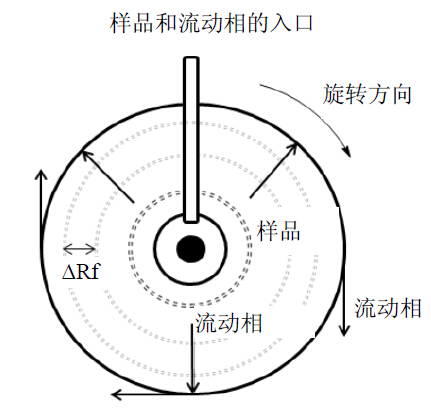 | 图 1 CTLC原理图 Fig. 1 Schematics of CTLC |
CTLC的分离效果与薄层板的涂层材料、涂层厚度、转速和洗脱液的流速等因素有关。CTLC薄层板的涂层材料不仅可以是吸附剂,还可以是凝胶等,这在一定程度上拓宽了CTLC的应用范围。Stahl等[1]对CTLC各参数对分离效果的影响进行了系统研究。研究表明,涂层材料和涂层厚度对分离度具有一定的影响,其中,涂层厚度对于分离度的影响可以通过增加流速等措施部分抵消。当薄层板涂层材料和厚度一定时,转速和流速对分离度的影响最为明显。
适当地提高转速和流速,会使分离度变大,分离时间缩短。转速过高,流速过快,则会使分离度降低,试剂用量加大。在确保最大分离度的前提下,兼顾分离时间短和溶剂消耗少等因素,采用中等转速和流速比较适宜。一般最佳流速为3~6 mL/(min∙mm),最佳转速为在洗脱液恰好流经薄层时的转速基础上增加100~200 r/min[1]。
2 在药物合成中的应用药物合成在药学研究中占有极其重要的地位。利用具有良好药理活性的天然产物作为先导化合物,通过对其进行结构修饰或拼合,合成出药效更好、毒副作用更小、靶向性更强的产物,一直是药学研究中的一大热点。对合成产物的分离纯化,大多采用硅胶柱。CTLC的出现,实现了快速分离纯化的目的,广泛应用于药物合成产物的分离纯化。主要分为2个方面:(1)手性化合物的拆分;(2)合成产物的分离纯化。
2.1 手性化合物的拆分手性化合物是一类分子式和结构式相同,但左右排列顺序不同的一类化合物,在生物体内具有很好的立体选择性。这类化合物虽然具有许多相同的理化性质,有时却具有不同的药理活性,因此,许多国家规定,申报手性药物时,必须拆分其相应的立体异构体。用于手性化合物拆分的主要色谱分离方法有薄层色谱、气相色谱、高效液相色谱和毛细管电泳法等。CTLC作为TLC的一种替代方法,应用于拆分手性化合物。以异硫氰酸羧酸酯和醛亚胺为原料,通过曼尼希反应合成2,3-二氨基琥珀酸衍生物的反应中产生了多种手性化合物,Dariusz等[2]利用CTLC对这些手性化合物的顺反异构体进行了分离,得到了相应的单体化合物(表 1)。
|
|
表 1 2,3-二氨基琥珀酸部分衍生物顺/反异构体的分离 Table 1 Separation of cis-/trans-isomers of 2,3-diaminosuccinic acid derivatives |
CTLC技术自发明以来,就广泛应用于药物合成中反应产物的分离纯化。由于合成反应中产物比较简单,样品量相对较小,特别适合运用CTLC对其进行分离纯化。与传统的PTLC和CC相比,CTLC具有诸多优势,如分离效果好、分离时间短、无须刮板提取、减少了杂质的引入、操作简便等,因此,其在药物合成中得到了广泛的应用。表 2总结了利用CTLC分离纯化合成产物的部分研究结果。
|
|
表 2 CTLC分离纯化合成产物的部分研究结果 Table 2 Separation and purification of synthesized products by CTLC |
随着CTLC技术的发展,越来越多的学者将其应用到天然产物的分离纯化中。由于天然产物样品比较复杂,单纯的采用CTLC并不能取得很好的分离效果,因此,普遍采取与其他色谱技术联用,实现对复杂样品的分离。目前,主要利用CTLC对生物碱以及一些紫外吸收相对较弱的天然产物如萜类和甾体类等进行分离纯化,具有很好的分离效果。也有部分学者利用CTLC对一些其他类型的化合物进行分离纯化,如黄酮和苯丙素类等。
3.1 生物碱生物碱是自然界中广泛存在的一类含氮有机化合物,大多具有显著的生理活性,具有很高的药用价值,因此,利用现代分离技术分离纯化生物碱具有非常重要的意义。传统的分离纯化手段主要为溶剂法、柱色谱法和树脂吸附等。其中CC仍然是分离纯化生物碱的重要手段之一。CTLC作为一种快速分离技术,其涂层材料可以是硅胶、氧化铝和凝胶等色谱填料,可以替代CC,实现对不同极性生物碱的快速分离、纯化,具有很好的分离效果,在分离纯化生物碱方面具有独特的优势。表 3总结了利用CTLC分离纯化生物碱的部分研究结果。
|
|
表 3 CTLC分离纯化生物碱的部分研究结果 Table 3 Separation and purification of alkaloids by CTLC |
萜类化合物在自然界中分布广泛,植物、动物、菌类及海洋生物中均有分布。现代药理研究表明,萜类具有诸多药理活性,是一类重要的活性成分。其结构是由多个异戊二烯单位组成,紫外吸收较弱,因此,在对此类化合物进行分离纯化时,大多采用柱色谱法。CTLC作为柱色谱的替代手法,有效实现了萜类化合物的快速分离纯化,并得到了很好的分离效果。其中以三萜及其苷类化合物[16,17,18,19]居多,也分离得到了一些其他类型的萜类,如倍半萜[20]、倍半萜内酯[21]和二萜苷[22]等。表 4总结了利用CTLC分离纯化萜类化合物的部分研究结果。
|
|
表 4 CTLC分离纯化萜类化合物的部分研究结果 Table 4 Separation and purification of terpenoids by CTLC |
甾体类化合物是一类与生活息息相关的化合物,由其研发而来的药品十分普遍,对诸多疾病发挥着重要的治疗作用,因此,对甾体类化合物,特别是甾体皂苷的研究,一直是国内外天然产物研究的重点之一。CTLC对甾体类化合物也具有很好的分离纯化效果,但国内外利用CTLC分离纯化甾体类化合物的研究却很少。Cota等[23]对乌桕茎叶的生物活性进行研究时,对其化学成分进行了分离纯化。利用CTLC,采用正己烷-二氯甲烷-甲醇作为洗脱液,分离得到β-谷甾醇。De Castro Ferreira Gomes等[24]利用CTLC方法,采用正己烷-醋酸乙酯作为洗脱剂,对Pithecellobium cauliflorum中的2种甾体皂苷类成分进行了分离纯化。鉴于CTLC与CC相比存在的诸多优点,应将其更多地应用到对甾体化合物的分离纯化中,实现快速分离纯化的目的。
3.4 其他CTLC对其他类型的化合物也具有很好的分离纯化效果,特别是一些极性较大的化合物,CTLC克服了CC存在的诸多缺点,可以实现重复连续上样,重复利用,且操作简便。与HPLC相比,CTLC经济实惠,上样量大。因此,CTLC是一种很好的快速分离手段。目前,国内外利用CTLC已经分离得到了部分黄酮、苯丙素类、糖和核苷类化合物(表 5)。
|
|
表 5 CTLC分离纯化其他类天然产物的部分研究结果 Table 5 Separation and purification of other natural products by CTLC |
De Oliveira等[29]利用CTLC,采用正己烷-醋酸乙酯作为洗脱剂,对商业甜菊糖中的莱鲍迪苷A、B进行了分离。Das等[30]建立了一种快速有效分离酸性和中性糖脂的方法。该方法利用CTLC,采用氯仿-甲醇-水(60∶35∶8)作为洗脱剂,可以在45~60 min内实现糖脂的快速分离。此外,CTLC对一些核苷衍生物也具有一定的分离效果[31]。
4 结语与展望CTLC作为一种快速分离技术,克服了CC存在的操作繁琐、无法连续加样、无法在线检测等缺点,经济实惠,可以替代CC、PTLC、凝胶色谱等多种色谱技术,多年来一直被广泛应用于合成产物的分离纯化。近年来,随着CTLC技术的发展,越来越多的学者将其应用于天然产物的分离纯化,并取得了很好的分离效果。目前,CTLC技术在天然产物分离纯化中的应用还处于初始阶段,国内外与其相关的研究很少且相对集中,分离得到的化合物主要以萜类和生物碱为主,在一些其他类型的化合物如黄酮、甾体、苯丙素类等中的应用很少。因此,加强CTLC技术在中药研究中的应用具有重要的意义。
虽然CTLC技术具有诸多优点,但该技术也不是很成熟,也存在一些问题。其中最主要的问题是在样品收集过程中容易出现交叉污染。造成该问题的主要原因是在样品收集过程中液体的喷溅。虽然适当降低转速和流速可以在一定程度上减少喷溅,但其分离效率会降低。比较可行的办法是适当改变洗脱剂的比例,优化仪器参数,增大峰的分离度或适当减少进样量。虽然CTLC技术本身还不是很完美,但其具有分离速度快、分离效率高、操作简便、经济实惠等优点,显示了该技术存在的巨大价值。随着技术的发展,CTLC将发展的更加完善,有望替代CC,成为天然产物研究中的一种新的重要的快速分离手段得到广泛应用。
| [1] | Stahl E, MiJller J. Parameters of preparative centrifugal thin-layer chromatography [J]. Chromatographia, 1982, 15(8): 493-497. |
| [2] | Dariusz Ciez, A, Justyna B, Kalinowska-Tłuscik A, et al. An approach to 2, 3-diaminosuccinic acid derivatives- synthesis of 2-thioxo-1, 3-imidazolidines by a mannich reaction [J]. Aust J Chem, 2012, 65: 333-342. |
| [3] | Miller R B, Case W S. Radial chromatography for the separation of nitroaniline isomers [J]. J Chem Educ, 2011, 88: 1328-1330. |
| [4] | Chartoire A, Comoy C, Fort Y. Toolbox for regioselective lithiations of furo [2, 3-c] pyridine [J]. J Org Chem, 2010, 75: 2227-2235. |
| [5] | Massicot F, Moririarte A, Brigaud T, et al. Synthesis of trifluoromethylcyclohexyl, cyclohexenyl and aryl compounds via stepwise Robinson annulation [J]. Org Biomol Chem, 2011, 9: 600-603. |
| [6] | Kitamura T, atsuyuki J, Taniguchi H. 1, 2- disulphenylation of alkenes induced by a hyper- valentlodine (III) reagent [PhIO-TfOH] [J]. J Chem Soc Perkin Trans, 1991, 6: 1607-1608. |
| [7] | Martinez A, Gil C, Castro A, et al. Benzothiadiazine dioxides (BTD) derivatives as non-nucleoside human cytomegalovirus (HCMV) inhibitors. Study of structural requirements for biological activity [J]. Bioorg Med Chem, 2003, 11: 2395-2402. |
| [8] | Alonso D, Dorronsoro I, Rubio L, et al. Donepezil-tacrine hybrid related derivatives as new dual binding site inhibitors of AChE [J]. Bioorg Med Chem, 2005, 13: 6588-6597. |
| [9] | Jasselin-Hinschberger A, Comoy C, Chartoire A, et al. Successive regioselective metalations of fused heterocycles: Synthesis of polyfunctionalized Furo [3, 2-b] pyridines [J]. J Org Chem, 2013, 78: 5618-5626. |
| [10] | 杨峻山, 陈玉武. 胡蔓藤生物碱的化学研究I. 生物碱的分离与胡蔓藤碱甲的结构 [J]. 药学学报, 1983, 18(2): 104-112. |
| [11] | Couet C E, Crews C, Hanley A B. Analysis, separation, and bioassay of pyrrolizidine alkaloids from comfrey (Synphytum officinale) [J]. Nat Toxins, 1996, 4: 163-167. |
| [12] | Kam T S, Choo Y M. Angustilodine, an unusual pentacyclic indole alkaloid from alstonia [J]. Helv Chim Acta, 2004, 87: 366-369. |
| [13] | Yurdanur Y, Huseyin A. Benzofurans and another constituent from seeds of Styrax officinalis [J]. Phytochemistry, 2003, 63: 939-943. |
| [14] | Muhammad I, Dunbar D C, Takamatsu S, et al. Antimalarial, cytotoxic, and antifungal alkaloids from Duguetia hadrantha [J]. J Nat Prod, 2001, 64: 559-562. |
| [15] | Glover R P, Yoganathan K, Butler M S. NMR spectral assignments of three aspidofractinine alkaloids, kopsine, fruticosine and fruticosamine [J]. Magn Reson Chem, 2005, 43: 483-485. |
| [16] | Dubois M A, Bauer R, Cagiotti M R, et al. Foetidissimoside A, a new 3, 28-bidesmosidic triterpenoid saponin, and cucurbitacins from Cucurbita foetidissima [J]. Phytochemistry, 1988, 27(3): 881-885. |
| [17] | Orsini F, Verotta L. Separation of natural polar substances by reversed-phase high-performance liquid chromato- graphy, centrifugal thin-layer chromatography and droplet counter-current chromatography [J]. J Chromatogr, 1985, 349: 69-75. |
| [18] | Teha C H, Moritab H, Shirota O, et al. 2, 3-dehydro- 4a-hydroxylongilactone, a novel quassinoid and two known phenyl propanoids from Eurycoma longifolia Jack [J]. Food Chem, 2010, 120: 794-798. |
| [19] | Sadaquat A, Renee G, Subramaniam S, et al. Benzo- phenones of Garcinia pseudoguttifera (Clusiaceae) [J]. Phytochemistry, 2000, 53: 281-284. |
| [20] | Reina M, Orihuela J C, Gonzalez-Coloma A, et al. Four illudane sesquiterpenes from Coprinopsis episcopalis [J]. Phytochemistry, 2004, 65: 381-385. |
| [21] | Peters A M, Haagsma N, Gensch K H, et al. Production and characterization of polyclonal antibodies against the bitter sesquiterpene lactones of chicory (Cichorium intybus L.) [J]. J Agric Food Chem, 1996, 44: 3611-3615. |
| [22] | Snook M E, Johnson A W, Severson R F, et al. Hydroxygeranyllinalool glycosides from tobacco exhibit antibiosis activity in the tobacco budworm [Heliothis virescens (F.)] [J]. J Agric Food Chem, 1997, 45: 2299-2308. |
| [23] | Cota B B, Johann S, Oliveira D M, et al. Biological potential of Stillingia oppositifolia [J]. Rev Bras Farmacogn Braz J Pharmacogn, 2011, 21(1): 70-77. |
| [24] | De Castro Ferreira Gomes D, Alegrio L V. Acyl steryl glycosides from Pithecellobium cauliflorum [J]. Phytochemistry, 1998, 49(5): 1365-1367. |
| [25] | Takeara R, Albuquerque S, Lopes N P, et al. Trypanocidal activity of Lychnophora staavioides Mart. (Vernonieae, Asteraceae) [J]. Phytomedicine, 2003, 10: 490-493. |
| [26] | Wollenweber E, D?rsam M, D?rr M, et al. Chemodiversity of surface flavonoids in Solanaceae [J]. Z Naturforsch, 2005, 60: 661-670. |
| [27] | Hamburger M, Gupta M, Hostettmannt K. Coumarins from Polygala paniculata [J]. Planta Med, 1985, 3: 215-217. |
| [28] | Murugaiyah V, Chan K L. Determination of four lignans in Phyllanthus niruri L. by a simple high-performance liquid chromatography method with fluorescence detection [J]. J Chromatogr A, 2007, 1154: 198-204. |
| [29] | De Oliveira B H, Packer J F, Chimelli M, et al. Enzymatic modification of stevioside by cell-free extract of Gibberella fujikuroi [J]. J Biotechnol, 2007, 131: 92-96. |
| [30] | Das K K, Basu M, Basu S. A rapid preparative method for isolation of neutral and acidic glycosphingolipids by radial thin-layer chromatography [J]. Anal Biochem, 1984, 143: 125-134. |
| [31] | María-Cruz B, Alessandra C, Ernesto Q, et al. Selective inhibition of human immunodeficiency virus type 1 (HIV-1) by a novel family of tricyclic nucleosides [J]. Antiviral Res, 2011, 92: 37-44. |
 2014, Vol. 45
2014, Vol. 45


