2. 甘肃省高校中(藏)药化学质量研究省级重点实验室, 甘肃 兰州 730000;
3. 甘肃中医学院中(藏)药资源研究所, 甘肃 兰州 730000;
4. 甘肃中医学院药用植物遗传育种研究所, 甘肃 兰州 730000
2. Key Laboratory of Chemistry and Quality for Traditional Chinese Medicines of College of Gansu Province, Lanzhou 730000, China;
3. Research Institute of Medicinal Plant Genetic Breeding, Lanzhou 730000, China;
4. Centre of Urban Ecology and Environmental Biotechnology, Lanzhou City University, Lanzhou 730000, China
中麻黄Ephedra intermedia Schrenk ex Mey. 是麻黄科中麻黄属多年生小灌木植物,主产于甘肃、青海、陕西、新疆、河北、山东、内蒙等省区,以西北地区最为常见。生于海拔数百米至2 000多米的干旱地区,沙漠地区以及干旱的山坡或草地上,是被《中国药典》2010年收录的正品麻黄之一,也是甘肃省的主产药材之一[1,2]。由于近年来滥采乱挖现象严重,致使中麻黄野生资源日渐枯竭,地面覆盖逐年减少,已成为濒危药用植物[3]。因此,中麻黄资源的可持续性利用和保护工作势在必行。
近年来,DNA分子标记技术已在植物种质资源利用与保护方面得到广泛应用,并成为研究热点[4,5,6,7]。简单重复序列区间(inter simple sequence repeat,ISSR)是由Zietkiewicz等于1994年发展的一种基于微卫星系列的新的分子标记技术,用于检测简单重复序列(simple sequence repeat,SSR)间DNA序列差异,具有不需要知道序列信息、简便、快捷、重复性好等特点[8]。因此,本研究利用ISSR分子标记技术对甘肃不同居群中麻黄品种进行遗传多样性分析,为中麻黄资源的合理开发、利用、保护和育种工作提供遗传学理论基础。
1 材料与仪器 1.1 材料材料为甘肃省不同居群中麻黄地上草质茎,采集信息见表 1,采样时选取无病虫害的幼嫩地上茎,放入装有硅胶的塑封袋中迅速干燥,并带回实验室于-20 ℃冰柜中保存。全部样品由甘肃中医学院中药资源教研室晋玲教授鉴定为麻黄科(Ephedraceae)中麻黄Ephedra intermedia Schrenk ex Mey. 的原植物。
|
|
表 1 植物材料信息 Table 1 Information of plant materials |
凝胶成像系统(美国Bio-Rad);PCR扩增仪(德国Biometra);台式高速冷冻离心机(湖南凯达科学仪器有限公司TGL16M型);DYY—7型电泳仪(北京六一仪器厂);电泳槽(北京六一仪器厂)。
ISSR随机引物(根据British Columbia大学公布的序列设计,由南京金斯瑞生物科技有限公司合成);CTAB、EDTA、SDS、Tris、PVP、β-巯基乙醇(西安科昊生物工程有限责任公司);RNaseA、Agarose琼脂糖、EB、TaqDNA聚合酶,dNTPs,10×缓冲液(北京鼎国昌盛生物技术有限责任公司);其他化学试剂均为国产分析纯。
2 方法 2.1 基因组DNA提取及检测采用改良CTAB法[9]提取不同居群中麻黄样本基因组DNA,用琼脂糖凝胶电泳法检测DNA的完整性,适当稀释后保存于-20 ℃冰箱中备用。
2.2 ISSR-PCR反应体系与扩增程序反应总体系为20 μL,内含10×PCR 缓冲液(Mg2+ Plus)2.0 mmol/L,Taq DNA聚合酶1.5 U,引物0.4 μmol/L,dNTPs 0.25 mmol/L以及DNA模板30 ng。扩增程序:94 ℃预变性4 min,94 ℃变性45 s,根据不同引物的退火温度复性45 s,72 ℃延伸2 min,40个循环,72 ℃延伸7 min,4 ℃保存结束反应。
2.3 供试样品电泳检测用筛选出的12条ISSR引物[10]按其最佳退火温度(表 2)逐条对11个不同居群样本基因组DNA进行PCR扩增。反应结束后进行1.2%琼脂糖凝胶电泳检测,电泳缓冲液为1×TBE,电压100 V下电泳90 min左右,EB(10 mg/mL)染色20 min,在凝胶成像系统下检测并拍照保存。
|
|
表 2 不同引物ISSR引物最佳退火温度 Table 2 Optimal annealing temperature for PCR reaction by different ISSR primers |
采用人工读带法,在相同迁移率位置上,有带记为1,无带记为0,建立数据矩阵。利用Popgen32软件对数据资料进行遗传多样性统计,分析各居群多态位点百分率(PPL)、Nei’s基因多样性指数(H)、Shannon’s多态性信息指数(I)、居群总基因多样性(Ht)、居群内基因多样性(Hs)、基因分化系数(Gst),基因流(Nm)、Nei’s遗传一致度和遗传距离(D),并根据Nei’s遗传距离进行UPGMA聚类分析,应用NTSYS软件构建系统树状图。
3 结果与分析 3.1 ISSR-PCR扩增结果用筛选出的12条ISSR引物对所有中麻黄基因组DNA进行扩增和电泳检测。结果显示,大部分样本均能扩增出清晰、数量多的条带,扩增产物碱基数在200~2 000 bp。引物UBC-866和UBC-895对甘肃省兰州市安宁区兴隆山中麻黄居群14个样本的扩增图谱见图 1。
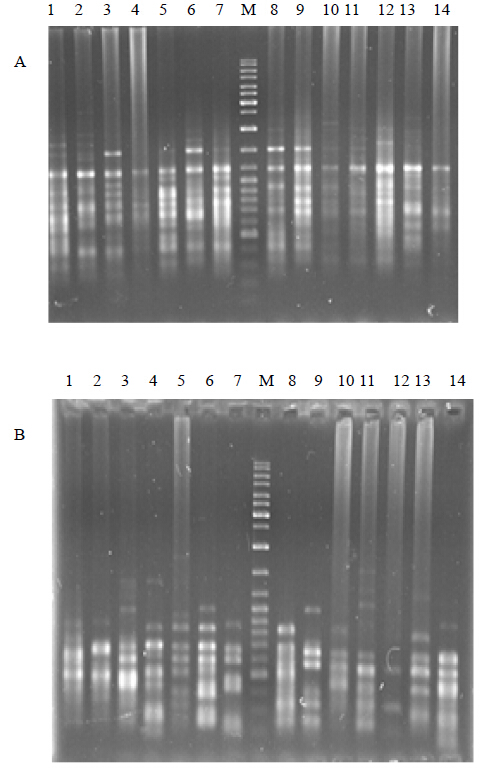 | 1~14-样品 M-Marker 1—14-samples M-Marker图 1 UBC-866 (A) 和UBC-895 (B) 对xls居群部分样本的扩增结果 Fig. 1 Amplification of samples from xls population by UBC-866 (A) and UBC895 (B) |
12条引物对11个居群的163个个体进行了ISSR分析,共检测到位点175个,其中多态性位点150个,PPL值为85.71%,说明中麻黄具有较高的遗传多样性。根据Popgen软件统计结果(表 3),中麻黄居群间的H为0.211 4,I为0.332 1,而不同居群内的PPL在21.14%~62.29%,其中最高的是rss;最低的是glhzt-z。H为0.084 6~0.201 3,I为0.123 3~0.305 9,H和I的大小与各PPL的高低趋势基本一致,各项系数均是rss最高,glhzt-y的栽培居群最低。此外,由于居群间的PPL、H和I均高于各居群内的值,说明中麻黄的居群内的遗传多样性水平低于居群间。Wright提出当基因流Nm>1时,居群间存在一定的基因流,其值越大基因交流越强[11],在中麻黄的11个居群中,Nm值为1.428 6,表明不同中麻黄居群间存在一定基因流,但水平不高。
|
|
表 3 11个不同居群中麻黄遗传信息参数 Table 3 Parameters of genetic information on 11 populations of E. intermedia |
通过Popgen软件分析得到中麻黄各居群的Ht为0.211 9,Hs为0.157 0,根据Ht和Hs来计算Gst为0.259 3。这表明有25.93%的变异存在于居群间,而74.07%的变异存在于居群内。居群的遗传分化表明,中麻黄居群间的分化程度较小,但居群内部却具有高度的遗传分化。
3.4 中麻黄居群间遗传距离与聚类分析Popgen软件统计结果表明,11个不同居群中麻黄之间遗传距离的变异范围是0.014 4~0.159 8(表 4),其中mq与glhzt-z之间的遗传距离最大,为0.159 8,这也表明两者之间的亲缘关系最远。tglsm和古glyht之间的遗传距离最近,为0.014 4,说明二者之间亲缘关系最近。
|
|
表 4 中麻黄居群遗传距离和遗传一致度 Table 4 Genetic distance and genetic identity of E. intermedia populations |
为了进一步表明各居群间的亲缘关系,利用NTSYS软件构建各居群Nei’s遗传距离UPGMA聚类图,通过聚类图可直接反映甘肃11个中麻黄居群间的亲缘关系。结果表明,在遗传距离0.12处glhzt-z和glhzt-y,其他各居群归为另一类;在遗传距离0.055处,民勤沙生植物园栽培居群被单独聚为一类,其余各居群归为一类;在遗传距离0.045处,rss、xls和jp的居群聚为一类,其他各居群归为另一类;在遗传距离0.038处,zy和ym为一类,tglsm、glhhx和glhht聚为一类,亲缘关系与地理分布具有一定的相关性(图 2)。
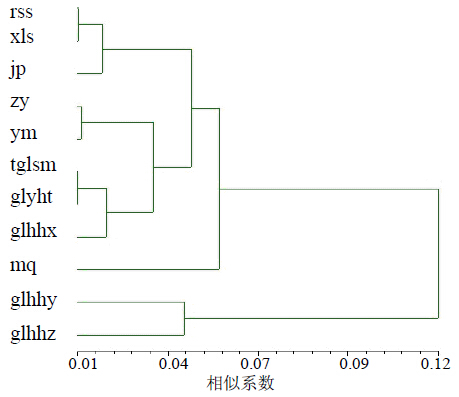 | 图 2 11个居群中麻黄的UPGMA聚类树 Fig. 2 UPGMAdendrogram for 11 populations of E. intermedia |
遗传多样性一般指种内的遗传差异水平,它可以反映了一个物种适应环境的能力以及可被改造和利用的潜力[12],如果一个物种的遗传多样性水平降低,就会导致其适应能力变差,有害隐形基因表达增加,最终会导致该物种的退化,这对于稀有和濒危物种的生物多样性保护是十分不利的。本课题利用12条ISSR随机引物对甘肃11个不同居群的163个样本扩增后,多态位点率为85.71%,比裸子植物的平均多态位点比率70.9%[13]高,说明中麻黄在物种水平上具有较高的遗传多样性。Popgen32软件统计结果表明居群内的H、I均比居群间的低,说明中麻黄的遗传多样性主要来自于居群间,因此在采取保护措施时应尽量保护数量多的居群。此外,由于不同中麻黄居群间基因流水平不高,导致居群内遗传多样性低,为了防止居群内中麻黄种质退化,应加强不同地区间中麻黄的基因交流。
根据基因分化系数估算的11个居群间的遗传分化系数为0.259 3,说明居群间的基因变异只占总的基因多样性的25.93%,居群内占74.07%。这表明大量的遗传分化主要存在于中麻黄居群内,少量的遗传分化存在于居群之间,这与其在不同地区间基因流有关,可以防止中麻黄居群内的近交衰退。此外,由于中麻黄主要分布在干旱的荒漠、戈壁地区,各居群生境类型简单,使其受生态环境影响差异不大,以至居群间的遗传分化程度较小。
许多研究表明,亲缘关系远近与地理分布呈一定相关性[14,15]。从聚类结果来看,地理距离较近的古浪县洋湖塘镇居群和古浪黄花乡居群、古浪县海子滩镇野生居群和栽培居群、兰州仁寿山和兴隆山居群均被聚为一类,充分表明了具有相同遗传背景的中麻黄居群其地理距离越近,亲缘关系也越近,所以相距较远的地区中麻黄间的基因交流有阻碍性。但在聚为一支的酒泉市文殊镇居群和兰州兴隆山、仁寿山居群中,前者却与后者的地理距离较远,说明地理差异并不是决定亲缘关系远近的惟一因素,其还受到繁育系统、生境条件和基因流多方面的影响,中麻黄遗传多样性是由其基因多样性和环境因素共同决定的。
| [1] | 中科院中国植物志编委会. 中国植物志 [M]. 北京: 科学出版社, 1978. |
| [2] | 中国药典 [S]. 一部. 2010. |
| [3] | 魏建和, 李先恩, 高海泉, 等. 甘肃省甘草麻黄资源状况调查 [J]. 中药信息与研究, 2011, 36(9): 1129-1132. |
| [4] | 高燕会, 李慧慧, 朱玉球, 等. 基于ISSR的栝楼遗传多样性分析 [J]. 中草药, 2011, 42(2): 363-366. |
| [5] | 张忠廉, 李学兰, 杨春勇, 等. 砂仁遗传多样性的ISSR分析 [J]. 中草药, 2011, 42(3): 570-574. |
| [6] | 李隆云, 陈大霞, 钟国跃, 等. 不同产地仙茅遗传多样性的ISSR分析 [J]. 中草药, 2012, 43(5): 967-971. |
| [7] | 张忠廉, 李学兰, 张丽霞, 等. 叶下珠种质资源遗传多样性的ISSR分析 [J]. 中草药, 2012, 43(1): 159-162. |
| [8] | 周延清, 分子标记技术在植物研究中的应用 [M]. 北京: 化学工业出版社, 2005. |
| [9] | 朱田田, 晋 玲, 杜 弢, 等. 中麻黄基因组DNA不同提取方法的比较 [J]. 中国实验方剂学杂志, 2012, 40(4): 316-318. |
| [10] | 朱田田, 晋 玲, 杜 弢, 等. 中麻黄ISSR-PCR反应体系的建立和优化 [J]. 中国药房, 2013, 43(24): 4033-4037. |
| [11] | 张春平, 何 平, 何俊星, 等. ISSR分子标记对金荞麦8个野生居群的遗传多样性分析 [J]. 中国中药杂志, 2010, 41(11): 1881-1885. |
| [12] | 王建波. 分子标记及其在植物遗传学研究中的应用 [J]. 遗传, 2002, 24(5): 613-616. |
| [13] | 魏 利. 利用ISSR分子标记对西伯利亚红松 (Pinus sibirica Du Tour) 遗传多样性研究 [D]. 哈尔滨: 东北林业大学, 2004. |
| [14] | 任盘宇, 潘明清. 云南南部5种魔芋属植物居群遗传结构的ISSR分析 [J]. 武汉大学学报, 2013, 59(1): 99-104. |
| [15] | 张春平, 何 平, 胡世俊, 等. 黄连遗传多样性的ISSR分析 [J]. 中草药, 2009, 40(10): 1630-1634. |
 2014, Vol. 45
2014, Vol. 45



