2. 宁夏医科大学药学院 药理系, 宁夏 银川 750000;
3. 兰州大学第一医院, 甘肃 兰州 730000
2. Department of Pharmacology, College of Pharmacy, Ningxia Medical University, Yinchuan 750000, China;
3. Affiliated First Hospital, Lanzhou University, Lanzhou 730000, China
人体内主要药物代谢酶是细胞色素P450(CYP)超家族[1],其中CYP1A1、CYP3A4是体内重要的药物代谢酶[2],CYP1A1作为药物评价致癌性的重要指标[1],CYP3A4是预测药物敏感性的模型[3]。由于CYP3A4酶是人体内一类非常重要的CYP代谢酶,临床60%的药物都要经其代谢转化[3],而且许多药物也是其诱导剂或抑制剂。
阿魏酸(ferulic acid)和异阿魏酸(isoferulic acid),两者结构相似,为一对同分异构体[4],是一种植物来源的酚酸[5],是阿魏、当归、升麻和川芎等中药的主要成分之一[6,7],是以桂皮酸为母核的酚酸类成分的代表[8]。阿魏酸具有广泛的药理学作用,如抗肿瘤、抗氧化、解毒、保肝等作用,是一种多靶点的抗肿瘤天然药物,且性质稳定、毒性低[9]。阿魏酸和异阿魏酸细胞给药后对CYP的影响目前尚未见文献报道,HepG2细胞具有典型肝癌细胞的一系列恶性特征[10,11],保留了一系列生物转化过程中的I相和II相酶,是研究和评价防治肝癌药物的较理想模型,本实验采用肝癌细胞HepG2给药模型,观察给药后HepG2细胞的生长以及细胞中CYPlA1、CYP3A4的活性变化,考察阿魏酸和异阿魏酸对CYP同工酶CYP1A1和CYP3A4的影响。
1 材料和方法 1.1 主要药品与试剂阿魏酸(110773-201012)和异阿魏酸(111698- 201103)均购自中国食品药品检定研究院,质量分数≥98%,用二甲基亚砜(DMSO)助溶。新生牛血清购自PAA公司;噻唑蓝(MTT,美国Sigma公司)。反转录qPCR RT Master Mix购自Toyobo公司;TaKaRa RNAiso Plus购自宝生物工程(大连)有限公司;实验所用引物用Primer Premier 5.0软件设计,委托上海生工生物工程有限公司合成,CYP3A4抗体购自Santa Cruz 公司。
1.2 仪器超净台、细胞培养箱、梯度PCR测定仪(购自PCR公司),ABI7500实时荧光PCR、高速低温离心机(Sigma公司),超声波裂解仪VCX750(美国SONICS公司)。
1.3 细胞细胞株人肝癌细胞HepG2为本实验室保存。将HepG2细胞加入至含10%新生牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养基中,置于37 ℃、5% CO2的饱和湿度培养箱中孵育传代培养。
1.4 MTT方法检测细胞增殖抑制率取对数生长期HepG2细胞接种于96孔板中,1×104个/孔,16 h后加入含不同质量浓度阿魏酸和异阿魏酸的培养基,药物终质量浓度为6.25、12.5、25、50、100、150、200 μg/mL,各质量浓度设3个复孔,设正常生长细胞为对照组。各组细胞置37 ℃、5% CO2的饱和湿度培养箱内培养48 h后,每孔加入20 μL的MTT(5 mg/mL),继续培养4 h后弃培养基,每孔加入DMSO 150 μL震荡溶解10 min。在酶联免疫检测分析仪上于波长490 nm处测定吸光度(A)值,计算细胞增殖抑制率,以3次平行实验数据为最终结果。
增殖抑制率=1-A实验 / A对照
1.5 细胞周期测定取对数生长期细胞接种于1次性细胞培养瓶,1×106个/瓶,培养16 h后,加入终质量浓度为50 μg/mL的阿魏酸和异阿魏酸的培养基,继续培养48 h后,参照文献方法[12]进行操作,用流式细胞仪分析细胞周期分布。
1.6 对HepG2细胞中CYP1A1和CYP3A4 mRNA表达的影响 1.6.1 分组实验组:阿魏酸和异阿魏酸质量浓度分别为25、50、100 μg/mL;对照组:正常细胞生长组;阳性对照组:酮康唑[13]质量浓度分别为25、50、100 µg/mL。
1.6.2 RNA的提取和cDNA的合成细胞接种于1次性细胞培养瓶,16 h后弃培养基,用PBS清洗2遍,加入含不同质量浓度阿魏酸和异阿魏酸的培养基,作用48 h。用RNAiso Plus试剂盒提取RNA,RNA溶解于15 μL RNse-free H2O中,5 μL用于测定RNA的纯度,8 μL用于反转录。用紫外分光光度计测A260、A280,2.1≥A260/A280≥1.8 合格,计算总RNA纯度及浓度。反转录体系为5×RT Master Mix 2 μL,酶混合物0.5 μL,引物混合物0.5 μL,RNA 1 μL,无RNA酶水6 μL,反转录总体积10 μL。反转录的条件为37 ℃、15 min,98 ℃、5 min,反转录产物−20 ℃保存。
1.6.3 实时荧光PCR反应将反转录产物10倍稀释后作为PCR反应模板,PCR的反应体系:1 μL稀释液,上下游引物10 μmol/L(表 1)各1 μL,2×SYBR Green I 12.5 μL,添加高压灭菌的三蒸水至终体积25 μL,混匀。反应条件:起始95 ℃、5 min,扩增时95 ℃、15 s,60 ℃、15 s,72 ℃、45 s循环40次,溶解曲线分析。以GAPDH为内参,进行PCR扩增产物的实时定量分析。
|
|
表 1 PCR反应引物及序列 Table 1 Primer and sequence used in real-time PCR reaction |
实时定量PCR数据采用比较阈值法进行相对定量分析。计算方法:目的基因诱导或抑制倍数=2-∆∆Ct,Ct值是热循环仪中荧光达到阈值循环数,∆∆Ct=实验组∆Ct(目的基因Ct-内参基因Ct)-对照组∆Ct(目的基因Ct-内参基因Ct)。
1.7 Western blotting分析将对照组和3个不同质量浓度(25、50、100 μg/mL)阿魏酸和异阿魏酸处理48 h后的细胞分别提取蛋白,然后以GAPDH为内参,按照文献方法[14]检测CYP3A4蛋白的表达差异。
1.8 统计学分析
所有数据用SPSS 17.0统计学软件进行统计学分析,数据均用 ±s表示,采用单因素方差分析。
±s表示,采用单因素方差分析。
MTT实验结果表明,随着阿魏酸和异阿魏酸质量浓度的增加,对HepG2细胞的增殖抑制率升高,呈剂量依赖关系。质量浓度在50 µg/mL时,2种药物的抑制率相同。质量浓度低于50 µg/mL时,异阿魏酸对HepG2细胞的抑制能力比阿魏酸强,但质量浓度高于50 µg/mL时,则呈相反趋势。阿魏酸和异阿魏酸的IC50值分别为66.64、83.69 μg/mL。见图 1。
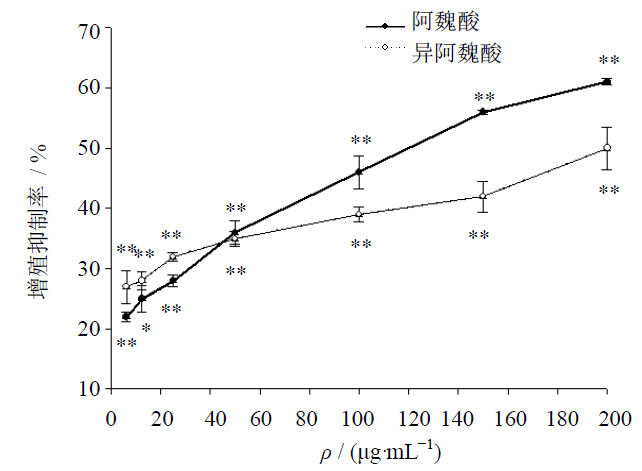 | 与对照组比较:*P<0.05 **P<0.01,下同 *P < 0.05 **P < 0.01 vs control group,same as below图 1 阿魏酸和异阿魏酸对HepG2细胞增殖的影响(  ±s,n=3)
Fig. 1 Effectsof ferulic acid and isoferulic acid on proliferation of HepG2 cells ( ±s,n=3)
Fig. 1 Effectsof ferulic acid and isoferulic acid on proliferation of HepG2 cells ( ±s,n=3) ±s,n=3) |
流式细胞仪测定结果表明,与对照组比较,阿魏酸和异阿魏酸均使HepG2细胞周期G2/M期发生了明显阻滞,见表 2。阿魏酸和异阿魏酸使G0/G1期和S期细胞数比例略微升高,而使G2/M期比例显著降低。特别是阿魏酸阻滞G2/M期,细胞数比例相比于对照组降低了13.53%。
|
|
表 2 阿魏酸和异阿魏酸对HepG2细胞周期的影响( ±s,n=3)
Table 2 Effects of ferulic acid and isoferulic acid on cell cycle of HepG2 cells ( ±s,n=3)
Table 2 Effects of ferulic acid and isoferulic acid on cell cycle of HepG2 cells ( ±s,n=3) ±s,n=3)
|
PCR实验结果显示,相比于对照组,阿魏酸和异阿魏酸(100、50、25 μg/mL)均明显抑制HepG2细胞中CYP1A1和CYP3A4 的mRNA表达,异阿魏酸比阿魏酸抑制作用更强。尤其是在低质量浓度25 µg/mL时,相比于阿魏酸,异阿魏酸对CYP1A1和CYP3A4 mRNA的抑制能力均超过3倍。阳性对照酮康唑(25、50、100 µg/mL)对CYP1A1和CYP3A4 mRNA均表现出普遍而强烈的抑制作用,见表 3。
|
|
表 3 阿魏酸和异阿魏酸对HepG2细胞中CYP1A1和CYP3A4 mRNA表达的影响 ( ±s,n=3)
Table 3 Effects of ferulic acid and isoferulic acid on CYP1A1 and CYP3A4 mRNA expression in HepG2 cells ( ±s,n=3)
Table 3 Effects of ferulic acid and isoferulic acid on CYP1A1 and CYP3A4 mRNA expression in HepG2 cells ( ±s,n=3) ±s,n=3)
|
Western blotting检测50 μg/mL的阿魏酸和异阿魏酸处理48 h后HepG2细胞内CYP3A4蛋白表达水平的变化。阿魏酸和异阿魏酸的CYP3A4蛋白表达量分别为对照组CYP3A4蛋白表达量的0.57、0.39。结果显示CYP3A4蛋白表达均明显低于对照组(P<0.05)。见图 2。
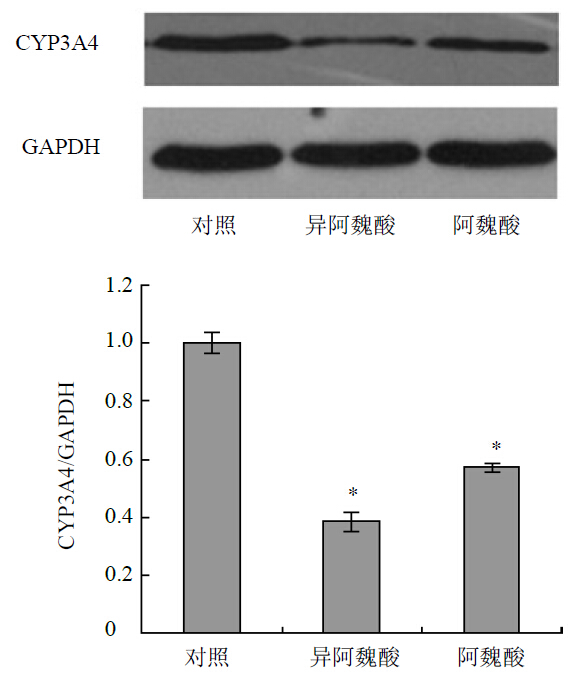 | 图 2 阿魏酸和异阿魏酸对HepG2细胞内CYP3A4蛋白表达的影响( ±s,n=3)
Fig. 2 Effectof ferulic acid and isoferulic acid on CYP3A4 protein expression in HepG2 cells ( ±s,n=3)
Fig. 2 Effectof ferulic acid and isoferulic acid on CYP3A4 protein expression in HepG2 cells ( ±s,n=3) ±s,n=3) |
MTT实验结果表明6.25~200 μg/mL阿魏酸和异阿魏酸均可抑制肝癌细胞HepG2生长。细胞周期在肿瘤的生长调控中具有重要的作用,通过改变细胞周期来阻止肿瘤细胞的无限增殖越来越受到人们的关注[15]。细胞周期的调节主要发生在2个重要阶段:G1/S期和G2/M期,阿魏酸和异阿魏酸处理HepG2细胞,使G2/M期细胞显著降低,2种药物通过影响细胞周期而抑制细胞生长。
随着各类新药的广泛应用以及联合用药的增多,药源性肝损伤的发生率逐年增高,药源性肝损伤的发生与肝组织内CYP450的高表达密不可分,部分药物经CYP450代谢产生反应性代谢产物,后者可与肝细胞内大分子物质共价结合造成肝损伤。近年来研究表明,阿魏酸可通过抑制肝组织细胞脂质过氧化反应,对药源性肝损伤有保护作用,如可以通过抑制CYP2E1活性进而抑制异烟肼和利福平联合用药所导致的肝损伤[16]。本实验对比研究了阿魏酸和异阿魏酸对2种主要CYP亚型的抑制效果,阿魏酸对CYP1A1活性有轻微的抑制作用,对CYP3A4活性有明显的抑制,异阿魏酸对CYP1A1和CYP3A4的活性表现出明显的抑制。研究结果显示,阿魏酸和异阿魏酸处理组明显降低了CYP1A1和CYP3A4 mRNA表达以及CYP3A4蛋白水平,提示抑制CYP1A1和CYP3A4过度表达是阿魏酸和异阿魏酸保护肝损伤的机制之一,通过调节CYP450的功能来调节肝损伤的氧化代谢,减少自由基的生成,减弱氧化应激损伤,从而起到一定的保肝作用。
鉴于阿魏酸和异阿魏酸是同分异构体,可以从结构上推测导致两者对CYP450酶抑制作用差异较大的原因。阿魏酸和异阿魏酸的药理活性基团,比如双键和羧基的位置都一致,两者的区别仅在于酚羟基和甲氧基异构,阿魏酸苯环上C-3位是甲氧基、C-4位是羟基,而异阿魏酸苯环C-3位是羟基、C-4位是甲氧基,结合实验结果,在代谢过程中可以推测苯环C-3位和C-4位的羟基和甲氧基的氧化位置可能是影响对CYP抑制效果的主要因素。
综上所述,本实验研究了阿魏酸和异阿魏酸这一对同分异构体对HepG2细胞周期和2种CYP450酶的作用,证明阿魏酸和异阿魏酸对CYP450酶系的抑制作用,实验结果为中西药代谢相关性提供了体外实验的数据支持。由Lynch等[17]得出的结论可知,药物对酶的抑制可增加药物的浓度,延长药物作用时间,引起药物毒性反应的增加,因而此2种药物对代谢酶的研究有助于预知它们治疗肿瘤时发生的不良反应。2种药物在人体内是否也存在CYP450酶的诱导或者抑制作用,有待于进一步的实验研究。在分子生物学技术推动下,药物代谢领域的研究对临床个体化给药以及药物的相互作用有极其重要价值。
| [1] | 李晓宇, 刘皋林. CYP450酶特性及其应用研究进展 [J]. 中国临床药理学与治疗学, 2008, 13(8): 942-946. |
| [2] | Shaik A P , Jamil K , Das P. CYP1A1 polymorphisms and risk of prostate cancer: a meta-analysis [J]. Urol J, 2009, 6(2): 78-86. |
| [3] | Seripa D, Pilotto A, Panza F, et al. Pharmacogenetics of cytochrome P450 (CYP) in the elderly [J]. Ageing Res Rev, 2010, 9(4): 457-474. |
| [4] | 李利军, 冯 军, 陈其锋, 等. 毛细管电泳同时分离测定阿魏酸、异阿魏酸的研究 [J]. 分析试验室, 2008, 27(9): 46-49. |
| [5] | Sung J H, Gim S A, Koh P O. Ferulic acid attenuates the cerebral ischemic injury-induced decrease in peroxire- doxin-2 and thioredoxin expression [J]. Neurosci Lett, 2014, 26(2):62-67. |
| [6] | 胡益勇, 徐晓玉. 阿魏酸的化学和药理研究进展 [J]. 中成药, 2006, 28(2): 253-255. |
| [7] | 刘 毅, 刘素香, 张铁军, 等. HPLC法测定川芎中阿魏酸和藁本内酯 [J]. 药物评价研究, 2010, 33(3): 210-212. |
| [8] | 莫李立, 王素军, 杨本坤, 等. 阿魏酸在Caco-2细胞模型的通透性及其在大鼠体内吸收特性研究 [J]. 中草药, 2012, 43(5): 947-951. |
| [9] | 殷华芳, 钱晓萍, 刘宝瑞, 等. 阿魏酸抗肿瘤作用机制研究进展 [J]. 现代中西医结合杂志, 2010, 19(32): 4238-4240. |
| [10] | Westerink W M, Schoonen W G. Cytochrome P450 enzyme levels in HepG2 cells and cryopreserved primary human hepatocytes and their induction in HepG2 cells [J]. Toxicol in Vitro, 2007, 21: 1581-1591. |
| [11] | Tolosa L, Gomez-Lechon M J, Perez-Cataldo G, et al, HepG2 cells simultaneously expressing five P450 enzymes for the screening of hepatotoxicity: identification of bioactivable drugs and the potential mechanism of toxicity involved [J]. Arch Toxicol, 2013, 87: 1115-1127. |
| [12] | 江金环, 刘 莉, 皮 江, 等. 姜黄素通过调控微管系统干扰HepG2细胞周期研究 [J]. 中草药, 2013, 44(9): 1144-1148. |
| [13] | 杨贵忠, 袁 野, 周岐新, 等. 酮康唑对健康成人肝细胞微粒体细胞色素P450同工酶3A4、1A2活性的作用 [J]. 南方医科大学学报, 2008, 28(9): 1634-1635. |
| [14] | Arakia N, Tsuruokaa S, Hasegawaa G, et al. Inhibition of CYP3A4 by 6′, 7′-dihydroxybergamottin in human CYP3A4 over-expressed hepG2 cells [J]. J Pharm Pharmacol, 2012, 64(12): 1715-1721. |
| [15] | Dorey K, Barila D, Cavin A C, et al. Regulation of human C-A bltyrosine kinase activity in Xenopus oocytes and acceleration of progesterone-induced G2/M transition by oncogenic forms [J]. Biol Chem, 1999, 380(2): 223-230. |
| [16] | 张志华, 吴红海, 薛 改, 等. 柑桔素抑制CYP450 3A4活性并减轻异烟肼和利福平合用的肝细胞毒性 [J]. 中国药理学通报, 2009, 25(12): 1619-1622. |
| [17] | Lynch T, Price A. The effect of cytochrome P450 metabolism on drug response, interactions, and adverse effects [J]. Am Fam Physician, 2007, 76(3): 391-396. |
 2014, Vol. 45
2014, Vol. 45


