2. 中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室, 国家口蹄疫参考实验室, 甘肃 兰州 730046
2. State Key Laboratory of Veterinary Etiological Biology, National Foot and Mouth Disease Reference Laboratory, Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, China
水仙Narcissus tazetta var. chinensis Roem系石蒜科(Amaryllidaceae)水仙属Narcissus L. 植物,其花姿、花色丰富,部分种类具有宜人的香味,是世界各国广泛种植的著名观赏兼药用植物[1, 2]。目前,关于水仙的研究主要集中在生理[3]、组织培养[4]和活性物质提取[5, 6, 7, 8, 9]等方面。例如水仙花挥发油主要成分丁香油酚对金黄色葡萄球菌、肺炎链球菌及致病性真菌有抑制作用,而且水仙总碱与加兰他敏在治疗阿尔茨海默病方面有一定作用[7, 8]。
植物内生真菌(Endophytic fungi)是在其生活史的整个或某一阶段存在于健康植物组织内部的一类真菌,它们不会引起宿主植物明显病变,但往往能产生和宿主植物相同、类似或结构新颖的次级代谢产物,是发掘新药的宝贵资源库[10]。因此,对植物内生真菌的研究自20世纪90年代以来已逐渐成为微生物学家们关注的热点[11, 12, 13, 14, 15, 16]。
鉴于上述特点,本实验对水仙内生真菌进行分离,一方面用于研究水仙内生真菌的多样性,另一方面旨在筛选出能产生抑菌活性成分和抗肿瘤成分的内生真菌,为开发临床新药奠定基础。
1 材料与仪器 1.1 材料实验所用水仙Narcissus tazetta var. chinensis Roem. 于2009年12月购于兰州广武花卉市场,在实验室培养15 d后,待叶长生长至5 cm,作为实验材料,由兰州理工大学杨林副教授鉴定。
1.2 主要试剂和仪器真菌基因组DNA提取试剂盒(Solarbio),rTaq DNA聚合酶(TaKaRa),DL2000 DNA Marker(TaKaRa),dNTP(TaKaRa),琼脂糖(solarbio);PCR产物纯化试剂盒(上海生工生物工程有限公司)。电泳仪(北京六一仪器厂),凝胶成像分析仪(美国Bio-Rad),PCR扩增仪(杭州朗基)。引物ITS1:TCCGTAGGTGAACCTGCGG,ITS4:TCCTCCGCTTATTGATATGC(上海生工生物工程有限公司合成)。
2 方法 2.1 水仙内生真菌的分离与纯化将新鲜健康的水仙根、鳞茎和叶分别用流水冲洗,风干表面水分,剪切成0.5 cm×0.5 cm大小的片段,无菌水漂洗2次,75%乙醇浸泡2 min,0.01%升汞浸泡4 s,无菌水冲洗3次,平放在含有100 U/mL青霉素钠和100 U/mL硫酸链霉素的PDA平板上,置28 ℃培养3~8 d。取最后一次漂洗液涂布在含有100 U/mL青霉素钠和硫酸链霉素的PDA平板上,作为阴性对照。
采用菌丝尖端挑取法,根据菌落形态、颜色、生长时间的不同,及时挑取组织块下或周缘生长的菌丝转接于PDA培养基上,划线稀释分离,直至获得纯培养,编号并保存菌种。
2.2 内生真菌的鉴定 2.2.1 形态学鉴定参照《真菌鉴定手册》[16],取纯化后的内生菌株,点植法接种于PDA平板上,28 ℃恒温培养5~8 d,期间观察其生长特征、菌落形态等;并采用插片法观察菌丝的显微结构,包括分生孢子梗、分生孢子形态等表型特征对分离菌株进行初步鉴定[17]。
2.2.2 分子鉴定采用真菌基因组DNA提取试剂盒法分别提取分离菌株的基因组DNA,以真菌通用引物ITS1、ITS4对核糖体转录间隔区ITS进行PCR扩增。琼脂糖凝胶电泳检测PCR扩增产物,PCR产物纯化后送上海生工生物工程有限公司测序。获得的序列进行BLAST比对,结合形态学特征,确定分离菌株的分类地位。
2.2.3PCR反应体系的建立 DNA模板1.0 μL,10×PCR 缓冲液(含Mg2+)5.0 μL,dNTP(2.5 mmol/L)4.0 μL,引物(10 μg/mL)各1.5 μL,Taq DNA聚合酶(2 U/μL)1 μL,加水补足50 μL。扩增条件:95 ℃、3 min;95 ℃、40 s,55 ℃、45 s,72 ℃、1 min,30个循环;72 ℃延伸10 min。
2.2.4 DNA序列分析及系统发育树构建登陆NCBI(http://www.ncbi.nlm.nih.gov/)利用BLAST将测序获得的各菌株ITS序列与GenBank中的已知序列进行比对,查找相似性最高的菌种,并用MEGA5.0软件按照邻接法(Neighbour-Joining,N-J),自展数(Bootstrap)为1 000,构建系统进化树。
2.2.5 种群多样性分析定义ITS-rDNA序列同源性大于97%,同属菌株作为同一分类单元[18],采用Shannon-Wiener指数(H)、均匀度指数(E),计算多样性[19]。
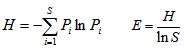
式中S为分类单元,Pi是第i种的多度比例(Pi=ni/N,ni是第i个分类单元的菌株数,N=∑ni,N是所有菌株数总和)
H来源于信息理论,其计算公式表明,群落中生物种类增多代表了群落的复杂程度增高,即H值愈大,群落所含的信息量愈大。
3 结果与分析 3.1 水仙内生真菌的分离采用组织切块法,从水仙植物的不同组织中共分离到18株内生真菌(表 1),其中16株分离于植物的根部,2株分离于鳞茎,分别为分离菌株数量的88.89%和11.11%;而叶中没有获得内生真菌,阴性对照平板上亦没有菌落产生,进一步说明分离方法的准确性。由此可见,在本实验条件下水仙中存在着一定的内生真菌资源,存在一定的组织偏好性,以其根部居多,主要是由于根部处在地表以下,接触土壤面积较大,土壤中丰富的微生物在长期的侵染过程中与之形成共生关系[14, 15]。此外,本实验中所用到的分离培养基及培养条件亦会影响微生物的分离,例如不同微生物的最适碳源、生长温度等都会有差异,对氧份的需求亦有所不同,因此在不同分离条件下获得的菌株会有所差异。
|
|
表 1 水仙中部分内生真菌的菌落形态 Table 1 Colony appearance of entophytic fungi from N. tazetta var. chinensis |
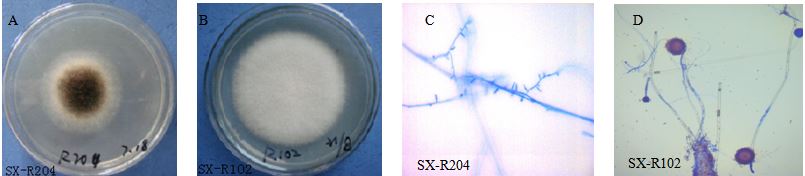
通过形态学方法对18株分离菌株从菌落表面性状、菌丝状态、菌落边缘以及培养基基质颜色等方面进行鉴定,结果见表 1。从表中可以看出各菌株在生长状态和形态学方面都有差异,具有丰富的菌落形态,有毡状、绒毛状、絮状等,各菌落色泽及产色素情况也不尽相同,既有不产色素的,也有黄色、灰褐色、墨绿色等,既有边缘光滑的,又有呈放射状的;部分菌落形态见图 1。尽管差异性比较显著,但是形态学的鉴定尚不能确定其归属。
|
图 1 水仙内生真菌部分菌落形态 (A、B) 及显微形态 (C、D棉兰染色) Fig. 1 Phenotypes (Aand B)and micrograms (C and Dwith Medan staining) of endophytic fungi from N. tazetta var. chinensis |
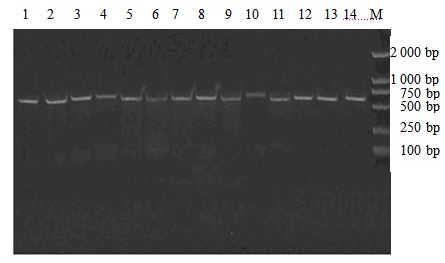
根据菌株间形态学上的差异,分别挑选内生真菌SX-R101、SX-R103、SX-R104、SX-R105、SX-R201、SX-R202、SX-R203、SX-R204、SX-R205、SX-R206、SX-R207、SX-R208、SX-S101和SX-S102共14株内生菌,提取基因组DNA,以其为模板,用引物ITS1和ITS4,PCR扩增核糖体转录间隔区ITS-rDNA,通过1.0%琼脂糖凝胶电泳,发现扩增出约500 bp大小的DNA条带(图 2),大多数条带清晰,专一性良好。用PCR产物纯化试剂盒纯化14株内生菌的PCR扩增产物测序(上海生工生物工程有限公司);测序结果通过NCBI/BLAST分析整理,提交到NCBI/Nucleotide数据库中,获得的登录号见表 2。
|
图 2 用ITS1和ITS4引物扩增的14株内生真菌ITS-rDNA的PCR扩增结果 Fig. 2 PCR amplification results of ITS-rDNA of 14 endophytic fungi using ITS1 and ITS4 primers M-Marker 1-4-SX-R101—105 5-12-SX-R201—208 13,14-SX-S101—102 |
|
|
表 2 水仙中部分内生真菌ITS-rDNA扩增产物序列与SX-R101的相似性 Table 2 Similarity of ITS-rDNA amplification sequence endophytic fungi in N. tazetta var. chinensis and SX-R101 |
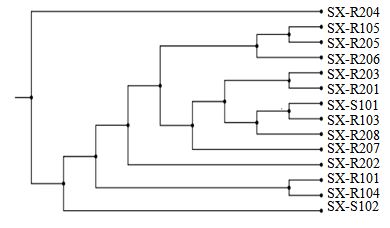
利用NCBI中的BLAST软件对测序结果进行同源性比对,见表 2。4株为青霉属Penicillium Lk. ex Fries,相似性在95%~99%;3株为曲霉属Aspergillus Mich. ex Link: Fr.,相似性99%~100%;3株为喙枝孢属Rhinocladiella Heinsen,相似性为99%;其他4株分别为木霉属Trichoderma Pers ex Fr.、链格孢属Alternaria Nees、赤霉属Gibberella Sacc. 和镰孢霉属Fusarium Lk. ex Fr.,相似性均为99%。对14株内生真菌的ITS-rDNA序列,利用MEGA5.0构建出系统发育树(图 3)。从图中可知这14株菌株在真菌分类学上隶属于子囊菌纲或半知菌纲。SX-R205和SX-R105聚在一起,与喙枝孢属亲缘关系较近;SX-R204、SX-S102、SX-R104、SX-R203、SX-R201、SX-R208和SX-R103聚在一起,与曲霉属及青霉属亲缘关系较近;SX-R206、SX-R207和SX-R202分别与赤霉属、链格孢属、青霉属亲缘关系较近。
|
图 3 14个分离菌株基于ITS-rDNA序列的聚类分析(SX-R101为外类群) Fig. 3 Clusteranalysis based on ITS-rDNA sequences of 14 isolated fungi,outgroup as SX-R101 |
本实验获得7个属的真菌主要是半知菌亚门和子囊菌亚门真菌,其中曲霉属和青霉属为优势菌群,喙枝孢属、木霉属、链格孢属、赤霉属、镰孢(霉)属为常见种;Shannon多样性指数为1.778,均匀度为0.913 7 ;说明水仙内生真菌种群在组成上具有一定的多样性,群落所含的信息量较为一般,主要原因是由于实验中分离的内生真菌主要来源于植物根部,其他组织中分布较少引起的。此外,在本次研究中菌株SX-R104的ITS-rDNA序列与GenBank中已报道序列一致性低于97%,这就显示出水仙内生真菌微生物种群中存在新的物种资源[19]。
4 讨论植物内生真菌广泛存在于植物组织内,并和宿主植物长期共生,与宿主在遗传、生理以及代谢等方面相互渗透、同步进化,形成互利互惠的共生关系,具有一定的生物多样性。因此,分离菌株的数量直接影响其多样性的研究。在本实验中所分离的18株内生真菌,在水仙体内内生真菌的分布部位存在差异性和专一性,部分真菌具有组织偏好性,根部内生真菌的菌株数多。究其原因一方面是由于植物在不同的生境下以及各部位化学组成的差异,会引起内环境的差异,进而间接影响内生真菌菌群的组成。毛益婷等[20]通过研究不同生境下野生铁皮石斛的内生真菌,认为环境湿度大,生长茂盛,处于开花期的植株内生菌相对活跃,多样性指数高;而环境干旱,生长生境较开阔,郁闭度较低,在适应生长环境的过程中部分内生菌也随之消亡,共生真菌多样性指数相对较低。王志伟等[21]在对鹅观草属植物内生真菌的研究中发现阴暗湿润的环境更利于内生真菌和宿主植物的共生,从而增加内生真菌的多样性;而且地区间内生真菌多样性的显著差异,有可能是宿主植物基因型的差异或生长环境的差异引起的。另一方面由于不同内生真菌最适生长培养基种类和培养条件的不同,种间竞争的差异性不同,使得实验室人工培养方法被分离的微生物种类和数量仅占预期数量的1%~5%,而其余95%~99%微生物种群仍然未被分离[22]。徐佳等[17]在28 ℃温度下,通过5种不同分离培养基,共获得19株内生真菌,其中淀粉培养基分离出的菌株种类与数量最多,说明淀粉培养基与其他4种培养基相比,其组成成分更适宜分离菌株的生长。此外,目前对内生真菌的分离主要集中在常温,好氧菌的分离,而对中、高温内生真菌的分离存在遗漏。因此,为了准确反映微生物种群多样性,有必要进一步通过优化分离、培养技术并运用多相分类方法,才能获取环境中可培养真菌的更加全面的信息。
此外,本课题组在后续的研究中发现水仙内生真菌次生代谢产物的醋酸乙酯提取物存在抑制乙酰胆碱酯酶和抗HepG2肿瘤活性,并对大肠杆菌和金黄色葡萄球菌等多种细菌有抑制作用,化合物的分离、纯化以及鉴定工作在进一步的研究中,期望能获得较高活性的化合物单体。
| [1] | 陈段芬, 高 健, 彭镇华. 水仙属植物研究进展[J]. 林业科学, 2008, 44(3): 140-146. |
| [2] | Nina R, Vincent S, Per M, et al. Phylogenetic selection of Narcissus species for drug discovery[J]. Biochem Syst Ecol, 2008, 36(5): 417-422. |
| [3] | Li X F, Shao X H, Deng X J, et al. Necessity of high temperature for the dormancy release of Narcissus tazetta var. Chinensis[J]. J Plant Physiol, 2012, 169(14): 1340-1347. |
| [4] | 解玮佳, 李世峰. 王国金, 等. 滇海水仙花的组织培养和快速繁殖[J]. 植物生理学通讯, 2010, 46(11): 1189-1190. |
| [5] | Jean P d A, Natalia B P, Laura T C, et al. Bioactive alkaloid extracts from Narcissus broussonetii: Mass spectral studies[J]. J Pharm Biomed Anal, doi. org/10. 1016/j. jpba. 2012. 05. 009. |
| [6] | Tomáš Ř, Pavel Ř, Karel S, et al. Glycosides of benzodioxole-indole alkaloids from Narcissus having axial chirality[J]. Phytochemistry, 2010, 71(2): 301-306. |
| [7] | Gotti R, Fiori J, Bartolini M, et al. Analysis of Amaryllidaceae alkaloids from Narcissus by GC-MS and capillary electrophoresis[J]. J Pharm Biomed Anal, 2006, 42(1): 17-24. |
| [8] | Laura T C, Strahil B, Carles C, et al. Daffodils as potential crops of galanthamine. Assessment of more than 100 ornamental varieties for their alkaloid content and acetylcholinesterase inhibitory activity[J]. Ind Crops Prod, 2013, 43: 237-244 (DOI: 10. 1016). |
| [9] | Linda S M O, Li T, Su M X, et al. Isolation, characterization, molecular cloning and modeling of a new lipid transfer protein with antiviral and antiproliferative activities from Narcissus tazetta[J]. Peptides, 2008, 29(12): 2101-2109. |
| [10] | 邹文欣, 谭仁祥. 植物内生菌的研究新进展[J]. 植物学报, 2001, 43(9): 881-892. |
| [11] | Zhou X W, Zhu H F, Liu L, et al. A review: recent advances and future prospects of taxol-producing endophytic fungi[J]. Appl Microbiol Biotechnol, 2010, 86(6): 1707-1717. |
| [12] | Wang Y, Dai C C. Endophytes: a potential resource for biosynthesis, biotransformation, and biodegradation[J]. Ann Microbiol, 2011, 61(2): 207-215. |
| [13] | Qin S, Xing K, Jiang J H, et al. Biodiversity, bioactive natural products and biotechnological potential of plant-associated end o-phytic actinobacteria[J]. Appl Microbiol Biotechnol, 2011, 89(3): 457-473. |
| [14] | 陈向东. 植物内生菌是有待深入开发的资源宝库[J]. 微生物学通报, 2012, 39(2): 282. |
| [15] | 杨明俊, 李 娟, 薛鸿燕, 等. 水仙内生真菌的分离及抑菌和抗肿瘤活性研究[J]. 中草药, 2014, 45(6): 819-824. |
| [16] | 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979. |
| [17] | 徐 佳, 陈 彬, 雷晓凌, 等. 丛生盔形珊瑚共附生可培养真菌多样性分析[J]. 微生物学通报, 2011, 38(8): 1193-1198. |
| [18] | McCaig A E, Glover L A, Prosser J I. Molecular analysis of bacterial community structure and diversity in unim-proved and improved upland grass pastures[J]. Appl Environ Microbio1, 1999, 65(4): 1721-1730. |
| [19] | 吴晓菡, 李文超, 秦路平. 天目山山胡椒不同部位内生真菌组成及多样性分析[J]. 植物资源与环境学报, 2012, 21(2): 107-113. |
| [20] | 毛益婷, 代晓宇, 马 荣. 不同生境下野生铁皮石斛内生真菌多样性的初步研究[J]. 新疆农业大学学报, 2011, 34(3): 234-238. |
| [21] | 王志伟, 纪燕玲, 陈永敢, 等. 禾本科植物内生真菌资源及其物种多样性[J]. 生态学报, 2010, 30(17): 4771-4781. |
| [22] | 马养民, 赵 洁. 植物内生真菌抗菌活性物质的研究进展[J]. 有机化学, 2010, 33(2): 220-232. |
 2014, Vol. 45
2014, Vol. 45



