麻黄Ephedrae Herba为麻黄科植物草麻黄Ephedra sinica Stapf、中麻黄Ephedra intermedia Schrenk et C. A. Mey. 或木贼麻黄Ephedra equisetina Bge. 的干燥草质茎,麻黄具有发汗散寒、宣肺平喘、利水消肿的功效,为临床常用解表药之一[1]。同时,文献统计表明,麻黄及其生物碱类成分在美国曾被广泛用作膳食补充剂,具有减轻体质量、增加能量的作用[2]。但由于麻黄碱(ephedrine,E)、伪麻黄碱(pseudoephedrine,PE)具有明确的中枢兴奋作用[3],因此过量使用麻黄能够引起心悸、失眠、抽搐、精神失常等不良反应[4],这严重制约了麻黄的临床安全用药。
中医药在减轻药物毒性方面具有丰富经验,药对配伍是其重要手段。七情配伍理论将其概括为相畏、相杀。方剂学中,麻黄最常与桂枝Cinnamomi Ramulus配伍,传统中医理论认为桂枝有增强麻黄发汗解表之功效[5],体现了相须为用的配伍原则。二者相须为用的配伍理论也得到了现代药理实验研究的较多证实[6, 7]。但近年来,一些药物动力学研究资料表明桂枝还能降低麻黄中E、PE的血药浓度[8],这提示桂枝与麻黄的配伍关系可能不仅仅局限于相须为用,二者之间还可能存在着相畏、相杀的配伍作用。但由于目前未见二者配伍对麻黄中枢兴奋毒副作用的影响报道,因此麻黄桂枝药对配伍是否体现出不同于相须为用的其他配伍关系,还有待于进一步的研究证实。基于此设想,本实验通过比较桂枝与麻黄配伍前后小鼠脑组织中E、PE的动力学变化,研究桂枝对麻黄中E、PE在脑组织内动态分布的影响,以期从药物动力学的角度认识二者配伍的相畏、相杀作用。
1 材料 1.1 试剂与仪器醋酸乙酯(色谱纯,天津市福晨化学试剂厂),二苯胺(IS)、氢氧化钠、磷酸氢二钠均为分析纯,七氟丁酸酐(百灵威科技有限公司),盐酸麻黄碱(批号171241-201007)、盐酸伪麻黄碱(批号 171237-200807)均购自中国食品药品检定研究院;气相色谱-质谱联用仪(Agilent 7890A—5975C msd),离心机(上海安亭科学仪器厂),涡旋仪(上海沪西分析仪器有限公司),恒温水浴锅(北京国华医疗器械厂)。
1.2 药物麻黄、桂枝均购于成都中药材批发市场,由成都中医药大学中药鉴定室王光志副教授鉴定为麻黄科植物草麻黄Ephedra sinica Stapf的干燥草质茎和樟科植物肉桂Cinnamomum cassia Presl的干燥嫩枝。
1.3 动物健康昆明种小鼠,雌雄各半,体质量(20±2)g,由四川省医学科学院实验动物研究所提供,动物合格证号SCXK(川)2008-24。
2 方法 2.1 色谱/质谱条件色谱柱:Agilent 19091s-433(30 m×250 μm,0.25 μm);进样量1 μL,无分流进样,进样器温度230 ℃;载气为He;体积流量1 mL/min;柱程序升温:初始温度70 ℃,保持1 min,以20 ℃/min的速率升温至160 ℃,保持2 min,再以10 ℃/min的速率升温至200 ℃,保持2 min,最后以30 ℃/min的速率升温至270 ℃,保持5 min;电离方式为EI,电离电压70 eV,倍增电压1 400 V;选择离子监测(SIM),E和PE m/z分别为210.00和254.00,二苯胺m/z为365.00,溶剂延迟4.00 min。
2.2 水煎液的制备 2.2.1 麻黄水煎液精密称取麻黄9 g,加入10倍量的蒸馏水浸泡20 min,武火煮沸,文火煎煮50 min,纱布滤过,再加约7倍量的蒸馏水煎煮25 min,合并2次滤液定容至每毫升药液相当于0.05 g麻黄生药量。其中含E 0.022 mg/mL,PE 0.026 mg/mL。
2.2.2 桂枝麻黄合煎液精密称取麻黄9 g、桂枝6 g,加入10倍量的蒸馏水浸泡20 min,麻黄先煎20 min,再加入桂枝煎煮30 min后,纱布滤过,后同“2.2.1”项下“麻黄水煎液”步骤。合煎液含E 0.011 mg/mL,PE 0.010 mg/mL。
2.3 动物处理小鼠120只,雌雄各半,随机分为20组,每组6只,其中10组分别ig麻黄水煎液,另10组分别ig麻黄桂枝合煎液,各组给药量(E+PE总量)均为0.72 mg/kg,分别于给药后10、20、30、45、60、90、120、240、480、720 min各处死1组小鼠,迅速取出脑组织,洗去表面血液并称质量,锡箔纸包裹后置于-20 ℃超低温冰箱保存。
2.4 脑组织样品预处理按脑质量(g)与蒸馏水体积(mL)1∶2的比例制备匀浆,取匀浆液0.5 mL于5 mL离心管,加入2 mL pH 11.73的NaOH-Na2HPO4缓冲液,25 μL 2 μg/mL的IS溶液,再加2 mL醋酸乙酯(分2次萃取,第1次1.5 mL,第2次1 mL),每次涡旋震荡2 min,3 000 r/min离心10 min,合并2次上清液后取0.5 mL于1.5 mL离心管中,氮气流吹干,加15 μL七氟丁酸酐与25 μL醋酸乙酯于上述离心管中,涡旋混合1 min,70 ℃衍生化30 min,氮气流吹干,加1 mL醋酸乙酯溶解,溶解液过0.22 μm滤膜待测。
2.5 标准曲线的制备方法精密称取盐酸麻黄碱、盐酸伪麻黄碱适量,置100 mL量瓶,加1 mL pH 11.73的NaOH-Na2HPO4缓冲液和醋酸乙酯溶解并稀释至刻度,作为对照品储备液(ρE=52.9 μg/mL,ρPE=59.1 μg/mL)。再将对照品储备液分别稀释成质量浓度为10、100、150、200、300、600 ng/mL的对照品溶液。分别取0.1 mL不同质量浓度的对照品溶液于5 mL离心管中,氮气流吹干后加入脑空白匀浆液各0.5 mL,配成不同质量浓度的标准脑组织样品,余下步骤同“2.4”项方法进行处理。按上述色谱条件测定,分别得到E和PE的标准曲线。
3 结果 3.1 衍生化试剂及特征离子的选择文献报道[9]使用三氟醋酐作为衍生化试剂,本实验采用七氟丁酸酐对E、PE进行衍生化,衍生化后的分离度好、检测灵敏度高;本实验提取m/z 210.00、254.00离子质量色谱峰面积作定量,而文献报道[9]仅选择丰度最大的碎片作特征离子,前期研究表明选取2个碎片较只选择m/z 254.00作特征离子检测灵敏度高,结合文献报道[10]推测,E、PE分子中的氨基衍生化为N,N′-二甲基七氟丁酰胺,在EI电离条件下,E和PE衍生物的裂解规律见图 1。
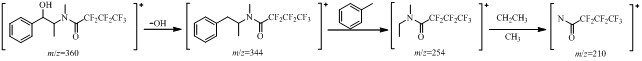
|
图 1 E和PE衍生物的裂解规律 Fig. 1 Cleavage rules of E and PE derivatives |
空白脑组织加混合对照品(E+PE+IS)、给药后脑组织和空白脑组织的色谱图见图 2。结果表明,空白脑组织色谱图中在对照品峰相应的保留时间处未出现色谱峰。
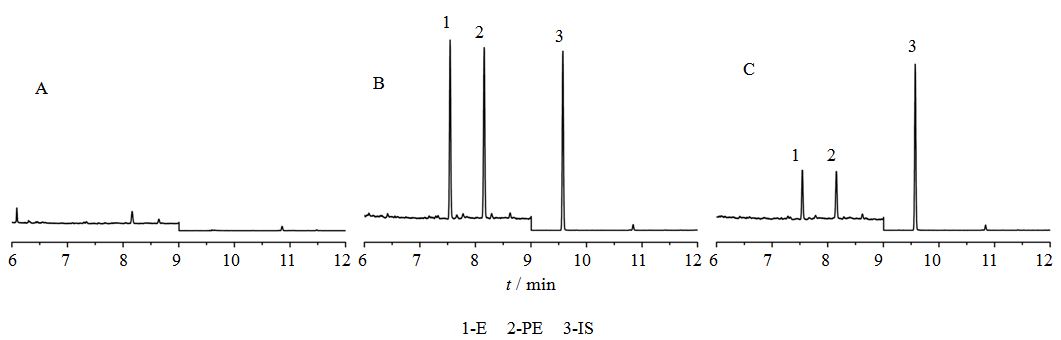
|
图 2 空白脑组织 (A)、空白脑组织+对照品+内标 (B) 和桂枝麻黄合煎液给药后240 min脑组织样品 (C) GC图 Fig. 2 GC of blank brain tissues (A),blank brain tissues + reference substance + internal standard (B),and brain tissues samples after 240 min of adminstration with codecoction of Cinnamomi Ramulus combined with Ephedrae Herba |
按“2.5”项下操作,以对照品与内标峰面积比值(Y)对质量浓度(X)进行线性回归,得E、PE在小鼠空白脑组织匀浆中的标准曲线方程。E:Y=0.045 7 X-0.016 5,r=0.998 6,线性范围为1.66~100 ng/mL;PE:Y=0.049 6 X+0.081 1,r=0.995 3,线性范围为1.66~100 ng/mL。
3.4 精密度试验取给药后不同时间点的组织样品混合制成高、中、低3种质量浓度的质控样品(样品中E质量浓度分别为92.7、52.37、1.731 ng/mL,PE质量浓度分别为99.4、62.84、4.587 ng/mL),每种分别取样5次,连续测样5 d,在同日内用同一条标准曲线处理得日内精密度,在5 d内用每日随行标准曲线处理得日间精密度。实验结果表明E的日内和日间精密度分别为RSD<10.25%和RSD<12.52%;PE的日内和日间精密度分别为RSD<9.93%和RSD<11.29%。说明本方法符合生物样品精密度的要求[11]。
3.5 回收率试验取0.1 mL质量浓度分别为0.05、0.15、0.3 μg/mL的对照品溶液各5份,加入空白脑匀浆液0.5 mL,按“2.4”项下操作,在上述色谱条件下分别测定脑组织中E、PE质量浓度,与真实值比较计算回收率。结果测得E高、中、低3个质量浓度的回收率分别为(71.50±7.33)%、(74.80±6.88)%、(76.90±5.94)%;PE的回收率分别为(72.90±5.98)%、(75.30±6.28)%、(80.20±7.96)%。说明本实验方法回收率均能达到生物样品的测定要求[11]。
3.6 脑组织中E和PE浓度经时变化麻黄组和桂枝麻黄配伍组E和PE在小鼠脑组织的药-时曲线见图 3。
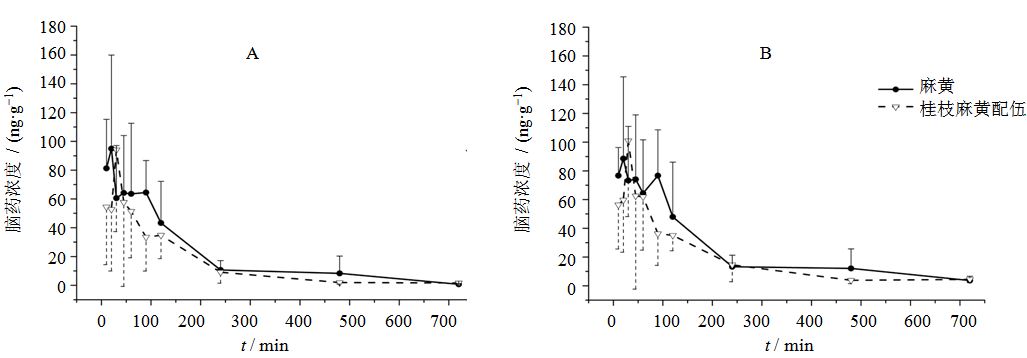
|
图 3 麻黄组和桂枝麻黄配伍组E (A) 和PE (B) 在小鼠脑组织内的药-时曲线 (x±s,n=6) Fig. 3 Mean concentration-timecurvesof E and PE in brain tissues of mice in codecoction of Cinnamomi Ramulus combined with Ephedrae Herba (x±s,n=6) |
将小鼠脑组织中E、PE的浓度数据除以各小鼠给予E或PE的量,求得单位给药剂量下脑组织分布浓度,以避免两物质绝对给药量不能完全同步折算所引起的比较误差。采用Kinetica 5.0.11软件,对以上折算后的单位给药剂量下每克脑组织中E、PE的浓度数据进行统计矩分析,求算药动学参数,并比较相对生物利用度。结果见表 1。
|
|
表 1 单位给药剂量下麻黄组和桂枝麻黄配伍组小鼠脑组织中E、PE分布动力学参数 Table 1 Distribution kinetic parameters of E and PE after administration in groups between Ephedrae Herba extract and codecoction of Cinnamomi Ramulus combined with Ephedrae Herba |
麻黄在临床应用过程中常伴有中枢不良反应,研究证实其主要成分E、PE易透过血脑屏障在脑组织中大量分布[12, 13],通过升高脑内谷氨酸水平,抑制神经细胞增殖,而产生中枢神经系统毒副作用[14, 15]。因此,脑是麻黄的毒性靶器官,E、PE的脑内浓度与麻黄的中枢兴奋副作用密切相关,可作为评价桂枝拮抗麻黄中枢毒副作用的指标,反映药对间相畏、相杀的配伍关系。
药物的体内过程遵循吸收、分布、代谢、排泄的规律,口服的药物先经消化道吸收入血,再经血液分布到各组织器官,因此药物在体内吸收入血的过程会直接影响其在组织中的分布过程。文献报道[16]指出,桂枝的配伍能延长小鼠血液中E、PE的tmax,这与本研究结果中桂枝对脑组织内E、PE的tmax值影响一致,提示桂枝可能通过减慢E、PE吸收入血的过程来延缓其在脑组织内的分布。
此外,本研究中桂枝麻黄配伍组小鼠脑内E、PE药-时曲线下面积(AUC0-∞)低于麻黄组,与文献研究[5]体现的血液中E、PE的AUC值变化趋势一致,推测桂枝降低脑内E、PE的累积分布量与其降低血液中药物总量有关;另一方面,桂枝的配伍能降低麻黄水煎液中E、PE的溶出率[16],使得经消化道吸收入血的药物总量和药物从血液向脑组织分布的量均降低。
同时,桂枝的配伍能缩短E的平均滞留时间(MRT0-∞),而对PE的MRT0-∞值无影响,说明桂枝可以缩短E在小鼠脑组织内的作用时间,使其在脑内的消除加快,提示桂枝有减轻麻黄中枢毒副作用的效果,但这一作用的具体机制尚无文献依据,还有待进一步研究证实。
整体而言,桂枝配伍麻黄后,E、PE的tmax延长,AUC0-∞降低,E的MRT0-∞缩短,提示桂枝能延缓小鼠脑内E、PE的分布,降低其入脑量,加速E、PE的消除过程,从而降低麻黄的中枢毒副作用,反映了桂枝杀麻黄,麻黄畏桂枝的配伍关系。
文献报道[9]小鼠ig麻黄水煎液后脑组织内E、PE的tmax为2.72~2.81 h,而本实验中的tmax为0.33 h,较文献报道时间缩短。其差异可能与给药量大小有关,文献中麻黄给药量约为10 g/kg,大于本实验1 g/kg的给药量。给药量越大,E、PE在消化道存在的时间和浓度均越大,必将延长其经消化道吸收入血和从血液分布到脑组织的时间。
综上所述,本研究采用GC-MS测定麻黄伍用桂枝前后小鼠脑组织内E、PE浓度,并求算其动力学参数,从脑组织分布动力学角度揭示了药对间相畏、相杀的配伍关系及桂枝对麻黄的减毒机制,结合体内外药理研究资料从桂枝降低水煎液中E、PE的煎出量、小鼠的血药浓度及脑内药物浓度3个方面阐释了桂枝与麻黄间相畏、相杀的配伍原则,为麻黄的合理应用提供了参考。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | Shekelle P G, Hardy M L, Morton S C, et al. Ephedra and ephedrine for weight loss and athletic performance[J]. JAMA, 2003, 289(12): 1537-1545. |
| [3] | 蒋袁絮, 闫 琳, 余建强, 等. 麻黄碱、伪麻黄碱及其水杨酸衍生物对小鼠中枢神经系统作用的比较[J]. 中草药, 2004, 35(11): 1274-1277. |
| [4] | Bowyer J F, Hopkins K J, Ferguson S A, et al. L-ephedrine-induced neurodegeneration in the parietal cortex and thalamus of the rat is dependent on hyperthermia and can be altered by the process of in vivo brain microdialysis[J]. Toxicol Lett, 2001, 125(1): 151-166. |
| [5] | 王中琳, 席加秋. 麻黄汤[M]. 北京: 中国医药科技出版社, 2009. |
| [6] | 熊 倩, 张 密, 郑青山. 麻黄汤不同配伍对大鼠发汗作用的定量评价[J]. 中药临床药理学与治疗学, 2011, 27(7): 763-768. |
| [7] | 李春香, 丁 方, 侯小双, 等. 不同配伍、煎煮及服药后时间对麻黄发汗作用的影响比较研究[J]. 中国医药科技, 2013, 3(1): 98-99. |
| [8] | 沈 群. 麻黄汤不同配伍对麻黄碱和伪麻黄碱在小鼠体内药代动力学的影响[D]. 广州: 第一军医大学, 2002. |
| [9] | 魏凤环, 罗佳波, 沈 群, 等. 麻黄汤及单味麻黄中麻黄碱与伪麻黄碱在小鼠组织中的药动学研究[J]. 中草药, 2004, 35(7): 781-784. |
| [10] | Valentine J L, Middleton R. GC-MS Identification of sympathomimetic amine drugs in urine: rapid mathodology applicable for emergency clinical toxicology[J]. J Anal Toxicol, 2000, 24(3): 211-222. |
| [11] | 化学药物非临床药代动力学研究技术指导原则[S]. 2005. |
| [12] | 魏凤环, 罗佳波, 陈育尧. 麻黄中麻黄碱在小鼠组织中的分布研究[J]. 时珍国医国药, 2006, 17(5): 769-770. |
| [13] | 魏凤环, 罗佳波, 陈育尧. 麻黄中伪麻黄碱在小鼠组织中的分布研究[J]. 广东微量元素科学, 2006, 13(5): 14-16. |
| [14] | Bowyer J F, Newport G D, Slikker W, et al. An evaluation of l-ephedrine neurotoxicity with respect to hyperthermia and caudate/putamen microdialysate levels of ephedrine, dopamine, serotonin, and glutamate[J]. Toxicol Sci, 2000, 55(1): 133-142. |
| [15] | Lee M K, Cheng B W H, Che C T, et al. Cytotoxicity assessment of ma-huang (ephedra) under different conditions of preparation[J]. Toxicol Sci, 2000, 56(2): 424-430. |
| [16] | 徐文杰, 陈飞龙, 谢 颖, 等. 不同配伍配比对麻黄-桂枝药对有效成分含量的影响[J]. 中国实验方剂学杂志, 2012, 18(10): 84-88. |
 2014, Vol. 45
2014, Vol. 45


