肾间质纤维化是各种原因所致肾病发展至终末期肾功能衰竭的共同病理特征[1],随着研究的深入,内质网应激(endoplasmic reticulum stress,ERS)与慢性肾病的密切关系逐渐被人们所认识,已被证实其广泛参与到各种原因(缺血、缺氧等)引起的肾脏疾病中[2]。ERS发生在细胞应激早期,是线粒体应激和细胞核应激的共同通路[3]。当肾小管上皮细胞受到炎症的刺激时,内质网便会发挥适宜的保护机制,但过久或过强的ERS则会诱导细胞凋亡,无法保持细胞的稳态,伴有细胞外基质的增多,造成间质纤维化[4, 5]。因此,深入研究肾纤维化ERS诱导细胞凋亡的机制对肾间质纤维化的防治具有重要意义。
水苏碱来源于多种中药[6]。能够减轻过氧化氢所致肾小管上皮细胞损伤[7];显著增加大鼠尿量[8];改善血液流变学、降低血液黏稠度[9]。本研究探讨水苏碱对蛋白激酶R样内质网激酶(PERK)信号通路介导激活转录因子4(ATF4)蛋白表达水平、ATF4激活内质网应激特异转录因子C/EBP同源蛋白(CHOP)表达水平及细胞凋亡通路的影响,以期阐明水苏碱抗肾间质纤维化的作用机制。
1 材料 1.1 实验动物清洁级健康雄性Wistar大鼠,体质量(200±20)g,购自吉林大学实验动物中心,合格证号SCXK-(吉)-2011-0004。
1.2 主要试剂及仪器水苏碱(质量分数为98.7%,购自四川天然活性成分研究所),依那普利(批号120201,上海现代制药股份有限公司)。血肌酐(Scr)、尿素氮(BUN)试剂盒(中生北控生物科技股份有限公司),一抗兔抗鼠PERK、CHOP、ATF4多克隆抗体(北京博奥森生物技术有限公司),山羊抗兔IgG抗体-HRP多聚体(北京中山生物技术有限公司),医学病理图像分析系统Image Pro Plus 6.0分析软件(哈尔滨医科大学提供)。
2 方法 2.1 动物分组、单侧输尿管梗阻大鼠模型制备及给药60只大鼠适应性喂养1周后,随机分为6组:假手术组,模型组,依那普利(0.45 mg/kg)组,水苏碱高、中、低剂量(92.88、46.44、23.22 mg/kg)组,每组10只。采用单侧输尿管结扎法建立肾间质纤维化大鼠模型。大鼠禁食24 h,ip 10%水合氯醛0.3 mL/100 g麻醉,无菌条件下从大鼠左肋脊角下方剪开皮肤及肌层至腹膜后,游离左侧输尿管,在肾盏处和肾下极处分别结扎并从中间剪断输尿管。假手术组分离输尿管(但不结扎和剪断输尿管)后即缝合腹腔。手术前1 d 各给药组开始ig相应剂量药物,假手术组和模型组给予同体积生理盐水。每天给药1次,共14 d。
2.2 Scr和BUN检测于术后第14天采用摘眼球取血法取血,约3 mL,不抗凝,血液收集后经2 500 r/min离心10 min分离出血清,将血清保存于-20 ℃冰箱,利用Glamour 2000型全自动生化分析仪进行肾功能检测。
2.3 肾脏病理学检测肾组织样本经过4%多聚甲醛固定,石蜡包埋,切片,以备HE、Masson染色。每例HE切片在400倍光镜下随机选择10个不含肾小球的视野,进行半定量分析。依据间质纤维化程度、小管萎缩、间质浸润、红细胞管型、蛋白管型、间质水肿、小管扩张、小管细胞空泡变性8项指标观察肾间质病理改变。每个参数分为4个等级:正常为0分,轻度受损为1分,中度受损为2分,重度为3分,每个样本小管间质损伤总评分为0~24分。行Masson染色切片后,每张切片在高倍镜400倍下随机选取20个视野,测定间质纤维化面积占同视野小管间质总面积的百分比。取平均值为每例切片的肾间质相对面积,作为衡量肾小管损伤的指标。应用Image Pro plus-6.0多媒体彩色病理图像分析软件进行半定量分析。
2.4 肾组织PERK、ATF4、CHOP蛋白表达的检测采用免疫组织化学SP法检测蛋白的表达。采用计算机Image.pro多媒体彩色病理图像分析软件进行免疫组织化学半定量分析。光镜下阳性反应部位为棕黄色,细胞核为淡蓝色。方法:每份样本随机选择5个视野,每个视野内选3~5处阳性染色区域,得出阳性染色区域的积分吸光度值,进行组间比较。
2.5 统计学处理数据结果以x±s表示,组间均数比较采用单因素方差分析(One-way ANOVA),组内比较采用t检验,采用SPSS 16.0统计软件进行分析。
3 结果 3.1 肾功能Scr和BUN水平模型组与假手术组比较,BUN和Scr均明显升高,差异显著(P<0.01);各治疗组与模型组比较,BUN、Scr均明显降低(P<0.05、0.01);水苏碱高剂量组降低BUN、Scr作用明显优于依那普利组(P<0.05)。见图 1。
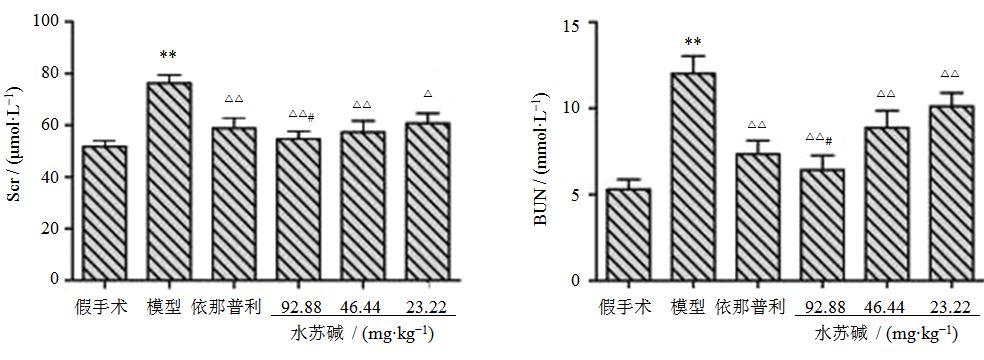
|
图 1 各组大鼠血清Scr和BUN水平 (x±s,n=10)
Fig. 1 Levels of Scr and BUN in serum of rats in each group (x±s,n=10)
与假手术组比较:**P<0.01;与模型组比较:△P<0.05 △△P<0.01;与依那普利组比较:#P<0.05,下同 **P < 0.01 vs Sham group; △P < 0.05 △△P < 0.01 vs model group; #P < 0.05 vs Enalapril group,same as below |
HE染色光镜下显示,假手术组HE染色肾脏病理未见明显异常;模型组肾间质大量炎性细胞浸润,皮质部分肾小管萎缩及扩张现象广泛存在,肾小管上皮细胞坏死、脱落极为严重,间质水肿导致肾间质宽度增加明显,间质纤维化程度比较高;依那普利及水苏碱高、中剂量组与模型组比较,均能减轻肾小管损伤(P<0.05、0.01);水苏碱高剂量组减轻肾小管损伤作用优于依那普利组(P<0.05)。见图 2、3。
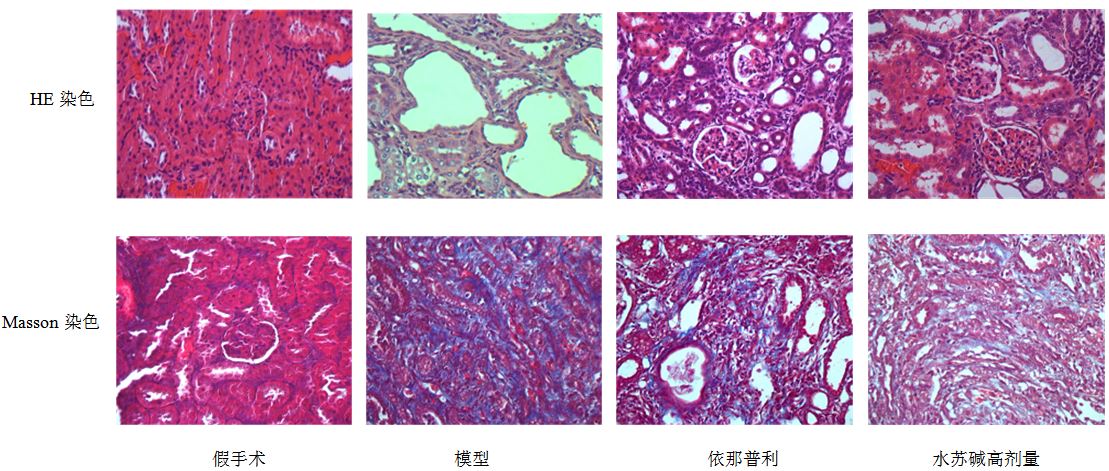
|
图 2 各组大鼠的肾小管损伤指数 (HE染色) 和肾组织胶原相对面积 (Masson染色) Fig. 2 Renal tubular damage index (HE staining) and relative area of renal tissue collagen (Masson staining) ofrats in each group |
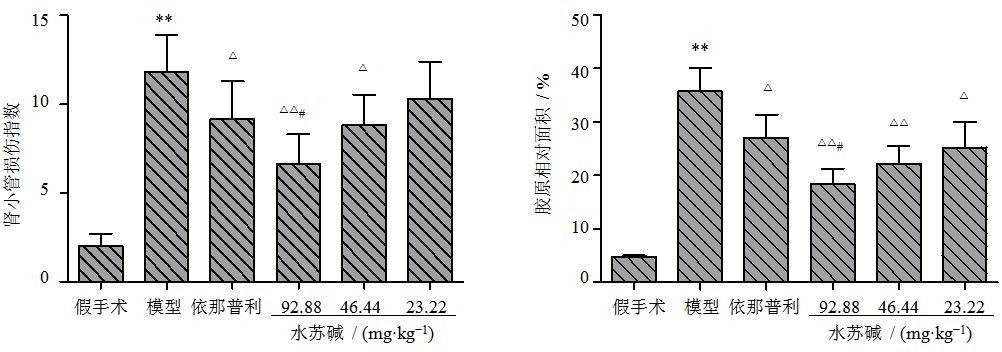
|
图 3各组大鼠肾小管损伤指数和肾组织胶原相对面积 (x±s,n=10) Fig. 3 Renal tubular damage index and relative area of renal tissue collagen of rats in each group (x±s,n=10) |
Masson染色假手术组未见异常;模型组肾间质胶原染色加深,分布面积更为广泛;同样观察到间质宽度加宽,肾小管的扩张及萎缩;依那普利及水苏碱高、中、低剂量组与模型组比较,肾间质胶原相对面积明显减小(P<0.05、0.01);与依那普利组比较,水苏碱高剂量组降低肾间质胶原相对面积的效果更为显著(P<0.05)。见图 2、3。
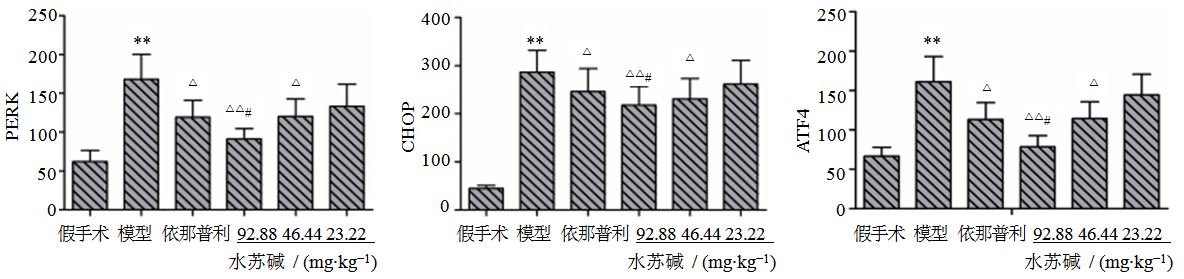
3.4 肾组织PERK蛋白的表达假手术组可见少量PERK存在于肾小管上皮细胞,呈现棕黄色颗粒。模型组PERK大量存在,与假手术组比较表达明显升高(P<0.01);依那普利及水苏碱高、中剂量组与模型组比较,PERK的表达明显降低(P<0.05、0.01);与依那普利组比较,水苏碱高剂量组更能显著降低PERK的表达(P<0.05)。见图 4、5。
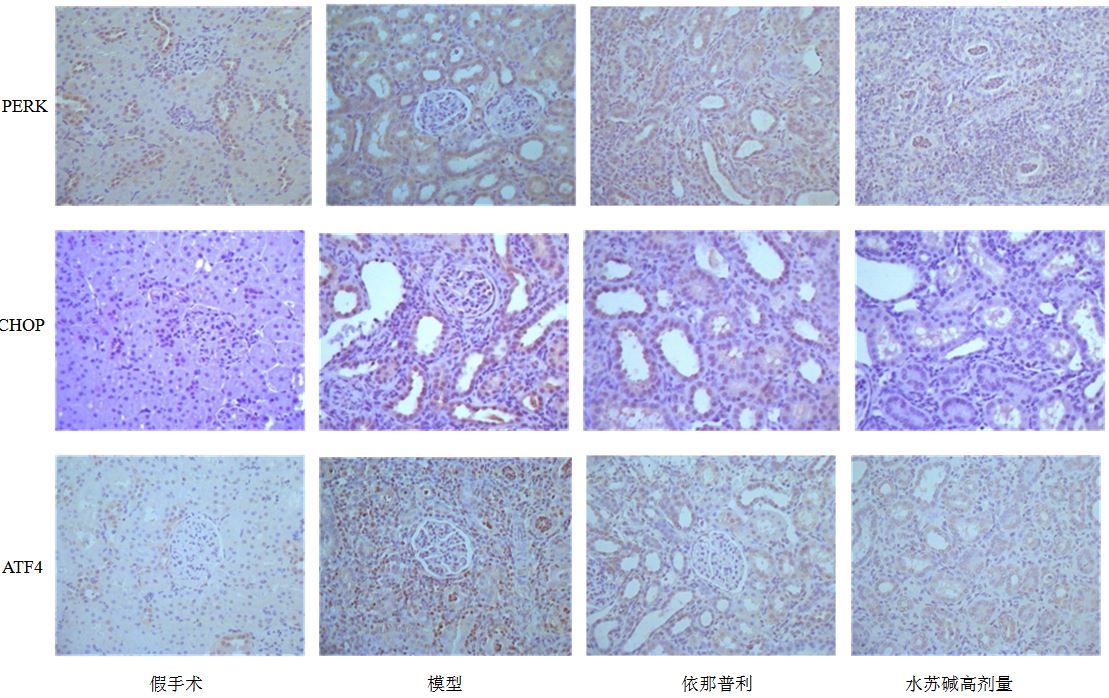
|
图 4 各组大鼠肾组织PERK、CHOP、ATF4蛋白表达 (免疫组化) Fig. 4 Expression of PERK,CHOP,and ATF4 in renal tissue of rats in each group (immunohistochemistry) |
|
图 5 各组大鼠肾组织PERK、CHOP、ATF4蛋白表达半定量分析 (x±s) Fig. 5 Expression of PERK,CHOP,and ATF4 in renal tissue of rats in each group (x±s) |
假手术组偶见肾小管上皮细胞胞浆中CHOP的阳性表达;模型组肾小管上皮细胞胞浆中CHOP表达明显增多(P<0.01),呈不均匀颗粒状;依那普利及水苏碱中、高剂量组与模型组比较,CHOP表达明显减少(P<0.05、0.01);水苏碱高剂量组与依那普利组比较有差异(P<0.05);表明水苏碱高剂量组能显著降低CHOP表达,其作用优于依那普利组。见图 4、5。
3.6 肾组织ATF4蛋白的表达模型组与假手术组比较,ATF4的表达明显升高(P<0.01);依那普利及水苏碱高、中剂量组与模型组比较,ATF4的表达明显降低(P<0.05、0.01);与依那普利组比较,水苏碱高剂量组更能显著降低ATF4的表达(P<0.05)。见图 4、5。
4 讨论肾间质纤维化是所有慢性肾病进行性发展的最终结果。肾间质纤维化的程度与肾功能的减退呈高度相关,且与慢性肾病的预后密切相关,因此减轻肾间质纤维化的程度有利于延缓慢性肾病向肾病终末期转化的速度。
本研究采用单侧输尿管梗阻诱导肾间质纤维化动物模型,输尿管的梗阻引起尿路压力增高,肾血流降低,静脉引流阻塞,并伴有炎症细胞浸润、肌纤维母细胞的过度增殖、胞外基质沉积[10]。术后14 d模型组大鼠肾小管上皮细胞萎缩及扩张、炎症细胞浸润明显加重,Masson染色显示肾间质胶原蛋白沉积增多,血清Scr和BUN浓度升高,这与临床常见的输尿管梗阻导致肾间质纤维化是一致的。水苏碱能够明显减轻肾小管的损伤、抑制胶原蛋白的合成、改善肾功能。
内质网是真核生物细胞内最大的细胞器,负责合成转运蛋白质、识别信号肽、糖基化修饰、钙离子贮存等重要的生理功能。当细胞遇到缺血、缺氧、Ca2+平衡紊乱等理化因素时,内质网功能紊乱,不能正确合成、加工、修饰、转运蛋白质,最终引起ERS。内质网激活通过激活未折叠蛋白反应(unfolded protein response,UPR)减少错误折叠蛋白、未折叠蛋白的合成、增强内质网的蛋白质折叠诱导内质网相关降解(endoplasmic reticulum associated degradation,ERAD)基因的表达[11],减轻错误折叠蛋白和未折叠蛋白的进一步聚集,尽量维持内质网的稳定,是一种内质网自我保护的机制,但过强及过久的内质网应激会诱导细胞凋亡,及时清除受损细胞,凋亡的肾小管上皮细胞不仅促进肾小管的萎缩还能引起细胞外基质沉积在凋亡细胞上,最后导致肾脏的结构和功能损伤[12, 13, 14, 15]。
内质网腔内存在3种未折叠蛋白感受器,即跨膜蛋白:PERK、抑制物阻抗性酯酶(inositol requiring enzyme l,IRE l)和激活作用转录因子(activating transcription factor 6,ATF6)。在ERS早期,PERK作为一种内质网I型跨膜蛋白,能够明显地感受到错误折叠蛋白、未折叠蛋白的积累所带来稳态的打乱,其介导PERK-ATF4信号通路是由UPR激活[16, 17],PERK信号通路能够对细胞起保护作用、促进细胞的生存,适当应激,内质网的BiP/GRP 78与PERK的N端结构域结合,稳态打乱时就会分离开来,激活PERK信号通路,通过自身磷酸化,活化ATF4,其介导的基因涉及到细胞凋亡包括CHOP,PERK-ATF4通路是诱导CHOP表达的关键通路。CHOP是内质网应激的特异性转录因子,过度的内质网应激总会优先启动CHOP信号通路来诱导细胞凋亡,CHOP的表达增加是过度ERS的标志[18]。
实验结果表明:术后14 d,模型组中PERK、ATF4、CHOP的表达均明显升高,假手术组表达甚微,说明单侧输尿管梗阻激活了ERS的PERK信号通路,试图缓解未折叠或错误折叠蛋白的蓄积;通过激活ATF4的表达来调控CHOP基因的转录和翻译,最终启动了CHOP介导的凋亡途径,以便快速消除功能失调的细胞,上述蛋白的表达趋势与文献报道中PERK介导的CHOP凋亡途径相一致[19]。与模型组相比,水苏碱各剂量组均能有效降低PERK、ATF4、CHOP的表达,这表明CHOP介导的细胞凋亡途径参与到了肾间质纤维化的发展,水苏碱通过阻断前期内质网应激的PERK信号通路以阻止肾小管上皮细胞的过度凋亡,延缓肾间质纤维化的发展进程。水苏碱抑制PERK表达介导的细胞凋亡通路的机制有望为研发新药干预肾间质纤维化提供一定的理论依据。
| [1] | Meng L Q, Tang J W, Wang Y, et al. Astragaloside IV synergizes with ferulic acid to inhibit renal tubulointerstitial fibrosis in rats with obstructive nephropathy[J]. Br J Pharmacol, 2011, 162: 1805-1818. |
| [2] | 丁 巍. 内质网应激与肾脏疾病[J]. 国际泌尿系统杂志, 2010, 30(6): 817-821. |
| [3] | Tabas I, Ron D. Integrating the mechanisms of apoptosis induced by endoplasmic reticulum stress[J]. Nat Cell Biol, 2011, 13(3): 184-190. |
| [4] | 刘 俊, 何娅妮. 内质网应激在肾脏疾病进展中的作用[J]. 生理科学进展, 2010, 41(6): 439-442. |
| [5] | Rutkowski D T, Kaufman R J. A trip to the ER: coping with stress[J]. Trends Cell Biol, 2004, 14(1): 20-28. |
| [6] | 江纪武, 肖庆祥. 植物药有效成分手册[M]. 北京: 人民卫生出版社, 1986. |
| [7] | 刘红燕, 王 瑞, 石 明, 等. 小剂量盐酸水苏碱对过氧化氢所致肾小管上皮细胞凋亡的保护作用[J]. 中国中西医结合肾病杂志, 2008, 9(9): 760-763. |
| [8] | 晁 志, 马丽玲, 周秀佳. 益母草中生物碱成分对大鼠的利尿作用研究[J]. 时珍国医国药, 2005, 16(1): 11-12. |
| [9] | Christopher R, Martens D, Edwards G. Peripheral vascular dysfunction in chronic kidney disease[J]. Cardiol Res Pract, 2011, doi: 10. 4061/2011/267257. |
| [10] | 张新志, 何立群. 肾小管间质纤维化动物模型的研究进展[J]. 时珍国医国药, 2010, 21(4): 969-971. |
| [11] | 李 明, 丁 健, 缪泽鸿. 未折叠蛋白反应的信号转导[J]. 生命科学, 2008, 20(2): 246-252. |
| [12] | 袁杨刚, 丁桂霞, 张爱华, 等. 内质网应激与肾脏损伤[J]. 中国肾脏病杂志, 2011, 27(12): 949-952. |
| [13] | Stefan J, Marciniak D R. Endoplasmic reticulum stress signaling in disease[J]. Physiol Rev, 2006, 86: 1133-1149. |
| [14] | Basseri S, Austin R C. Endoplasmic reticulum stress and lipid metabolism: mechanisms and therapeutic potential[J]. Biochem Res Int, 2012, doi: 10. 1155/2012/841362. |
| [15] | 廖晓辉. 肾小管上皮细胞凋亡在肾间质纤维化中的作用[J]. 国际泌尿系统杂志, 2008, 28(3): 390-393. |
| [16] | 李载权, 周爱儒, 唐朝枢. 内质网应激反应分子机理研究进展[J]. 中国生物化学与分子生物学报, 2004, 20(3): 283-288. |
| [17] | 吕振嵘, 刘秀华. 蛋白激酶R样内质网激酶信号通路在内质网应激中作用的研究进展[J]. 生理科学进展, 2011, 42(2): 154-157. |
| [18] | Oyadomari S, Mori M. Role of CHOP/GADD153 in endoplasmic reticulum stress[J]. Cell Death Differ, 2004, 11(4): 381-389. |
| [19] | Chiang C K, Hsu S P, Wu C T, et al. Endoplasmic reticulum stress implicated in the development of renal fibrosis[J]. Mol Med, 17(11/12): 1295-1305. |
 2014, Vol. 45
2014, Vol. 45


