2. 武汉大学药学院, 湖北 武汉 430072
2. Pharmaceutical College of Wuhan University, Wuhan 430072, China
石榴皮Granati Pericarpium是石榴科植物石榴Punica granatun L. 的干燥果皮,味酸、涩,性温,归大肠经,作为传统中药在我国历版药典中均有收载[1]。石榴皮含有丰富的鞣质、黄酮、生物碱等多种化学成分[2],其中以鞣质的量最为丰富,其量高达10.4%~21.3%,主要包括没食子酸、鞣花酸、安石榴林、安石榴苷等[3]。近年来的研究显示,石榴皮鞣质具有抗病毒、抗肿瘤[4, 5, 6]、抗动脉粥样硬化[7]以及预防心血管疾病等多种药理活性。我国石榴资源丰富,石榴皮廉价易得,具有巨大的潜在开发应用价值。本课题组前期研究发现石榴皮鞣质对腺嘌呤性慢性肾衰大鼠和阿霉素肾病大鼠具有保护作用[8, 9],具有改善慢性肾脏疾病的作用。本实验以肾纤维化大鼠为研究对象,探究石榴皮鞣质对肾纤维化大鼠肾功能的改善作用,为肾纤维化的治疗及石榴皮鞣质的开发利用提供相关的理论依据。
1 材料 1.1 药材与试剂石榴皮购于西安中药材市场,经武汉大学药学院张洪教授鉴定为石榴科(Punicaceae)石榴属Punica L.植物石榴Punica granatum L. 的果皮,符合《中国药典》2010年版规定。没食子酸对照品(批号110831-2200303,中国食品药品检定研究院),干酪素(批号20080702,上海伯奥生物科技公司),青霉素(批号C1210701,华北制药股份有限公司),蒸馏水自制,丙酮(分析纯)、酒精、二甲苯(国药集团),叠氮化钠(NaN3,批号201012051457,谷歌生物有限公司),缬沙坦胶囊(批号130109,北京诺华制药有限公司)。其余试剂均为分析纯。
1.2 动物雄性SPF级SD大鼠,体质量150~200 g,由武汉大学动物实验中心提供,动物使用合格证号:SCXK(鄂)2008-0004。
1.3 仪器设备AG245型电子分析天平(瑞士Mettler),UV—2800紫外可见分光光度计[尤尼柯(上海)仪器有限公司],KD—BM包埋机(浙江省金华市科迪仪器设备有限公司),JB—L5冻台(武汉俊杰电子有限公司),RM2016切片机(上海徕卡仪器有限公司),YXJ—1离心机(深圳天南海北实业有限公司),KD—P摊片机(浙江省金华市科迪仪器设备有限公司),7170A型日立生化自动分析仪(日本东亚公司),ALPHAI—4/RZ—2冷冻干燥机(德国Martin Christ),CK2型倒置显微镜(日本Olympus公司)。
2 方法 2.1 石榴皮鞣质的提取称取干燥石榴皮约100 g,粉碎。室温下,用10倍量70%的丙酮浸渍约6 h,后超声30 min,滤取滤液。其残渣重复以上操作2次,合并滤液并浓缩。浓缩液上HP-20柱,以70%乙醇洗脱,收集洗脱液,浓缩、冷冻干燥,即得石榴皮鞣质粉末。按《中国药典》2010年版中鞣质定量测定方法对石榴皮中鞣质的量进行测定,石榴皮鞣质粉末中含鞣质55.62%。
2.2 分组实验所用大鼠共3批,每批40只。将40只雄性SD大鼠常规喂养1周以适应实验环境后,随机分为5组,即假手术组、模型组、缬沙坦阳性对照组、石榴皮鞣质低剂量组(20 mg/kg,以鞣质的量计)、石榴皮鞣质高剂量组(60 mg/kg),每组8只。
2.3 肾纤维化模型的建立及给药参照文献报道采用左侧输尿管结扎方法[10]构建大鼠肾纤维化模型。先以5%水合氯醛(按6 mL/kg计算)ip麻醉大鼠,常规消毒。无菌条件下,沿腹正中打开腹腔,暴露左侧肾脏并游离左侧输尿管,用丝线在接近肾盂段,即中上1/3处,两侧结扎并从中间剪断输尿管。依次缝合肌肉层和皮肤层,关闭腹腔。其中假手术组大鼠按相似的操作步骤进行手术,但仅游离左侧输尿管,不对其进行结扎和剪断。术后每日ip 1%(1 g/100 mL蒸馏水)青霉素,连续3 d,同时伤口以碘伏消毒,防止感染。
术后当天开始ig给药,石榴皮鞣质高、低剂量组,分别给予60、20 mg/kg溶于蒸馏水的石榴皮鞣质。缬沙坦组按10 mg/kg给予缬沙坦。假手术组与模型组大鼠均给予等量蒸馏水。各组大鼠每天同一时间给药1次,直至实验结束。
2.4 样品采集及观察指标的检测于术后1、2、3周分别取一批动物,将各组8只大鼠分别置于代谢笼中收集24 h尿液,记录尿量体积,加入1% NaN3溶液200 μL以防腐,-70 ℃冰箱保存,用于24 h尿蛋白定量检测和测定尿液中Ca2+、P3+的浓度变化。分别以10%水合氯醛麻醉各组大鼠,并行心脏采血2~3 mL,迅速在低温下4 000 r/min,离心13 min,分离血清,送武汉大学人民医院检验科检测尿素氮(BUN)和血肌酐(Scr)水平。处死大鼠,剖开腹腔,肉眼观察肾脏的外形变化,迅速取左侧肾组织,去掉包膜,切成薄片,4%多聚甲醛固定24 h,自来水洗净残留固体成分,修整使切面平整,再以75%(过夜)、85%(2 h)、90%(2 h)、95%(1 h)及100%乙醇(30 min×2)顺序梯度脱水,二甲苯(3次,每次5~10 min)透明,石蜡包埋后进行修整、切片(厚度约4 μm),摊片后于60 ℃烘箱内烘烤,室温保存。进行苏木素-伊红(HE)染色和Masson染色,光镜观察肾组织的病理学变化。
取肾组织Masson染色切片采用Masson染色半定量[11],每组每张切片在肾皮质肾小管区随机挑选8个不重复200倍视野进行观察,以蓝色胶原沉积为阳性信号,计算蓝染面积,以其平均值为每张切片的肾间质胶原面积[12],并计算胶原占整个组织面积的比率即胶原的量。
2.5 统计学分析运用SPSS 13.0统计分析软件包对实验数据进行处理,采用单因素方差分析法来判别组间的差异性,各组数据以x±s表示。
3 结果 3.1 大鼠尿液生化指标检测结果 3.1.1 各组大鼠24h尿蛋白定量检测结果 术后1周,模型组大鼠尿蛋白的量较假手术组明显增加(P<0.05),石榴皮鞣质低、高剂量组及缬沙坦组虽有小幅增加,但差异无统计学意义。术后2周,模型组及石榴皮鞣质低、高剂量组大鼠尿蛋白的量较假手术组均非常显著增加(P<0.01),缬沙坦组较假手术组显著增加(P<0.05),但石榴皮鞣质高剂量组与缬沙坦组大鼠尿蛋白较模型组均显著降低(P<0.05)。术后3周,各造模组大鼠尿蛋白的量较假手术组均有非常显著性增加(P<0.01),而石榴皮鞣质低、高剂量组与缬沙坦组大鼠尿蛋白较模型组均显著降低(P<0.05)。除假手术组外,各组大鼠尿蛋白的量随时间呈正相关。结果见表 1,提示石榴皮鞣质对肾纤维化导致的尿蛋白水平增加具有下调作用。
|
|
表 1 石榴皮鞣质对肾纤维化大鼠24 h尿蛋白量的影响(x±s,n=8) Table 1 Effect of tannins from Granati Pericarpium on 24 h urine protein quantity of renal fibrosis rats (x±s,n=8) |
术后1周,各组大鼠尿液中Ca2+浓度无明显变化。术后2周,模型组、石榴皮鞣质高和低剂量组、缬沙坦组大鼠尿液中Ca2+浓度较假手术组显著升高(P<0.05),但石榴皮鞣质高剂量组与模型组比较大鼠尿液中Ca2+浓度显著降低(P<0.05),石榴皮鞣质低剂量组、缬沙坦组与模型组间差异无统计学意义。术后3周,模型组、石榴皮鞣质高和低剂量组、缬沙坦组大鼠尿液中Ca2+浓度较假手术组显著升高(P<0.05、0.01),但石榴皮鞣质低剂量组大鼠尿液中Ca2+浓度较模型组显著降低(P<0.05),石榴皮鞣质高剂量组、缬沙坦组大鼠尿液中Ca2+浓度较模型组非常显著降低(P<0.01)。结果见表 2,提示石榴皮鞣质可显著性改善肾纤维化大鼠出现明显的Ca2+紊乱现象。
|
|
表 2 石榴皮鞣质对肾纤维化大鼠尿液中Ca2+和P3+浓度的影响 (x±s,n=8) Table 2 Effect of tannins from Granati Pericarpium on concentration of Ca2+ and P3+ in urine of renal fibrosis rats (x±s,n=8) |
术后1周模型组大鼠尿液中P3+浓度显著低于假手术组(P<0.05)。各给药组大鼠尿液中P3+浓度虽有一定程度的降低,但与假手术组比较无统计学意义。术后2周,与假手术组比较,模型组大鼠尿液中P3+浓度非常显著下调(P<0.01),石榴皮鞣质低剂量组有降低趋势(P<0.05),而石榴皮鞣质高剂量组和缬沙坦组差异无统计学意义;与模型组比较,石榴皮鞣质低和高剂量组、缬沙坦组大鼠尿液中P3+浓度均显著增加(P<0.05)。术后3周,各造模组大鼠尿液中P3+浓度较假手术组均显著降低(P<0.01),与模型组比较,石榴皮鞣质高剂量组和缬沙坦组大鼠尿液中P3+浓度均显著增加(P<0.05),而石榴皮鞣质低剂量组影响不显著。结果见表 2,提示肾纤维化大鼠体内P3+的紊乱在术后1周即出现,但程度较轻,术后3周较为严重;石榴皮鞣质可显著改善肾纤维化大鼠机体中的P3+紊乱现象。
3.2 大鼠血液生化指标检测结果各组大鼠分别于术后1、2、3周处死前,ip 10%水合氯醛麻醉,心脏穿刺取血,测定血清中的Scr和BUN,结果见表 3。术后1、2、3周假手术组Scr水平无明显变化。模型组、石榴皮鞣质组、缬沙坦组Scr均较同期假手术组显著增加(P<0.01),缬沙坦组与模型组比较显著降低Scr水平(P<0.01)。术后2、3周,石榴皮鞣质低剂量组与模型组比较显著降低Scr水平(P<0.05)。术后1、2、3周,石榴皮鞣质高剂量组与同期模型组比较显著降低Scr水平(P<0.05)。提示Scr水平是肾纤维化较为敏感的指标,石榴皮鞣质高剂量组改善效果较低剂量组显著。
|
|
表 3 石榴皮鞣质对肾纤维化大鼠血清中Scr和BUN水平的影响 (x±s,n=8) Table 3 Effect of tannins from Granati Pericarpium on levels of Scr and BUN in serum of renal fibrosis rats (x±s,n=8) |
与假手术组比较,术后1周,模型组大鼠血清BUN水平明显增高(P<0.05),给药组虽有升高趋势,但与假手术组比较无统计学意义。术后2周,模型组与石榴皮鞣质低剂量组大鼠血清BUN水平较假手术组显著增加(P<0.01),而石榴皮高剂量组与缬沙坦组有增加趋势(P<0.05)。术后3周,模型组与假手术组比较大鼠血清BUN水平增加非常显著(P<0.01),各给药组与模型组比较大鼠血清BUN水平显著降低(P<0.05、0.01),见表 3。
3.3 肾脏组织病理改变肉眼观察术后1、2、3周,假手术组肾脏大小、形态正常,颜色呈暗红色;模型组及各给药组左侧肾脏均明显肿大(约为正常肾脏的3~4倍),颜色呈暗灰色,内含褐色混浊微稠液体,肾实质变薄。
HE染色后光镜观察,假手术组大鼠肾组织中的肾小球、肾小管大小和形态正常,未见间质炎性细胞浸润及纤维增生等改变。术后1、2、3周处死的假手术组大鼠肾脏变化无明显差异。术后1周,模型组大鼠左侧肾脏的部分近端肾小管上皮细胞出现明显的空泡变性,管腔内可以观察到脱落坏死的上皮细胞,远端肾小管扩张,可见明显的间质水肿和炎性细胞浸润;术后2周,肾皮质变薄,小管上皮细胞的空泡变性程度加剧,炎性细胞浸润更加明显,肾小管萎缩明显,集合管和远曲小管呈现囊状扩张,肾间质可观察到成纤维细胞的增殖和纤维化;第3周,可见皮髓质变薄,大量炎性细胞浸润,大部分肾小管萎缩,间质成纤维细胞增殖明显,间质纤维化加重,结果显示造模成功。石榴皮鞣质低、高剂量组及缬沙坦组术后1周,均可见肾小管上皮细胞空泡变性、坏死,炎性细胞浸润,肾小管扩张程度较相同时间点的模型组明显减轻,减轻程度大小依次为缬沙坦组、石榴皮鞣质高剂量组、石榴皮鞣质低剂量组;术后2周,上述病变总体较第1周均有明显加重,但各给药组较同期模型组炎性细胞浸润减轻,细胞空泡变性、坏死,肾小管扩张、萎缩及间质纤维化程度均有不同程度减轻;术后3周,给药组较假手术组间质成纤维化细胞、间质纤维化程度明显,缬沙坦组与石榴皮鞣质组炎性细胞浸润较模型组减轻明显,间质成纤维化细胞、间质纤维化程度较轻,而皮细胞变性、肾小管扩张及萎缩差异不明显,见图 1。
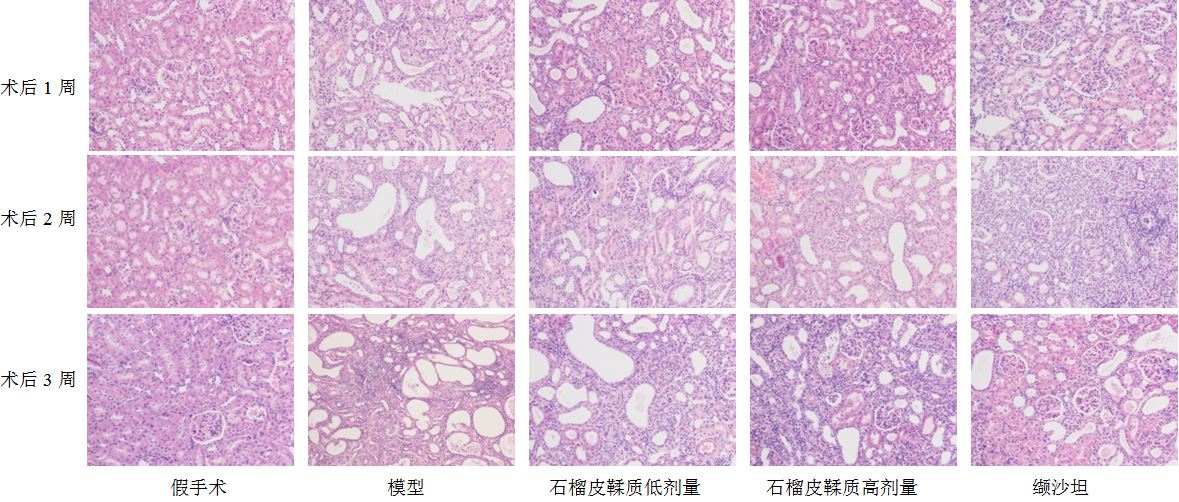
|
图 1 肾脏病理HE染色 Fig. 1 HE staining of renal pathology |
Masson染色结果显示,假手术组肾组织中肾小球基膜,肾小管毛细血管周围有少量蓝色胶原染色,肾小管周围间质部分显色很少;模型组肾间质区可见大量清晰的蓝色胶原纤维增生,且梗阻时间越长,蓝色胶原增多越明显,间质纤维化呈灶状分布,偶见肾小球局灶节段性硬化;石榴皮鞣质低、高剂量组和缬沙坦组肾间质胶原纤维较假手术组比较有明显的增加,且时间越长,蓝色胶原纤维越多,但胶原纤维的量均少于同期模型组,缬沙坦组与模型组差异最大,其次为石榴皮鞣质高剂量组、石榴皮鞣质低剂量组。结果见图 2。Masson染色的半定量结果显示,与假手术组比较,模型组胶原的量明显增加(P<0.01),石榴皮鞣质高、低剂量组与模型组比较显著降低(P<0.01),见表 4。
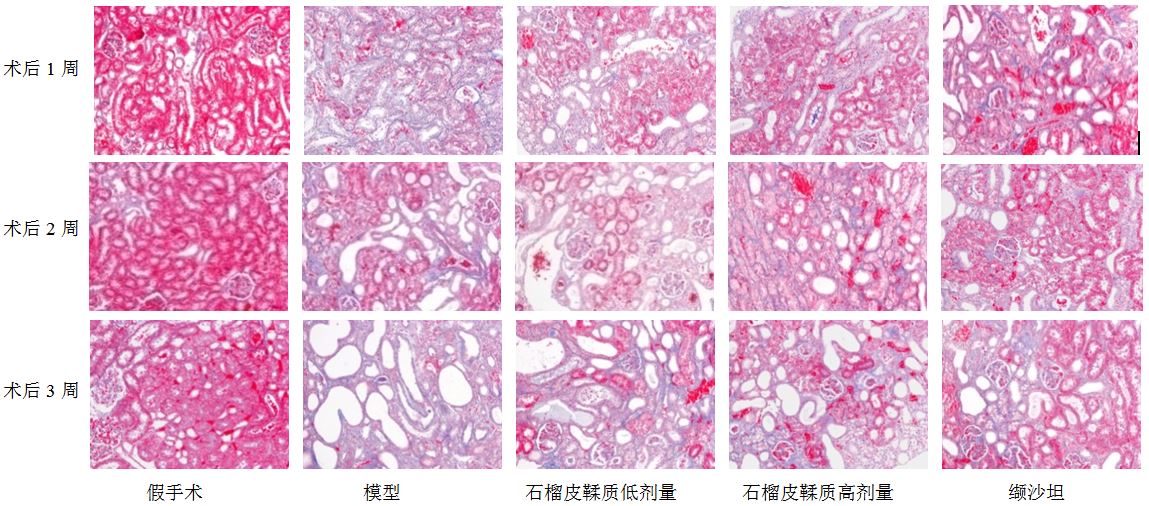
|
图 2 肾脏病理Masson染色 Fig. 2 Masson staining of renal pathology |
|
|
表 4 石榴皮鞣质对肾纤维化大鼠肾间质胶原量的影响 (x±s,n=8) Table 4 Effect of tannins from Granati Pericarpium on renal interstitial collagen content of renal fibrosis rats (x±s,n=8) |
肾间质纤维化被认为是慢性肾脏疾病进展至肾功能衰竭的共同途径和病理特征[13]。参与肾间质纤维化这一病程的因素众多,如细胞外基质过多沉积,成纤维细胞的过度增生,细胞因子和血管活性物质的作用。左侧输尿管结扎诱导肾纤维化模型,是目前公认的导致肾间质纤维化病变,符合临床慢性肾衰特点的经典动物模型[14]。本实验采用单侧输尿管结扎制备大鼠肾纤维化模型,观察石榴皮鞣质对肾间质纤维化的作用。并对肾组织进行HE、Masson染色,及检测尿液尿蛋白、Ca2+、P3+及血样BUN、Scr生化指标。结果显示,HE、Masson均观察到造模组肾组织有不同程度的损伤、纤维化。尿蛋白、Ca2+、BUN、Scr水平增加,P3+浓度降低。模型组大鼠造模后1周HE染色、Masson染色、BUN和Scr指标开始偏离假手术组,且随病程的加重其偏离程度越明显。HE、Masson染色可以从形态学角度观察肾组织不同时间发生的变化,是肾脏病变的重要指标,同时BUN和Scr值比同期假手术组增高,也反映了模型组大鼠的病理状态,说明造模成功。
本实验对造模后,各组大鼠尿液中的Ca2+、P3+变化趋势进行了考察。结果显示,术后1周Ca2+、P3+均有变化,但差异并不太明显,术后2、3周,P3+浓度在输尿管结扎的各组大鼠尿液中有明显的下调趋势,而Ca2+则有一定程度的增加趋势。根据HE、Masson染色结果得知,术后1周肾组织的肾皮质变薄,肾小管上皮细胞的空泡变性程度加剧,炎性细胞浸润更加明显,肾小管萎缩明显,集合管和远曲小管呈现囊状扩张,肾组织受损已有所体现,肾功能已受到一定的影响,而Ca2+、P3+未见异常,可见在肾纤维化初期,肾组织对Ca2+、P3+的代偿作用可以维持Ca2+、P3+正常水平。而随着肾功能的减退,肾脏对P3+的排泄能力进一步的下降,P3+排泄障碍导致血清中P3+浓度的增加,在正常机体中Ca2+、P3+浓度值的乘积趋近一个定值,两者互相影响。当某一种离子浓度升高,对另一种离子具有的抑制效应,必引起另一种离子浓度的下调,因此,血液P3+浓度上调,Ca2+浓度就会下调,排泄量也随之减少,在Ca2+、P3+浓度异常的初期,机体可以通过其他途径对异常的Ca2+、P3+浓度进行代偿,使其趋于正常值。在病态机体中,紊乱的Ca2+、P3+长期得不到恢复,机体的代偿作用便再无法维持其浓度的正常水平,这时Ca2+、P3+的紊乱就显现出来。
从实验结果可以看出,石榴皮鞣质具有显著改善肾纤维化大鼠肾功能的作用,表现为用药后石榴皮鞣质高、低剂量组与模型组比较,HE、Masson染色肾组织病变程度明显减轻,BUN和Scr水平均明显下调,与缬沙坦阳性组有相似的调节作用。同时观察到石榴皮鞣质对肾纤维化导致的Ca2+、P3+紊乱具有一定的调节改善作用。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 郭晓萍, 尹 苗, 陈希文, 等. 石榴皮鞣质的提取及体外抑菌活性[J]. 江苏农业科学, 2011, 39(3): 403-405. |
| [3] | 刘延泽, 李海霞. 石榴皮中的鞣质及多元酚类成分[J]. 中草药, 2007, 38(4): 502-504. |
| [4] | Lansky E P, Newman R A. Punica granatum (pomegranate) and its potential for prevention and treatment of inflammation cancer[J]. Ethnopharmacology, 2007, 109(2): 177-206. |
| [5] | 杨 林, 周本宏. 石榴皮中鞣质和黄酮类化合物抑菌作用的实验研究[J]. 时珍国医国药, 2007, 18(10): 2335-2336. |
| [6] | Negip S, Jayaprakasha G K, Jena B S. Antioxidant and anti-mutagenic activities of pomegranate peel extracts[J]. Food Chem, 2003, 80(2): 393-397. |
| [7] | Aviram M, Volkova N, Coleman R, et al. Pomegranate phenolics from the peels, arils, and flowers are antiatherogenic: studies in vivo in atherosclerotic apolipoprotein E-deficient (E0) mice and in vitro in cultured macrophages and lipoproteins[J]. Agric Food Chem, 2008, 56(3): 1148-1157. |
| [8] | 周本宏, 郭志磊, 王慧媛, 等. 石榴皮鞣质对腺嘌呤性慢性肾衰大鼠保护作用研究[J]. 中国药学杂志, 2009, 44(22): 1699-1703. |
| [9] | 周本宏, 郭志磊, 范 捷. 石榴皮鞣质对阿霉素肾病大鼠的保护作用[J]. 中国医院药学杂志, 2010, 30(20): 1722 -1725. |
| [10] | 孙培荣, 石永兵, 施晓松. 银杏达莫对梗阻性肾病大鼠肾间质纤维化的作用[J]. 现代临床医学, 2010, 36(3): 171-173. |
| [11] | 唐云海, 朱春玲. 山莨菪碱对梗阻性肾病大鼠肾间质纤维化的抑制[J]. 贵阳医学学报, 2010, 35(1): 26-29. |
| [12] | 张海燕, 李幼姬, 候赛云, 等. 结缔组织生长因子在单侧输尿管梗阻大鼠肾组织中的表达[J]. 中国病理生理杂志, 2006, 22(3): 427-430. |
| [13] | 龚绍琼, 张 弋. 氯沙坦对单侧输尿管梗阻大鼠肾间质纤维化的保护作用[J]. 实用医学杂志, 2008, 24(16): 2769-2771. |
| [14] | Lijnen H R. Pleiotrpic functions of plasminogen activator inhibitor-1[J]. J Thromb Haemost, 2005, 3(1): 35-45. |
 2014, Vol. 45
2014, Vol. 45



