2. 四川省农业科学院土壤肥料研究所, 四川 成都 610066
2. Soil and Fertilizer Institute, Sichuan Academy of Agricultural Sciences, Chengdu 610066, China
川楝Melia toosendan Sieb. et Zucc. 是楝科(Meliacease)楝属Melia Linn. 的落叶乔木[1],主要分布于四川、贵州、云南,主要有效成分为川楝素(toosendanin,C3OH38O11),有驱虫、抗癌、抗毒素等作用[2]。川楝虽然分布广泛,但川楝素的产量却较低,而药用植物内生菌可以产生与宿主相同或相似的天然活性物质[3],如苦楝素[4]、鬼臼毒素类似物 [5]。
聚酮类化合物(polyketide,PK)与非核糖多肽(nonribosonmal peptide,NRP)是2类具有代表性的天然产物,可用作抗生素、抗真菌剂、抗癌药物、免疫制剂、抗病毒药物等[6,7]。催化这些天然产物合成途径的酶称为聚酮合成酶(polyketide synthase,PKS)和非核糖体多肽合成酶(nonribosonmal peptidesynthetase,NRPS)。已有研究发现,禾本科植物内生真菌[8]中存在NRPS,番荔枝Annona squamosa L. 内生真菌中存在PKS[9]。但是目前对药用植物内生真菌PKS和NRPS的研究相对较少。
传统真菌的鉴定以形态、生化等表型特征为基础,过程复杂,同时不产孢菌株用此方法鉴定较为困难。而分子生物学的发展为真菌的鉴定提供了更全面、科学的依据。ITS序列在核苷酸序列上的高度变异性和长度上的保守型,可以获得足够的信息来反映真菌种水平间的差异,目前已应用于药用植物内生真菌的鉴定[10]。
本研究对川楝内生真菌进行了形态学鉴定,通过PCR扩增其ITS序列、PKS和NRPS基因,进行BLAST比较和系统发育分析,以期了解川楝内生真菌的遗传多样性,为川楝内生真菌资源的开发利用提供依据,同时丰富PKS和NRPS基因数据库。
1 材料采集四川省雅安市、攀枝花市、宜宾市、广元市、成都市、乐山市、西昌市、绵阳市、达州市9个地点,经四川农业大学胡超讲师鉴定为川楝Melia toosendan Sieb. et Zucc. 的根、茎、叶、皮、果,从中共分离得到了126株内生真菌,经去重和限制性片段长度多态性(restriction fragment length polymorphism,RFLP)分析后选取39株多样性明显的菌株作为本研究的目标菌株。
2 方法 2.1 内生真菌表型鉴定用PDA培养基对39株菌株进行插片培养,观察菌落特征和显微形态特征,参照魏景超[11]的方法将其鉴定到属。
2.2 内生真菌总DNA的提取采用改良的CTAB法[12]提取川楝内生真菌的DNA,用1%的琼脂糖凝胶电泳检测DNA的质量和大小,置于-20 ℃保存备用。
2.3 ITS-PCR扩增ITS-PCR扩增所用引物为ITS1(5’-TCCGTAG-GTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCT-TATTGATATGC-3’)[13]由上海生工合成。
ITS-PCR扩增的反应体系(30 μL):2×PCR Mix 15 μL,ITS1(10 pmol)1 μL,ITS4(10 pmol)1 μL,DNA 1 μL,无菌重蒸水补足至30 μL。反应程序:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,35个循环,72 ℃延伸10 min,产物于4 ℃恒温保存。用1%的琼脂糖凝胶电泳检测产物的大小。
2.4 PKS基因的扩增PKS基因扩增所用引物为KAF(5’-GARKSICAYGGIACIGGIAC-3’)、KAR1(5’-C-CAYTGIGCICCRTGICCIGARAA-3’)和KAR2(5’-CCAYTGIGCICCYTGICCIGTRAA-3’)[14]由上海生工合成。
PKS扩增的反应体系(30 μL):2×PCR Mix 15 μL,KAF(10 pmol)1 μL,KAR1或KAR2(10 pmol)1 μL,DNA 2 μL,无菌重蒸水补足至30 μL。反应程序:94 ℃预变性5 min,94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸2 min,35个循环,72 ℃延伸10 min,产物于4 ℃恒温保存。用1%的琼脂糖凝胶电泳检测产物的大小。
2.5 NRPS基因的扩增NRPS基因扩增所用引物为AUG003(5’-CCGGCACCACCGGNAARCCHAA-3’)和AUG007(5’-CCGGACCATGTCGCCNGTBYKRT-A-3’)[15]由上海生工合成。
NRPS扩增的反应体系(30 μL):2×PCR Mix 15 μL,AUG003(10 pmol)1 μL,AUG007(10 pmol)1 μL,DNA 2 μL,无菌重蒸水补足至30 μL。反应程序:94 ℃预变性4 min,94 ℃变性30 s,60 ℃退火1 min,72 ℃延伸2 min,35个循环,72 ℃延伸10 min,产物于4 ℃恒温保存。用1%的琼脂糖凝胶电泳检测产物的大小。
2.6 测序及序列分析将ITS的产物和得到的PKS、NRPS基因片段直接送华大基因科技有限公司测序。将所得序列在GenBank中进行BLAST同源性检索(http://blast.ncbi.nlm.nih.gov/),将获得的同源序列和测定序列用Clustal X进行分析,采用MEGA 5.0软件包中的Kimura-2-Parameter Distance模型进行多序列匹配,用邻接法(Neighbor-joining,NJ)构建系统发育树,Bootstrap 1 000次检测各分支的置信值。将所测的序列提交到GenBank数据库,获得登录号。
3 结果与分析 3.1 川楝内生真菌的鉴定本实验共分离得到126株内生真菌,经初步去重和限制性片段多态性分析后选择39株为代表菌株进行进一步分析,见表 1。经过表型鉴定(部分菌株的表型见图 1),能够鉴定到属的内生真菌菌株为31株,分属于17个属。部分菌株由于未产孢而没有鉴定到属。它们分别为青霉属Penicillium Lk. ex Frise、木霉属Trichoderma Pers. ex FR.、曲霉属Aspergillus Micheli ex Fr.、交链孢属Alternaria Nees ex Wallr.、黑葱花霉属Periconia Tode ex Schw.、附球菌属Epicoccum Lk. ex Wallr.、镰孢霉属Fusarium Lk. ex Fr.、枝顶孢霉属Acremonium Lk. ex Fr.、多节孢属Nodulisporium Press、肉座菌属Hypocrea Fr.、毛壳菌属Chaetomium Kunze et Schmidt、脉纹孢菌属Neurospora Shear et Dodge、拟茎点霉属Phomopsis Sacc.、芽枝霉属Cladosporium Link ex Fr.、节孢霉属Arthrinium Kunze、茎点菌属Phoma Sacc. 和短梗蠕孢霉属Trichocladium Harz。
|
|
表 1 川楝内生真菌形态学鉴定 Table 1 Morphological identification of endophytic fungi from M. toosendan |
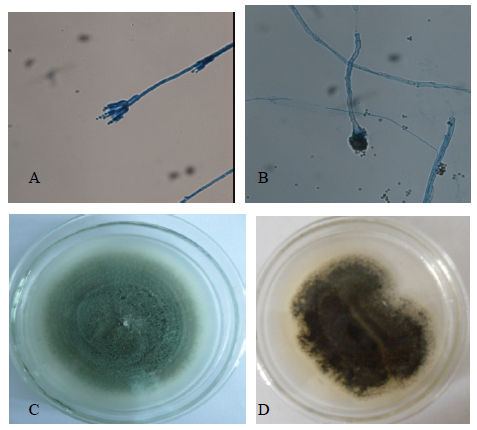 | A、B-光学显微镜的形态特征,C、D-PDA培养基上的菌落(培养时间为14 d,温度为28 ℃);A、C-青霉属,B、D-曲霉属 A and B-morphological characteristics by optical microscope; C and D-colonies on PDA (culture time = 14 d,culture temperature = 28 ℃); A and C-Penicillium; B and D—Aspergillus图 1 部分川楝内生真菌菌株的表型鉴定 Fig. 1 Phenotype identification on some strains of endophytic fungi from M. toosendan |
川楝内生真菌菌株DNA用引物ITS1和ITS4扩增得到的PCR产物,大小在500~600 bp(图 2)。
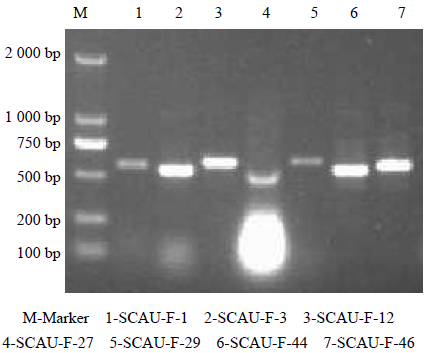 | 图 2 部分菌株ITS-PCR扩增电泳图 Fig. 2 Electrophoretogram of ITS-PCR amplication of some strains |
通过用BLAST在Genbank数据库序列对比分析发现,川楝内生真菌种群结构具有非常丰富的资源多样性。在本研究中,序列相似性最低的为SCAU-F-210,与相似性最高的Periconia macrospinosa相似性仅为86%;产孢(SCAU-F-182)与Botryotinia fuckeliana相似性最高,为100%。
系统发育树(图 3)显示,川楝内生真菌分属于短梗蠕孢霉属、微壳色单隔孢属Microdiplodia
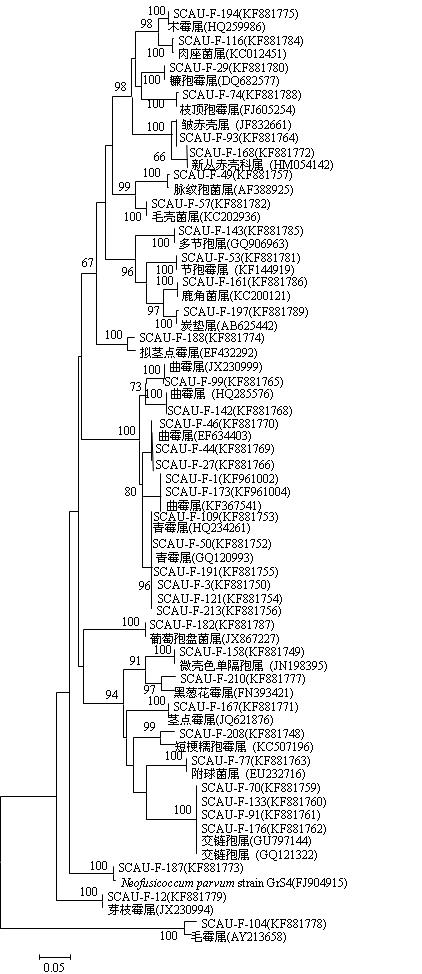 | 图 3 川楝内生真菌ITS序列的系统发育树 Fig. 3 Phylpgenetic tree of ITS sequences of endophytic fungi from M. toosendan |
All.、青霉属、交链孢属、脉纹孢菌属、附球霉属、新丛赤壳科属Neonectria Wollenw.、曲霉属、芽枝霉属、拟茎点霉属、木霉属、茎点霉属、Neofusicoccum parvum Crous、黑葱花霉属、镰孢霉属、毛霉属Mucor Micheli ex Fries、节孢霉属、毛壳菌属、皱赤壳属Rugonectria P. Chaverri et Samuels、多节孢属、肉座菌属、鹿角菌属Xylaria Hill ex Grev.、葡萄孢盘菌属Botryotinia Whetzel、枝顶孢霉属和炭垫属Nemania S. F. Gray 25个属。所得39个序列中有7个序列归属于曲霉属(17.9%),6个归属于青霉属(15.4%),为川楝内生真菌的优势属。
3.3 PKS基因的分析部分菌株的PKS基因扩增电泳图见图 4,由图可见产物条带在600 bp左右。
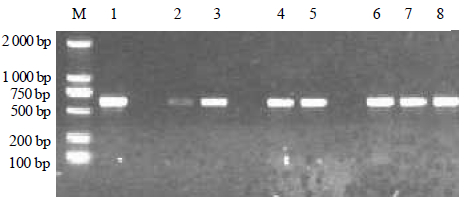 | M-Marker 1~8-扩增产物 M-Marker 1—8-amplification products图 4 部分菌株的PKS基因扩增电泳图 Fig. 4 Electrophoretogram of PKS gene amplication of some strains |
共得到12个PKS基因片段,占总量的30.8%。将测序得到的PKS基因片段用BLAST比对,结果见表 2。本研究得到的PKS片段与GenBank中已知PKS序列的相似度较高,从99%~100%。本研究中得到的PKS基因均为I型的PKS。PKS基因的系统发育树(图 5)显示,它们分属于曲霉属、交链孢属、镰孢霉属、葡孢盘菌属,其中有7个为曲霉属。
|
|
表 2 川楝内生真菌PKS基因的相似菌株及相似度 Table 2 Similarstrains and similarity of PKS genes of endophytic fungi from M. toosendan |
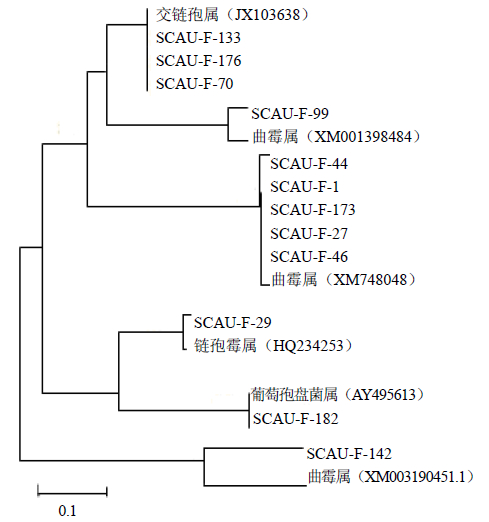 | 图 5 川楝内生真菌PKS基因的系统发育树 Fig. 5 Phylpgenetic tree of PKS genes of endophytic fungi from M. toosendan |
菌株的NRPS基因扩增电泳图见图 6,由图可见产物条带在700 bp左右。本研究共得到了6个NRPS基因片段,占总量的15.4%。将测序得到的NRPS基因片段用BLAST比对,结果见表 3。本研究得到的NRPS片段与GenBank中已知NRPS序列的相似度很高,从99%~100%。
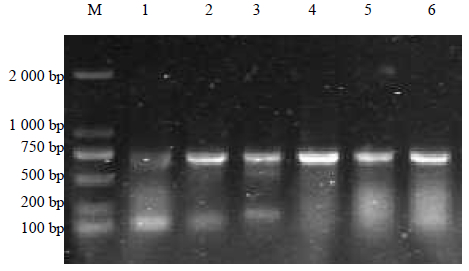 | M-Marker 1~6-扩增产物 M-Marker 1—6-amplification products图 6 菌株的NRPS基因扩增电泳图 Fig. 6 Electrophoretogram of NRPS gene amplication of strains |
|
|
表 3 川楝内生真菌NRPS基因的相似菌株及相似度 Table 3 Similarstrains and similarity of NRPS genes of endophytic fungi from M. toosendan |
得到的6个NRPS基因的相似序列都为Penicillium sp.,因此NRPS的系统发育树省略。
4 讨论研究发现,药用植物具有非常丰富的内生真菌资源。而楝科植物内生真菌的研究主要集中在苦楝M. azedarach L. 和印楝Azadirachta indica A. Juss上,本研究弥补了对川楝内生真菌研究的不足。Geris等[16]从巴西苦楝分离出55株内生真菌,分属于8个属,青霉属和曲霉属是最多的。陈远友等[17]从安徽农大校园等地苦楝分离出了290株,分属于11个属,其中匐柄霉属Stemphylium Wallr.、交链孢属、刺盘孢属Colletotrichum Corda和拟茎点霉属是优势属。邵士成等[18]从云南印楝分离出372株,分属于50个属,分布广泛的是刺盘孢属、交链孢属、鹿角菌属。Verma等[19]从印度印楝中分离出了233株,分属于18个属,拟茎点霉属、枝孢霉属、拟盘多毛孢属Pestalotiopsis Steys. 为优势属。本研究对川楝内生真菌的形态学鉴定和系统发育分析表明,川楝内生真菌分属于25个属,青霉属、曲霉属为优势属,可能植物种类和地理位置对内生真菌的资源多样性、优势种群有很大的影响。其他研究人员对川楝和印楝内生真菌的研究大多采取形态学鉴定的方法,而本研究采取形态学鉴定和分子生物学鉴定相结合的方法,弥补了不产孢菌株鉴定的不足,使川楝内生真菌的资源多样性较为完整,同时也证明了ITS结果的可靠性。但是,由于数据库还不够完善,有的菌株并没有鉴定到种。川楝内生真菌在资源的多样性上为寻找产生生物活性物质的菌株奠定了基础。
研究人员已经从印楝和苦楝的内生真菌中发现了多种生物活性物质。Geris等[20]从苦楝内生真菌青霉属分离得到了有抑菌活性的3个化合物。Campos等[21]从苦楝内生真菌Aspergillus aculeatus Iizuka中首次分离到2个聚酮类化合物。Yang等[22]从苦楝内生真菌Fusarium sp. LN-10发酵产物中分离得到了有较强的海虾致死活性的化合物。本研究从川楝内生真菌中筛选出了12株含PKS 基因的菌株和6株含NRPS基因的菌株,这些菌株隶属于青霉属、曲霉属、葡孢盘菌属、交链孢属、镰孢霉属。本研究从6株青霉属菌株中筛选出了NRPS基因,7株曲霉属菌株中筛选出了PKS基因,表明川楝的内生真菌还是有发掘潜力的,其中青霉属和曲霉属值得深入研究。
| [1] | 国家中医药管理局《中华本草》编委会. 中华本草 [M]. 上海: 上海科学技术出版社, 1998. |
| [2] | 张建楼, 钟秀会. 川楝素的药理作用研究概况 [J]. 上海畜牧兽医通讯, 2007(5): 65-67. |
| [3] | Stierle A, Strobel G, Stierle D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew [J]. Science, 1993, 260(5105): 214-216. |
| [4] | 王 琪, 傅育红, 高锦明, 等. 苦楝内生真菌的初步分离和筛选 [J]. 西北农业学报, 2007, 16(2): 224-227. |
| [5] | 曾绍荣, 邵 华, 张玲琪. 从南方荷叶中分离出一株产鬼臼毒素类似物的内生真菌 [J]. 微生物学杂志, 2004, 24(4): 116-119. |
| [6] | 冯建飞, 周日成, 郭兴庭, 等. 聚酮类化合物及其应用 [J]. 现代农业科技, 2011(3): 24-26. |
| [7] | 王世媛. 非核糖体肽合成酶 (NRPSs) 作用激励与应用的研究进展 [J]. 微生物学报, 2007, 47(4): 734-737. |
| [8] | 王 永, 纪燕玲, 王 晗, 等. 禾本科植物内生真菌研究 13: 禾本科植物内生真菌的分离鉴定及基因组DNA的快速提取 [J]. 南京农业大学学报, 2012, 35(3): 52-56. |
| [9] | 林 筱. 番荔枝内生真菌的分离、鉴定、活性筛选及次级代谢产物的初步研究 [D]. 厦门: 厦门大学, 2008. |
| [10] | 魏希颖, 张黎光, 姚玉秀, 等. 产黄芩苷内生真菌的筛选与鉴定 [J]. 天然产物研究与开发, 2012, 24(6): 819-823. |
| [11] | 魏景超. 真菌鉴定手册 [M]. 上海: 上海科学技术出版社, 1979. |
| [12] | 单淑芳. 苦楝内生真菌生物多样性及其代谢产物生物活性的研究 [D]. 合肥: 安徽农业大学, 2009. |
| [13] | 燕 勇, 李卫平, 高雯洁, 等. rDNA-ITS序列分析在真菌鉴定中的应用 [J]. 中国卫生检验杂志, 2008, 18(10): 1958-1961. |
| [14] | Nicholson T, Rudd B, Dawson M, et al. Design and utility of oligonucleotide gene probes for fungal polyketide synthases [J]. Chem Biol, 2001, 8(2): 157-178. |
| [15] | Slightom J L, Metzger B P, Luu H T, et al. Cloning and molecular characterization of the gene encoding the aureobasidin A biosynthesis complex in Aureobasidium pullulans BP-1938 [J]. Gene, 2009, 431(1/2): 67-79. |
| [16] | Geris dos S, Regina M, Rodrigues-Fo E, et al. Endophytic fungi from Melia azedarach [J]. World J Microbiol Biotechnol, 2003, 19(8): 767-770. |
| [17] | 陈远友, 单淑芳. 苦楝内生真菌的生物多样性研究 [J]. 安徽农学通报, 2009, 15(14): 60-63. |
| [18] | 邵士成, 吴少华, 陈有为, 等. 云南元江印楝植物内生真菌的种类组成 [J]. 生物多样性, 2008, 16(1): 63-67. |
| [19] | Verna V C, Gond S K, Kumar A, et al. The endophytic mycoflora of bark, leaf, and stem Tissues of Azadirachta indica A. Juss (Neem) from Varanasi (India) [J]. Microb Ecol, 2007, 54(1): 119-125. |
| [20] | Geris dos S, Regina M, Rodrigues-Fo E. Meroterpenes from Penicillium sp. found in association with Melia azedarach [J]. Phytochemistry, 2002, 61(8): 907-912. |
| [21] | Campos F R, Barison A, Daolio C, et al. Complete 1H and 13CNMR assignments of aurasperone A and fonsecinone A, two bis-naphthopyrones produced by Aspergillus aculeatus [J]. Magn Reson Chem, 2005, 43(11): 962-965. |
| [22] | Yang S X, Gao J M, Zhang Q, et al. Toxic polyketides produced by Fusarium sp., an endophytic fungus isolated from Melia azedarach [J]. Bioorg Med Chem Lett, 2011, 21(6): 1887-1889. |
 2014, Vol. 45
2014, Vol. 45


