2. 温州医科大学附属第一医院 移植科, 浙江 温州 325000
2. Centre for Transplantation, The First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, China
心血管疾病是慢性肾脏病患者死亡的主要原因,而动脉中膜钙化是终末期肾病患者心血管病变的重要病理基础之一[1,2],因而如何预防血管钙化具有重要的临床意义。最近有研究发现白藜芦醇(3,4,5-三羟基二苯乙烯,resveratrol,Res)可以抑制平滑肌细胞的增殖与凋亡[3],对心血管系统具有长期保护作用,但对人动脉血管平滑肌细胞(human vascular smooth muscle cells,hVSMC)钙化过程的影响尚未见相关报道。本研究观察Res对高钙、高磷条件下hVSMC的成骨样转化作用,并探索其可能的分子机制。
1 材料与方法 1.1 主要试剂Res,质量分数(HPLC)≥98%,批号YY90051,上海博蕴有限公司。高糖DMEM(含葡萄糖4.5 g/L)、胎牛血清,澳洲HyClone;青链霉素、胰酶,美国Gibco;钙离子检测试剂盒(南京建成生物有限公司);抗α-SMA抗体、抗骨桥蛋白(OPN)抗体,美国abcom;抗骨形态蛋白(BMP-2)抗体(美国Abgent);抗GAPDH抗体、辣根过氧化物酶标记二抗,Solarbio;化学发光检测试剂盒(ECL);Trizol(美国,Invitation);逆转录试剂盒和SYBR Green Master Mix(日本,Toyobo公司)。
1.2 原代hVSMC培养无菌条件下取本院妇产科胎儿(男婴,足月)脐带,剥离脐动脉,无菌PBS清洗,剥除外膜,胰酶消化法提取脐动脉平滑肌细胞,用含20%胎牛血清的高糖DMEM培养液培养,置于37 ℃、5% CO2培养箱中,3 d后观察细胞贴壁后换液,待细胞生长至80%融合进行传代,传代后用含10%胎牛血清的DMEM培养液培养。免疫组化α-SMA鉴定细胞。实验用第4~10代细胞。
1.3 实验分组及处理细胞生长至70%~80%融合时更换培养液,用CaCl2、NaH2PO4调节培养液中钙磷浓度,分为以下5组:对照组(磷1.4 mmol/L,钙2.0 mmol/L);高钙高磷阳性对照组(磷3.0 mmol/L,钙2.5 mmol/L);实验组为高钙高磷条件下加入不同浓度(5、10、20 μmol/L)的Res,以换用培养液当天记为第0天,培养12 d,每2~3天换液。
1.4 细胞钙化的检测 1.4.1 茜红素染色法对钙化进行定性检测4%多聚甲醛固定30 min后用2%的茜红素工作液(pH 4.2)在室温下染色15 min,显微镜下观察。
1.4.2 钙的定量检测0.6 mol/L盐酸在37 ℃下脱钙24 h,利用钙和Arsenazo反应生成蓝紫色物质,通过与参考品同时测定其在650 nm处的吸光度(A)值计算各组的含钙量。BCA法检测细胞蛋白的量,用蛋白定量标化检测含钙量。
1.5 实时荧光定量PCR检测相关基因表达收集各组细胞,Trizol法抽取细胞总RNA,反转录成cDNA,进行PCR,反应体系为10 μL,反应条件:95 ℃、3 min;95 ℃、15 s,62 ℃、1 min,重复40个循环。以2-ΔΔCt表示实验组目的基因的表达相对于对照组的变化倍数,以GAPDH作为内参。
1.6 Western blotting检测相关蛋白表达每组蛋白的上样总量约为20 μg,将各组样本加入预制的10% SDS-聚丙烯酰胺凝胶中,电泳分离后,湿转至PVDF膜,5%的脱脂牛奶封闭1.5 h,加一抗,4 ℃条件下孵育过夜,TBST充分洗涤,室温下用含辣根过氧化酶标记二抗的5%脱脂牛奶TBST液孵育1 h,TBST洗涤后ECL发光,用X线拍片记录实验结果。
1.7 免疫荧光以4%多聚甲醛固定细胞爬片,0.5% Triton X-100室温下作用30 min,加入PBS稀释的一抗,4 ℃下孵育过夜,37 ℃复温30 min,PBS洗涤3次后加二抗避光孵育50 min,观察,拍照。
1.8 统计学分析
所有计量资料用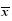 ±s表示,符合正态分布且方差齐性的数据,组间资料比较采用t检验或单因素方差分析(One-way ANOVA)进行统计学分析。采用SPSS 16.0进行统计分析。
±s表示,符合正态分布且方差齐性的数据,组间资料比较采用t检验或单因素方差分析(One-way ANOVA)进行统计学分析。采用SPSS 16.0进行统计分析。
48 h后细胞贴壁,原代培养获得的细胞呈典型的hVSMC形态:细胞长梭形或多边形,胞质丰富,细胞核居中,呈卵圆形,倒置显微镜下观察细胞生长呈典型的“峰谷样”。免疫组化α-SMA染色见细胞胞浆内α-SMA表达丰富,高倍镜下呈细丝状。α-SMA染色阳性率超过95%,纯度符合实验要求。见图 1。
 | 图 1 hVSMC的α-SM鉴定 Fig. 1 α-SMA identification of hVSMC |
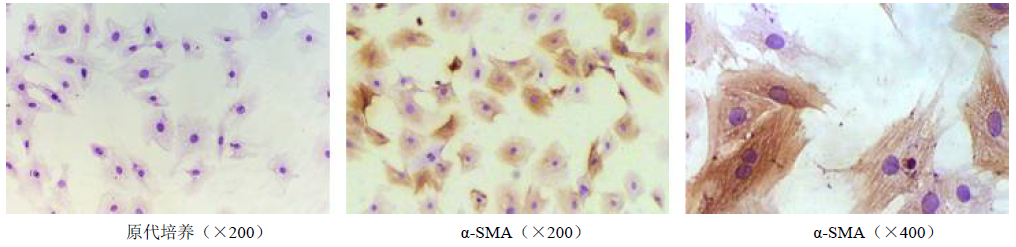
高钙高磷培养液培养细胞12 d后,细胞层可见颗粒样沉积,而对照组细胞间未见沉积,茜红素染色结果显示,对照组未见明显异常物质,高钙高磷组可见橘红样团块形成,见图 2。
 | 图 2 培养hVSMC细胞的茜红素染色 Fig. 2 Alizarin red staining of hVSMCs |
应用钙离子检测试剂盒测细胞含钙量,以蛋白定量标化:与对照组比较,高钙高磷阳性对照组的含钙量明显增加,达5倍(P<0.05),见表 1。
|
|
表 1 hVSMC内钙沉积定量检测 Table 1 Quantification of calcium deposition in hVSMCs |
高钙高磷环境下培养的hVSMC细胞加入不同浓度Res后,细胞仍有不同程度的成骨样转化,但随着Res浓度升高,细胞成骨样转化逐渐减弱,与高钙高磷组比较,细胞含钙量明显降低(P<0.05),见表 1。
2.4 Res下调成骨样转化hVSMC的相关基因表达在正常钙磷浓度的培养基中培养的hVSMC细胞,其成骨样细胞相关基因骨特异性碱性磷酸酶(BAP)、OPN、BMP-2的表达较低,诱导成骨样转化后,BAP、OPN、BMP-2表达显著升高(P<0.01);随着加入Res浓度的升高,成骨样细胞BAP、OPN、BMP-2的表达逐渐下降(P<0.05、0.01),见图 3。
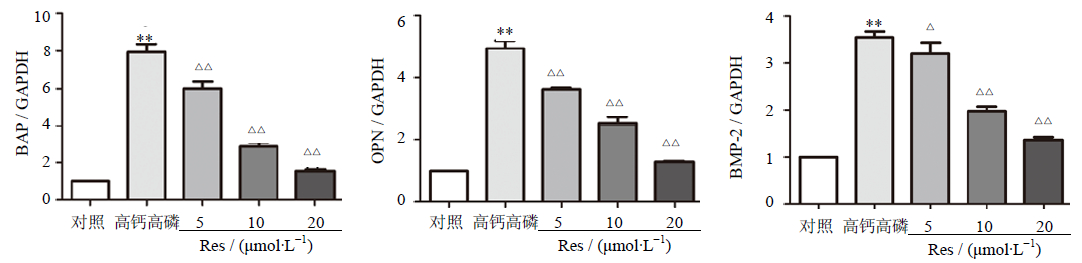 | 与对照组比较:**P<0.01;与高钙高磷组比较:△P<0.05 △△P<0.01,下图同 **P < 0.01 vs control group; △P < 0.05 △△P < 0.01vs positive group,following figures are same图 3 Res对hVSMC细胞中BAP、BMP-2、OPN mRNA表达的影响 Fig. 3 Effects of Res on mRNA expression of BAP,BMP-2,and OPN in hVSMCs |
正常情况下,hVSMC中BMP-2、OPN蛋白表达较低,高钙高磷诱导hVSMC成骨样转化后,BMP-2、OPN蛋白表达水平显著升高(P<0.01),加入Res后,与高钙高磷组比较,BMP-2、OPN蛋白的表达随着Res浓度的升高而降低(P<0.01),见图 4。正常hVSMC中α-SMA蛋白的表达较高,高钙高磷培养12 d后,其表达显著下降(P<0.01),Western blotting印迹实验结果显示,随着Res浓度的升高,α-SMA蛋白的表达呈上升趋势(P<0.05、0.01),见图 5。
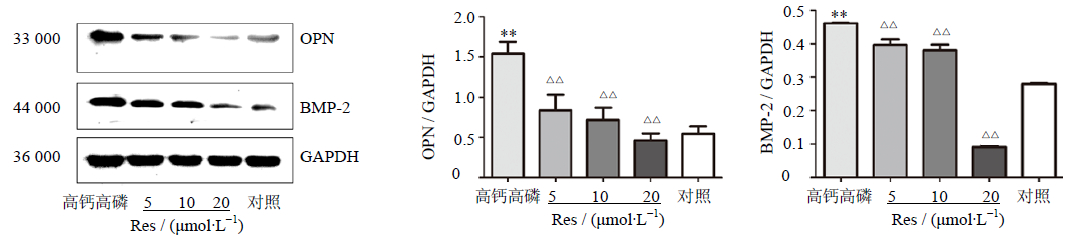 | 图 4 Res对hVSMC细胞中OPN和BMP-2蛋白表达的作用 Fig. 4 Effects of Res on protein expression of BMP-2 and OPN in hVSMCs |
 | 图 5 Res对hVSMC细胞α-SMA蛋白表达的影响 Fig. 5 Effect of Res on protein expression of α-SMA in hVSMCs |
正常情况下,hVSMC中OPN、BMP-2蛋白表达较低,高钙高磷诱导后,OPN、BMP-2蛋白表达明显升高(P<0.05),加入Res后,随Res浓度升高,OPN、BMP-2蛋白表达逐渐下降,见图 6和表 2。
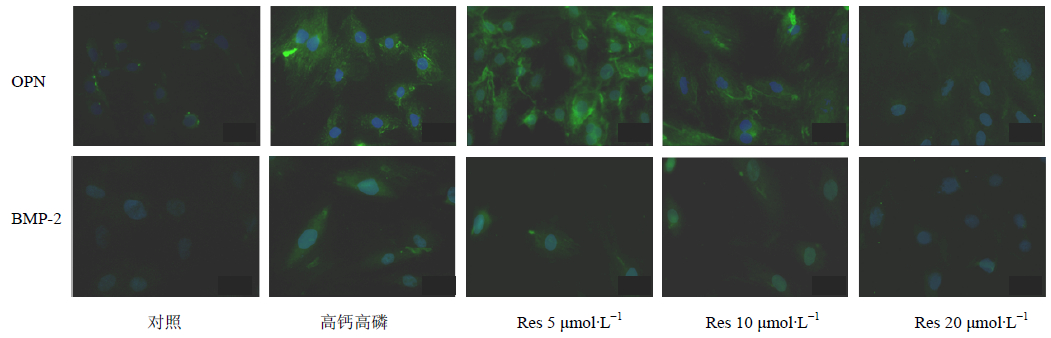 | 图 6 免疫荧光检测OPN和BMP-2的蛋白表达 Fig. 6 Protein expression of OPN and BMP-2 by immunofluorescence |
|
|
表 2 各组OPN、BMP-2平均荧光强度 Table 2 Mean fluorescence intensity of OPN and BMP-2 |
血管钙化是一种异位钙化,在终末期肾病患者中十分常见。尤其是进行维持性血液透析时,终末期肾病患者血管钙化发生早、发展迅速,导致心血管疾病的死亡率明显增加[4]。大量临床研究证明,严重的钙磷代谢异常会引起终末期肾病患者的血管钙化[5,6,7]。相关研究也提出高钙高磷环境引起的动脉平滑肌细胞(VSMC)的凋亡与转分化促进了终末期肾病患者血管的钙化[8]。而心血管疾病是肾功能不全患者最主要的死亡原因,预防或逆转血管钙化对终末期肾病患者将有明显益处。本研究证实白藜芦醇对高钙高磷诱导的hVSMC的成骨样转化有明显的抑制作用,对持续血透的终末期肾病患者有潜在的治疗价值。
前期研究证实慢性肾脏病患者的血管钙化主要与中膜VSMC的变化相关[5,7]。以往实验多采用鼠VSMC或牛VSMC研究血管钙化的防治[6,9],近几年体外实验中采用hVSMC研究钙化过程逐渐增加[10],可以更好地反映人血管钙化的发生机制,为钙化的防治提供依据。因此本实验中,培养胎儿脐动脉平滑肌细胞作为观察对象,通过形态学和特异性标记蛋白α-SMA免疫化学鉴定,研究hVSMC在中膜钙化中的变化。肾功能衰竭的患者中,高钙高磷血症是一种重要的并发症,在异位钙化中起着重要的作用。高磷主要促进VSMC的成骨样转变,而高钙是促进VSMC的凋亡和基质囊泡的形成[11]。早在2004年,Yang等[12]证实高钙、高磷可刺激VSMC形成钙盐沉积,近几年也有研究证明[13,14],高磷高钙环境下VSMC发生转分化,导致钙盐沉积。本研究中,建立高钙高磷环境(钙2.5 mmol/L、磷3.0 mmol/L)显示与其他研究者的结果一致:高钙高磷对hVSMC诱导12 d后,形成明显的钙盐沉积,茜素红染色可见细胞团块处有橘红色的钙盐沉积形成。
近几年对高钙高磷诱导血管钙化的机制研究较多,很多研究显示血管钙化本质上是与骨形成相似的高度可调控的过程[15]。成骨样转化相关因子如BAP、OPN、BMP-2等被证明是参与血管钙化的关键分子,并可用于表型鉴定。BAP为骨特异性碱性磷酸酶,在VSMC的成骨样变中表达最早,反映VSMC的变化。BMP-2和OPN均属于非胶原骨基质蛋白。OPN是一种分泌性糖基化磷酸蛋白,在骨、软骨等组织中广泛表达,参与调节骨的矿化过程。BMP-2属于转化生长因子(transforming growth factor,TGF)家族,其作用是启动骨形成,在动脉硬化斑块和中膜钙化的血管中高表达,还可能与基质Gla蛋白(MGP)等其他钙化抑制因子的失活物结合形成促进血管钙化的复合物加速血管的钙化。α-SMA则是血管平滑肌细胞的特异性标记蛋白,由激素和细胞增殖所调节,细胞的转化以及动脉粥样硬化等条件会改变VSMC中α-SMA的表达。Moe等[16]报道中指出以血透患者血清为高磷水平,其培养的VSMC中的BMP-2表达升高。王宁宁等[17]的研究中也提出体外高钙高磷会引起VSMC的转分化,相关因子表达升高。本研究结果证实,高钙高磷可诱导VSMC的转分化,高钙高磷组OPN、BMP-2、BAP的表达显著高于对照组。
Res是一种多酚类物质,存在于多种植物中,目前为止未发现有毒副作用。Res具有多种药理作用,如抗炎、抗凋亡、抗增殖、抗氧化及雌激素样效应,还具有较好的抗肿瘤作用[18,19]。Res可抑制VSMC的增生,高浓度的Res则会导致激活的VSMC凋亡。Bruedigam等[20]研究证明Res对罗格列酮导致的VSMC的钙化有抑制作用。Ichiki等[3]证实Res是一种ET-1拮抗剂,可抑制Ang II导致的VSMC的凋亡与增生,但对于Res在高钙、高磷诱导的VSMC转分化中的作用,目前研究较少。本研究以高钙高磷诱导的hVSMC成骨样变为基础,加入不同浓度的Res,观察Res在hVSMC成骨样变过程中的作用。研究结果显示:加入不同浓度的Res后,随着Res浓度的增高,钙盐沉积逐渐减少,成骨样转化相关基因BAP、OPN、BMP-2的mRNA表达逐渐下调。Western blotting印迹亦证实,随着Res浓度的增高,OPN、BMP-2的表达逐渐下降,而VSMC的特异性标记α-SMA的表达逐渐增高。这些结果表明Res在高钙高磷诱导的VSMC钙化过程中有抑制作用,Res浓度越高,其抑制作用越强。这为以后探索Res对血管的保护作用提供依据,具有一定的临床意义。
总之,高钙高磷对hVSMC有主动调节骨转化的作用,成骨样细胞相关蛋白的产生,VSMC中α-SMA的丢失及钙盐的沉积导致血管的钙化。而Res对此过程中起抑制作用,减轻了hVSMC的钙化,对终末期肾病患者的血管保护具有潜在的重大意义。但Res抑制高钙、高磷诱导的VSMC的钙化的具体分子机制仍不清楚,需要进一步的研究与深入探讨。
| [1] | Wang N, Yang J, Yu X, et al. Radial artery calcification in end-stage renal disease patients is associated with deposition of osteopontin and diminished expression of alpha-smooth muscle actin [J]. Nephrology, 2008, 13(5): 367-375. |
| [2] | Raggi P, Kleerekoper M. Contribution of bone and mineral abnormalities to cardiovascular disease in patients with chronic kidney disease [J]. Clin J Americ Soc Nephrol: CJASN, 2008, 3(3): 836-843. |
| [3] | Ichiki T, Miyazaki R, Kamiharaguchi A, et al. Resveratrol attenuates angiotensin II-induced senescence of vascular smooth muscle cells [J]. Regulat Pept, 2012, 177(1/3): 35-39. |
| [4] | Bellasi A, Kooienga L, Block G A, et al. How long is the warranty period for nil or low coronary artery calcium in patients new to hemodialysis? [J]. J Nephrol, 2009, 22(2): 255-262. |
| [5] | Shroff R C, McNair R, Figg N, et al. Dialysis accelerates medial vascular calcification in part by triggering smooth muscle cell apoptosis [J]. Circulation, 2008, 118(17): 1748-1757. |
| [6] | Alam M U, Kirton J P, Wilkinson F L, et al. Calcification is associated with loss of functional calcium-sensing receptor in vascular smooth muscle cells [J]. Cardiovascul Res, 2009, 81(2): 260-268. |
| [7] | Ahmed S, O'Neill K D, Hood A F, et al. Calciphylaxis is associated with hyperphosphatemia and increased osteopontin expression by vascular smooth muscle cells [J]. Am J Kidney Dis, 2001, 37(6): 1267-1276. |
| [8] | Shanahan C M, Crouthamel M H, Kapustin A, et al. Arterial calcification in chronic kidney disease: key roles for calcium and phosphate [J]. Circ Res, 2011, 109(6): 697-711. |
| [9] | Ding H T, Wang C G, Zhang T L, et al. Fibronectin enhances in vitro vascular calcification by promoting osteoblastic differentiation of vascular smooth muscle cells via ERK pathway [J]. J Cell Biochem, 2006, 99(5): 1343-1352. |
| [10] | Zavaczki E, Jeney V, Agarwal A, et al. Hydrogen sulfide inhibits the calcification and osteoblastic differentiation of vascular smooth muscle cells [J]. Kidney Internat, 2011, 80(7): 731-739. |
| [11] | Sekiguchi S, Suzuki A, Asano S, et al. Phosphate overload induces podocyte injury via type III Na-dependent phosphate transporter [J]. Am J Physiol Renal Physiol, 2011, 300(4): 848-856. |
| [12] | Yang H, Curinga G, Giachelli C M. Elevated extracellular calcium levels induce smooth muscle cell matrix mineralization in vitro [J]. Kidney Internat, 2004, 66(6): 2293-2299. |
| [13] | Suzuki A, Ammann P, Nishiwaki-Yasuda K, et al. Effects of transgenic Pit-1 overexpression on calcium phosphate and bone metabolism [J]. J Bone Miner Metab, 2010, 28(2): 139-148. |
| [14] | Hu M C, Shi M, Zhang J, et al. Klotho: a novel phosphaturic substance acting as an autocrine enzyme in the renal proximal tubule [J]. FASEB, 2010, 24(9): 3438-3450. |
| [15] | Shroff R C, Shanahan C M. The vascular biology of calcification [J]. Semin Dialysis, 2007, 20(2): 103-109. |
| [16] | Moe S M, Chen N X. Pathophysiology of vascular calcification in chronic kidney disease [J]. Circulat Res, 2004, 95(6): 560-567. |
| [17] | 王宁宁, 王笑云, 杨俊伟, 等. 体外高磷环境下血管平滑肌细胞转分化过程的研究[J]. 中华肾脏病杂志, 2009, 25(2): 116-121. |
| [18] | 张秀娟, 包钰涵, 贾绍华, 等. 白藜芦醇对人胃癌SGC-7901细胞形态、线粒体膜电位、活性氧及钙离子浓度的影响 [J]. 药物评价研究, 2012, 35(3): 161-164. |
| [19] | 陈 玲, 陈复兴, 刘军权, 等. 白藜芦醇对人γδT细胞生长和杀伤功能的影响 [J]. 中草药, 2011, 42(10): 2056-2059. |
| [20] | Bruedigam C, Eijken M, Koedam M, et al. Opposing actions of rosiglitazone and resveratrol on mineralization in human vascular smooth muscle cells [J]. J Molecul Cell Cardiol, 2011, 51(5): 862-871. |
 2014, Vol. 45
2014, Vol. 45


