2. 宁波天衡药业股份有限公司, 浙江 宁波 315201
2. Ningbo Team Pharmaceutical Co., Ltd., Ningbo 315201, China
白桦脂酸(betulinic acid,BA)是从白桦树皮、蒲桃树叶、夏枯草、滇刺枣仁等药用植物分离得到的五环三萜类化合物[1,2],具有抗肿瘤、抗HIV、抗疟、抗炎等多种生物学活性,尤其是对黑色素瘤细胞(Mel-1、Mel-2和Mel-4)具有专一的细胞毒性,不损伤正常细胞[3,4],作为一种潜在的治疗黑色素瘤药物极具开发前景。然而,BA不溶于水以及相对较大的相对分子质量(MW 456.71)限制了其经皮给药[5]。而纳米粒、脂质体、纳米乳等纳米给药系统可增加药物透皮速率,延长停留时间。其中醇质体(ethosomes)是一种新型的含有一定量小分子醇且具有囊泡结构的纳米给药载体,主要用于经皮给药,具有流动性及变形性强、包封率高、稳定性好、刺激性小等优点[6,7,8]。通过柔性强的醇质体膜结构,携带药物直接穿透角质层,同时醇质体上的磷脂也可与角质层上的脂质发生融合,促进药物穿透角质层。Niu等[9]的研究表明脂质体中加入胆酸盐可增加脂质体的柔性,更有利于纳米粒穿透生物膜。因此,本研究以BA为模型药物,处方中加入去氧胆酸钠(sodium deoxycholate,SDC)制成一种SDC修饰醇质体,并通过正交设计优化得到SDC修饰醇质体处方,再进行了BA-SDC修饰醇质体与BA脂质体及普通醇质体的体外经皮渗透性比较,为BA经皮给药系统的研究及产品开发提供新思路。
1 材料和仪器BA(质量分数≥98%,西安小草植物科技有限责任公司);大豆卵磷脂(上海太伟药业有限公司);葡聚糖凝胶(Sephadex G-50,北京瑞达恒辉科技发展有限公司);SDC(上海研生生化试剂有限公司);异丙醇(国药集团化学试剂有限公司);甲醇和乙腈为色谱纯;其他试剂均为分析纯。
Agilent 1200高效液相色谱仪(美国Agilent公司);HJ—3数显恒温磁力搅拌器(常州国华电器有限公司);JY92—2D超声波细胞粉碎仪(宁波新芝生物科技股份有限公司);JEM—2100透射电镜(日本电子公司);RYJ—6B型Franz扩散池(上海黄海药检仪器厂,有效扩散面积2.8 cm2,接收池体积6.5 mL);Zetasizer Nano—ZS90型马尔文激光散射粒径测定仪(英国马尔文公司)。
实验动物为昆明种小鼠,雄性,体质量18~22 g,购自浙江省医学科学院,许可证号SCXK(浙)2008-0033。
2 方法和结果 2.1 BA-SDC修饰醇质体的制备采用乙醇注入法制备:称取BA 20 mg、SDC 20 mg和大豆卵磷脂360 mg,加入6 mL乙醇使之完全溶解。持续搅拌下,密闭环境中以缓缓细流注入14 mL pH 7.4的磷酸盐缓冲液,继续搅拌10 min,然后在冰水浴条件下探头超声(200 W,工作10 s,间歇5 s)30次,将得到的样品冷藏、备用,即得BA-SDC修饰醇质体。
2.2 BA脂质体及普通醇质体的制备BA脂质体及普通醇质体均采用乙醇注入法制备,称取BA 20 mg和大豆卵磷脂380 mg,分别加入处方量乙醇使之完全溶解。持续搅拌下,密闭环境中以缓缓细流注入适量的pH 7.4磷酸盐缓冲液,使总体积达到20 mL。注完后继续搅拌,脂质体需将乙醇挥尽,普通醇质体则搅拌10 min即可。然后在冰水浴条件下探头超声(200 W,工作10 s,间歇5 s)30次,将得到的样品冷藏、备用,即分别制得BA脂质体及普通醇质体。
2.3 包封率的测定 2.3.1 色谱条件[10]色谱柱为Hedera ODS-2 C18柱(250 mm×4.6 mm,5 μm);柱温为40 ℃;检测波长为207 nm;流动相为乙腈-3%醋酸溶液(70∶30);体积流量为1.0 mL/min;进样量为10 μL。
2.3.2 方法学考察精密称取干燥至恒定质量的BA对照品适量至100 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得质量浓度为126.00 μg/mL BA储备液。分别精密量取储备液2、5、10、20、50 mL至100 mL量瓶中,加甲醇稀释至刻度,摇匀。按“2.3.1”色谱条件进样,记录峰面积。以BA质量浓度为横坐标(X),峰面积积分值为纵坐标(Y),绘制标准曲线,计算回归方程Y=67.832 X+8.952 7(n=3),r=0.999 6,线性范围为2.52~63.00 μg/mL。日间精密度和日内精密度的RSD值分别为1.79%和1.30%,低、中、高质量浓度(30.24、37.80、45.36 μg/mL)样品溶液回收率平均分别为100.9%、99.1%、102.3%,RSD分别为1.87%、1.92%、1.75%。
2.3.3 包封率测定采用葡聚糖凝胶柱分离法[11]测定包封率。取制备所得醇质体或脂质体混悬液0.5 mL,从已制备好的Sephadex G-50微柱凝胶顶端加入,转速为3 000 r/min条件下离心6 min,用1 mL水洗脱2次,合并滤液,用甲醇定容至50 mL,过0.22 μm微孔滤膜滤过,HPLC检测,计算得到包封药物的量(W包)。取醇质体或脂质体混悬液0.5 mL,不经微柱离心,直接用甲醇稀释至相同倍数,用0.22 μm微孔滤膜滤过,HPLC检测,计算得醇(脂)质体中药物的总质量(W总),计算包封率(包封率=W包 / W总),结果见表 1。
|
|
表 1 包封率、粒径及多分散指数测定结果 (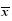 ±s,n=3)
Table 1 Determination of polydispersity index of EE and particle size ( ±s,n=3)
Table 1 Determination of polydispersity index of EE and particle size (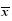 ±s,n=3) ±s,n=3)
|
取与醇质体质量浓度相同的BA溶液0.5 mL,按上述方法过Sephadex G-50微柱凝胶,收集滤液,用甲醇定容至50 mL,过0.22 μm微孔滤膜滤过,HPLC检测,记录峰面积为A后。取BA溶液0.5 mL,不经微柱离心,直接用甲醇稀释至相同倍数,用0.22 μm微孔滤膜滤过,HPLC检测,记录峰面积为A前,计算微柱对游离BA的吸附率[(A前-A后) / A前],结果为99.6%,表明微柱对游离BA的吸附性能良好。最终测得BA脂质体、普通醇质体及SDC修饰醇质体的包封率平均值分别为为83.6%、87.2%和92.7%。SDC修饰醇质体与脂质体、普通醇质体比较,包封率均显著增加(P<0.01)。
2.4 粒径及多分散指数测定取BA脂质体或醇质体适量,采用马尔文激光散射粒径测定仪测定其平均粒径及多分散指数,结果见表 1。BA脂质体、普通醇质体和SDC修饰醇质体的平均粒径分别为182.4、157.5、105.2 nm。BA-SDC修饰醇质体与脂质体相比,其平均粒径显著性减小(P<0.01),说明醇质体处方中加入SDC,制得的粒径为最小,且包封率提高。
2.5 单因素试验通过对磷酸盐缓冲液pH值(X1)、大豆卵磷脂和BA的质量比(X2)、BA和SDC的质量比(X3)、乙醇体积分数(X4)、搅拌时间(X5)5个单因素进行筛选,分别考察其对醇质体包封率的影响,结果见表 2。结果可知磷酸盐缓冲液pH值和搅拌时间对包封率的影响较小,同时确定磷酸盐缓冲液pH值为7.4,搅拌时间为10 min。利用正交试验设计优化对包封率影响较大的其余3个因素。
|
|
表 2 不同因素对包封率影响的试验结果 Table 2 Effects of different factors on EE |
经过单因素考察,选择对SDC修饰醇质体制备影响较大因素:大豆卵磷脂和BA的质量比(A)、BA和SDC的质量比(B)、乙醇体积分数(C)为优化指标,包封率为考察指标,各因素取3水平,采用L9(34) 正交表进行试验,对醇质体处方进行优化。因素水平及实验结果见表 3,方差分析结果见表 4。
|
|
表 3 L9(34) 正交试验设计与结果 Table 3 Design and results of L9(34) orthogonal test |
|
|
表 4 方差分析 Table 4 Analysis of variance |
根据表 4方差分析结果可知,各因素对醇质体包封率影响大小依次为A>B>C,其中因素A具有极显著影响(P<0.01),因素B、C具有显著影响(P<0.05);初步确定最佳处方工艺组合为A2B2C2,即大豆卵磷脂与BA的质量比为18∶1,BA与SDC质量比1∶1,乙醇体积分数为35%。按优化后处方制备3批BA-SDC修饰醇质体,测定其平均粒径和包封率,结果见表 5。优化处方后制备的BA-SDC修饰醇质体平均粒径为(102.3±3.6)nm,包封率为(93.8±1.6)%。结果表明,该处方与工艺稳定性可控,重现性好。
|
|
表 5 验证结果 Table 5 Results of verification |
吸取优化处方后制备的醇质体混悬液少许滴于有支持膜的铜网上,滤纸吸取铜网边缘多余液体,待稍干后,以透射电镜观察其形态,结果见图 1。由图 1可知,BA-SDC修饰醇质体外观呈类球形,粒子大小比较均一。
 | 图 1 BA-SDC修饰醇质体电镜照片 Fig. 1 Electron micrograph of ethosomes modified by BA-SDC |
取体质量合格的健康昆明种小鼠,颈椎脱臼法处死,腹部剪毛。剪下腹部皮肤,小心去除皮肤上的短毛、皮下组织和筋膜,放大镜观察确保皮肤角质层的完整性。用生理盐水漂洗干净后备用。将皮肤夹于双室扩散池中,角质层面向供给池,真皮层面向接收液;分别取1 mL BA-SDC修饰醇质体、BA普通醇质体、BA脂质体以及BA 10%异丙醇饱和溶液(含药物BA量均为1 mg)加入供给池,接触皮肤角质层。以10%异丙醇水溶液作为接收介质,37 ℃水浴保温,并以400 r/min速度搅拌;分别于1、2、3、4、6、8、10、12 h定时取样1 mL(同时补充37 ℃保温的等量空白接收液)。接收液经蒸干,用甲醇定容至1 mL经0.22 μm微孔滤膜滤过,按“2.3.1”项色谱条件进样检测并计算质量浓度,计算累计渗透量(Qn),结果见图 2。
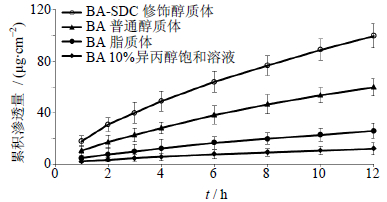 | 图 2 BA在不同载体中的累积渗透量曲线 (n= 3) Fig. 2 Accumulated permeation amount curves of BA from different carriers (n = 3) |
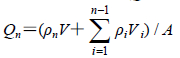
ρn为不同取样点时的接收液中BA质量浓度(μg/mL),ρi为各取样点时取样液中BA质量浓度(μg/mL),V为接收池体积(mL),Vi为每次取样体积(mL),A为有效扩散面积(cm2)
结果显示,BA在不同载体中12 h累计渗透量由大到小的顺序依次为BA-SDC修饰醇质体>BA普通醇质体>BA脂质体>BA 10%异丙醇饱和溶液。其中BA-SDC修饰醇质体12 h的累积渗透量为(99.62±9.44)μg/cm2,分别是BA普通醇质体、BA脂质体和BA 10%异丙醇饱和溶液的1.67、3.85和8.33倍,且差异具有统计学意义(P<0.01)。
2.9 稳定性考察取适量BA-SDC修饰醇质体密封于锥形瓶中,分别置于4、25 ℃条件下保存,分别于0、1、2、3个月测定样品的包封率。结果4 ℃时的包封率分别为91.9%、91.2%、90.6%、90.1%,25 ℃时的包封率分别为91.9%、90.7%、90.3%、89.6%。可知BA-SDC修饰醇质体稳定性良好。
3 讨论本研究结果表明,与脂质体和普通醇质体相比,BA-SDC修饰醇质体具有较小的粒径范围和较高的包封率。进一步进行正交试验优化SDC修饰醇质体的处方,发现乙醇体积分数过低将不利于对药物的包封,乙醇体积分数增加,包封率也随之提高。但当乙醇体积分数超过35%时,包封率反而降低,可能有部分磷脂溶解。
体外透皮实验中,由于BA不溶于水,必须选择合适的接收液才能满足实验要求的漏槽状态,考虑到介质对皮肤的影响以及能更好的模拟药物在体内的渗透条件,通过预试验选择10%异丙醇溶液作为接受介质。
醇质体与脂质体相比,由于乙醇的加入使得双分子层膜具有良好的柔韧性和流动性,在经皮传递过程中易于变形,因而更容易穿过皮肤屏障进入皮肤深部甚至体循环,促进药物的经皮转运[13]。本研究发现BA在醇质体系统12 h累计渗透量高于其脂质体,能显著增强药物透皮效率,这与醇本身促透作用有关,也与醇的加入形成的醇质体的粒径更小,膜流动性更强等因素。且BA在SDC修饰醇质体系统中累积渗透量、渗透速率明显高于普通醇质体,原因可能有以下2个方面:由于SDC的存在使得所制备的醇质体粒径较小,而且均匀;SDC为透皮吸收促进剂,在柔性脂质体中应用,可以增加脂质体的变形能力,在醇质体中应用,也可增强醇质体的变性能力,有利于提高BA的透皮速率。
| [1] | 陈 子, 吴秋玲, 陈 燕, 等. 白桦脂酸对人Raji淋巴瘤细胞增殖、凋亡及细胞周期的影响 [J]. 中草药, 2008, 39(4): 556-559. |
| [2] | 陈秀玮, 王丹云, 刘 佳, 等. 白桦脂酸对人宫颈癌裸鼠移植瘤的抑制作用及机制 [J]. 临床肿瘤学杂志, 2012, 17(5): 412-416. |
| [3] | Sawada N, Kataoka K, Kondo K, et al. Betulinic acid augments the inhibitory effects of vincristine on growth and lung metastasis of B16F10 melanoma cells in mice |
| [4] | 徐 军, 王晋萍, 钱辰旭, 等. 白桦脂酸的研究进展 [J]. 生命科学, 2011, 23(5): 503-510. |
| [5] | 赖 玲. 白桦脂酸的提取与胶囊剂的制备 [D]. 武汉: 华中科技大学, 2006. |
| [6] | 姜素芳, 胡姣艳, 何丽华. 盐酸青藤碱醇质体的制备及其体外经皮渗透研究 [J]. 中草药, 2012, 43(9): 1738-1741. |
| [7] | 沈丹丹, 张 涛, 黄 华. 盐酸奥昔布宁醇脂质体的制备及体外透皮吸收研究 [J]. 中国药科大学学报, 2011, 42(1): 48-52. |
| [8] | 于燕燕, 赵继会, 冯年平, 等. 鬼臼毒素醇质体的体外经皮渗透特性研究 [J]. 中草药, 2012, 43(1): 74-77. |
| [9] | Niu M, Lu Y, Hovgaard L, et al. Liposomes containing glycocholate as potential oral insulin delivery systems: preparation, in vitro characterization, and improved protection against enzymatic degradation [J]. Int J Nanomed, 2011, 6: 1155-1166. |
| [10] | 赖 玲, 杨 昕, 杨 光, 等. 正交试验法优选酸枣仁中白桦脂酸的提取工艺 [J]. 中草药, 2006, 37(4): 532-534. |
| [11] | 刘利萍, 毛 威, 安原初. 克霉唑醇质体和脂质体的体外经皮渗透性及抗菌性的对比研究 [J]. 中国药学杂志, 2009, 44(4): 278-282. |
| [12] | 闫沁远, 李凌云. 尼美舒利醇质体的体外经皮渗透特性及皮肤刺激性 [J]. 中国医院药学杂志, 2011, 31(21): 1780-1783. |
| [13] | 李 翀, 邓 丽, 张 焱, 等. 表面修饰二氧化硅的含醇脂质体促进姜黄素口服吸收 [J]. 药学学报, 2012, 47(11): 1541-1547. |
 2014, Vol. 45
2014, Vol. 45



