2. 陕西省肿瘤医院 药剂科, 陕西 西安 710061
2. Department of Pharmacy, Shaanxi Provincial Cancer Hospital, Xi'an 710061, China
铁是人体必需的微量元素之一,参与血红蛋白的合成、细胞呼吸、电子传递、DNA合成并参与酶活性反应。缺铁使酶活性降低,细胞功能紊乱,体力减弱,容易疲劳,还可引起组织器官异常,细胞免疫功能缺陷,对感染的易感性增高。但是,铁过载也会引起诸多疾病[1,2,3,4,5]。在机体内铁的吸收、摄取、利用和存储都受到一定的调控,但是由于机体排铁能力相对不足,所以如果外源性铁摄入过多,如食用大量含铁的食物,吸入大量含铁的颗粒,注射大量含铁的蔗糖酸盐以及多次反复的输入全血或红细胞等都会引起机体铁过载[6]。血液中铁超出转铁蛋白结合能力时,可产生未被转铁蛋白结合的游离铁离子(Fe3+)其沉积于组织中便形成铁过载。大量研究结果表明阿尔茨海默病(早老性痴呆)、帕金森综合症和骨质疏松症(osteoporosis,OP)等的发病机制都与机体内铁过载有直接关系[7,8,9]。研究表明异常金属元素在脑内的沉积直接参与了阿尔茨海默病和帕金森综合症的发病过程,并且在动物模型上证明,以异常Fe3+为靶点的药物可以有效预防这类疾病[10]。临床驱铁药物铁螯合剂可与Fe3+形成络合物而促进Fe3+排泄,降低体内Fe3+水平及其在各个器官组织中的病理性沉积,因而可能具有防治铁过载OP的潜在作用[11,12,13]。
中药治疗阿尔茨海默病、帕金森综合症和OP有很好的临床效果,但是以现代科学却难以解释其治疗机制和物质基础,所以难以规范化并影响其推广应用。从铁过载的角度考虑,可能是中药中存在多种能与Fe3+形成络合物的有机成分,这些成分进入体内与Fe3+形成络合物而使过载铁排出体外。为了验证这种推测,本实验建立了体外筛选分析的方法来确定临床所用中药中哪种中药以及哪些成分是与Fe3+络合的主要成分,并评估其络合强度。
体内沉积的铁仍然会解离出少量游离Fe3+,如果中药中的成分能与Fe3+形成更稳定的络合物,则由于新络合物的形成而消耗了Fe3+,而沉积的铁就会解离来补充被消耗的Fe3+。如此,随着与Fe3+络合的中药成分的不断进入,沉积的铁会不断溶解,形成络合物后排出体外。以L表示能够与Fe3+形成络合物的中药中的配体成分,FeL表示新生成的络合物,FeC表示铁沉积物,C表示沉积铁的配体(除Fe3+外其他络合物、沉积物的电荷均略去),则有下列平衡存在:

由于体内游离Fe3+浓度无法测知,中药中能够与Fe3+形成络合物的配体成分L有待筛选,那么体内研究是无法进行的。如果能够建立测定游离Fe3+浓度的方法,则可进行体外筛选。虽然能够与Fe3+络合的中药成分未知,浓度也未知,但如果在一定量的中药中加入一定量的Fe3+,当测知加入的游离Fe3+浓度变小时,说明所加中药中含有与Fe3+络合作用强的成分存在,这样就可以筛选出对Fe3+络合作用强的中药。然后再对所选中药进行分离、筛选、追踪,最后就可能找到对Fe3+络合作用强的成分,此类成分很可能就是中药驱除体内过量铁的活性成分,也可能就是中药治疗阿尔茨海默病、帕金森综合症和OP等与铁过载有关疾病的物质基础。所有这些研究的起点和关键是要建立测定中药煎液中游离Fe3+的灵敏方法。
本实验基于查阅文献基础,选择临床报道治疗阿尔茨海默病、帕金森综合症及OP的常用中药(主要为补肾中药),如续断、锁阳、补骨脂等。同时选择未见临床报道治疗以上3类疾病的中药作为对比,如桔梗、绞股蓝等。
利用游离态Fe3+对无色罗丹明B螺环酰肼衍生物(FD1)的催化开环作用,使无色的试剂开环后显示出罗丹明B的颜色[14]。该颜色的吸光度与游离Fe3+浓度成比例,以此来测定游离态Fe3+的浓度,并进一步评估中药煎液对Fe3+的络合强度。反应式见图 1。
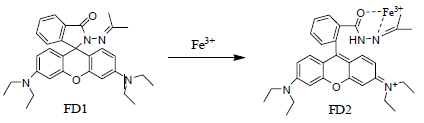 | 图 1 FD1与Fe3+络合原理 Fig. 1 Principle of FD1 complexing with Fe3+ |
岛津UV2550紫外分光光度计(深圳市赛亚泰科仪器设备有限公司)。
药材购买于同仁堂西安分店,经西安市药检所谢志民研究员鉴定,均为正品药材(符合《中国药典》2010年版规定)。续断Dipsacusasper Wall. ex Henry,产地四川攀枝花;锁阳Cynomorium songaricum Rupr,产地甘肃酒泉;巴戟天Morinda officinalis How,产地广东肇庆;沙苑子Astragalus complanatus R. Br.,产地陕西渭南;葫芦巴Trigonella foenum-graecum L.,产地河南郑州;骨碎补Drynaria fortunei (Kunze) J. Sm.,产地四川西昌;仙茅Curculigo orchioides Gaertn.,产地四川宜宾;狗脊Cibotium barometz (L.) J. Sm.,产地广西南宁;菟丝子Cuscuta chinensis Lam.,产地河南洛阳;地榆Sanguisorba officinalis L.,产地河南郑州;黄柏Phellodendron chinense Schneid.,产地四川都江堰;远志Polygala tenuifolia Willd.,产地陕西渭南;绞股蓝Gynostemma pentaphyllum (Thunb.) Makino,产地陕西安康;拳参Polygonum bistorta L.,产地山西陵川;川贝母Fritillaria cirrhosa D. Don,产地四川绵阳;玉竹Polygonatum odoratum (Mill.) Druce,产地河南郑州;桂枝Cinnamomum cassia Presl,产地广东肇庆;钩藤Uncaria rhynchophylla (Miq.) Miq. ex Havil.,产地四川绵阳;泽泻Alisma orientale (Sam.) Juzep.,四川彭山;桔梗Platycodon grandiflorus (Jacq.) A. DC.,产地安徽亳州。蒸馏水洗净,80 ℃烘干6 h备用。
所用试剂均为分析纯,水为二次蒸馏水。
2 方法与结果 2.1 试剂的合成按照文献方法[15]合成试剂FD1,精密称取罗丹明B 3.0 g至500 mL圆底烧瓶中,以甲醇作溶剂加入过量水合肼,回流3 h,冷却待析出固体后抽滤,并用水洗3次,固体经干燥既得罗丹明B酰肼。精密称取罗丹明B酰肼1 g,与丙酮搅拌反应6 h,经减压蒸馏回收丙酮,即析出白色粉末,得终产物FD1,产率40%,熔点为215~217 ℃,质量分数为98%。核磁及质谱数据为1H-NMR (400 MHz,CD3OD) δ: 7.87 (d,J = 6.4 Hz,1H),7.56 (s,2H),7.11 (d,J = 6.2 Hz,1H),6.45 (s,1H),6.43 (s,1H),6.38 (d,J = 2.4 Hz,2H),6.35 (d,J = 2.5 Hz,1H),6.33 (d,J = 2.5 Hz,1H),3.37 (d,J = 7.0 Hz,8H),1.95 (s,3H),1.75 (s,3H),1.16 (d,J = 7.0 Hz,12H)。MS (EI): m/z 496.5 (M+),C31H36N4O2元素分析:计算值:C 74.97%、H 7.31%、N 11.28%;实测值:C 74.84%、H 7.17%、N 11.32%。
2.2 各药材水煎液的制备准确称取各药材10.000 g,加水150 mL浸泡60 min,然后用大火煮沸,后改用文火保持微沸30 min,再用4层纱布滤过,滤液保留,滤渣分别加水100、100 mL,重复以上操作方法再煎煮2次各20 min,合并3次滤液静置冷却,待次日高速离心20 min,取上清液定容至100 mL再稀释10倍,相当于生药0.01 g/mL待测[14]。
2.3 标准溶液的制备精确称取分析纯无水三氯化铁162.2 mg(1 mmol),用水定容至1 L量瓶中,配置成1 mmol/L的Fe3+标准储备溶液,备用。将已配制好的Fe3+标准储备溶液分别稀释至0.8、0.6、0.4、0.2、0.08、0.06、0.04、0.02 mmol/L。
2.4 FD1试剂配制精密称取FD1试剂40.0 mg,用无水乙醇定容至100 mL量瓶中,配置成0.81 mmol/L的溶液,备用。
2.5 吸收波长考察精密吸取0.1 mmol/L标准Fe3+溶液2 mL,以及FD1(0.81 mmol/L)试剂溶液2 mL于5 mL量瓶内,用20 mmol/L,pH 7的4-羟乙基哌嗪乙磺酸缓冲溶液(hepes缓冲液)定容至刻度,摇匀,利用紫外-可见分光光度计进行波长扫描。经测试FD1-Fe3+络合物显色后,全波长扫描得最大吸收波长为563 nm,见图 2。
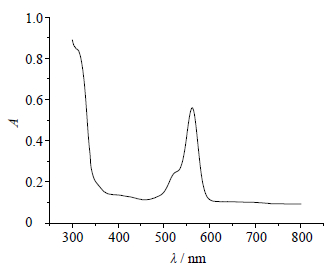 | 图 2 Fe3+-FD1络合物紫外可见吸收光谱 Fig. 2 UV-Vis spectrum of Fe3+-FD1 complex |
精密吸取水溶液2mL,以及FD1(0.81 mmol/L)试剂溶液2 mL于5 mL量瓶内,以pH 3.6~8.5 hepes缓冲液分别定容至刻度,并混合均匀。测定各样品在563 nm处吸光度(A)值。经测定FD1在pH 3.6~8.5 hepes缓冲液中A值,发现最适pH值为6.5~7.5,见图 3。
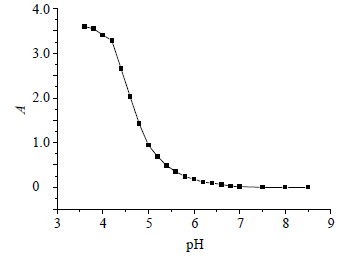 | 图 3 pH值对FD1吸收的影响 Fig. 3 Effect of pH values on FD1 absorption |
准确移取各浓度Fe3+标准溶液各2 mL于5 mL量瓶中,加入FD1(0.81 mmol/L)试剂溶液2 mL,用hepes缓冲液定容至刻度,摇匀,显色,于特定波长处测A值,以Fe3+质量浓度为横坐标,以A值为纵坐标绘制标准曲线。在实验条件下,Fe3+质量浓度在1.68~22.4 mg/L符合比尔定律,线性回归方程为A=4.662 C-0.111 3,r=0.999 0,检出限为0.032 mg/L。
2.8 显色时间的影响精密吸取0.1 mmol/L标准Fe3+溶液2 mL,以及FD1(0.81 mmol/L)试剂溶液2 mL于5 mL量瓶内,用hepes缓冲液定容至刻度,摇匀,显色时间5、15、25、30 min后测其在563 nm处A值并绘制在不同时间A值与浓度之间的关系图,见图 4。通过对FD1-Fe3+络合物显色5、15、25、30 min后,对于其线性关系的考察结果,5 min时间最适,线性关系良好。
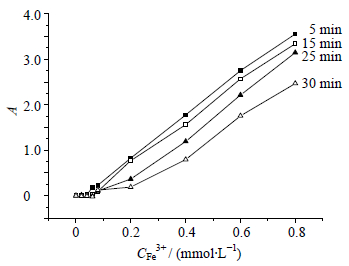 | 图 4 显色时间对线性关系的影响 Fig. 4 Effect of color time on linear relationship |
在测定0.1 mmol/L标准Fe3+溶液时,当误差小于5%时,共存离子可允许倍数(是指当除Fe3+以外的其他金属离子以Fe3+多少倍共存但是不影响Fe3+定量测定时,所允许的倍数)为Mg2+(300倍),Zn2+、Co2+(200倍),Ni2+、K+、Na+、Ag+(100倍),Pb2+(50倍),Fe2+(5倍),Cu2+(1倍)(加入不同倍数的共存离子,测定其在563 nm处A值,当该值与为加入共存离子的标准Fe3+溶液A值之间误差不大于5%)。虽然Cu2+的允许倍数为1倍,但是中药中一般Fe质量分数高,而Cu质量分数很低,所以不会对Fe的测定构成影响,说明该方法具有良好的选择性。
2.10 精密度考察精密吸取0.1 mmol/L标准Fe3+溶液2 mL各6份,按照标准曲线制备方法进行检测分析,记录A值,结果其RSD值为1.10%,表明该方法具有良好的精密度。
2.11 稳定性考察精密吸取续断供试品溶液2mL,按照标准曲线制作方法进行分析测试,每隔5 min测试1次,连续测试6次,记录A值,结果其RSD值为1.92%,表明Fe3+在供试品溶液中30 min内稳定。
2.12 重复性考察准确称取续断药材10.000 g,按“2.2”项方法操作。精密吸取6份同质量浓度的上述续断供试品溶液,按照标准曲线制备方法进行检测分析,记录A值,结果其RSD值为1.80%,表明该方法具有良好的重复性。
2.13 加样回收率试验紫外-可见分光光度法测定中药水煎液中Fe3+的量,在各中药饮片水煎液干法消化样品中,添加3个水平的Fe3+标准品,进行回收率试验。标准Fe3+溶液浓度为0.1、1、2 mmol/L,按照标准曲线制备方法进行检测分析,3个水平各重复6次测定。结果表明,标准Fe3+的平均加标回收率在90.45%~104.11%,重复性RSD<5%。该方法回收率较高,重复性良好,可应用于中药水煎液中成分对铁络合强度的测定。
2.14 铁络合能力测定准确移取各药材水煎液各2mL于5 mL量瓶中,加入FD1(0.81 mmol/L)试剂溶液2 mL,用hepes缓冲液定容至刻度,混合均匀,显色后于563 nm处测A值,以A值计算煎液中游离态Fe3+的量;准确移取各药材水煎液、0.1 mmol/L标准Fe3+溶液各2 mL于5 mL量瓶中,加入FD1(0.81 mmol/L)试剂溶液2 mL,用hepes缓冲液定容至刻度,混合均匀,显色后于563 nm下测定A值,以A值计算络合量以显示对Fe3+的络合能力。准确移取各中药饮片水煎液2 mL于5 mL量瓶中,准确加入2 mL水代替试剂FD1用hepes缓冲液定容至刻度,摇匀,于563 nm波长处测定A值,作为样品空白。测定结果见表 1(其中,Fe3+加入量为11.20 μg)。
|
|
表 1 中药与Fe3+络合率测定结果 Table 1 Determination on strength of CMM complexing with Fe3+ |
Fe3+络合率=Fe3+络合量 / Fe3+加入量=(游离态Fe3+量+Fe3+加入量-Fe3+测得量) / Fe3+加入量
3 讨论本实验基于Fe3+对于螺环罗丹明B酰肼衍生物开环反应的催化作用,建立了测定中药煎液中游离态Fe3+的方法。在中药煎液中加入一定量的标准Fe3+溶液,然后测定其游离态Fe3+的回收率,进而建立了中药煎液对Fe3+络合能力的体外评估方法。该方法具有简便、灵敏、选择性高、容易推广和应用的特点。
中药治疗与铁过载有关的疾病具有很好的效果,但从现代科学看,其机制不明、物质基础不清,严重影响了其推广应用,也无法制定相应的质量控制标准,使其临床效果难以保障。本实验研究结果虽然离弄清中药治疗铁过载的机制和物质基础还有一定距离,但分析筛选方法的建立使得此项研究能够开展并预期能够取得成果,因此必将推动此项研究的进步。
结果显示续断、锁阳、巴戟天、沙苑子、葫芦巴、骨碎补、仙茅、狗脊8种补肾中药对铁的络合强度较高(63.57%~84.28%),这与临床报道治疗老年痴呆症及OP常用补肾药是一致。也说明这些补肾药中可能含有对Fe3+络合能力较强的成分,值得深入研究。同时,经查阅相关文献发现补肾中药中络合率较高的续断、锁阳、沙苑子、仙茅、骨碎补的主要成分都为三萜皂苷类,并且在其他对比中药饮片中桔梗的络合率较高,其主要成分也为三萜皂苷类,所以,由此推测三萜皂苷类化学成分可能更容易与游离Fe3+进行络合。本课题组会进一步实验证实这一推测,为中药治疗铁过载疾病机制进行证据补充。
| [1] | 毕桂宏. 简析微量元素铁与中药临床疗效的相关性 [J]. 中医中药, 2011, 9(32): 161-162. |
| [2] | 吕金荣. 微量元素铁与人体健康 [J]. 微量元素与健康研究, 2006, 23(3): 63-64. |
| [3] | 单振芬. 微量元素与人体健康 [J]. 微量元素与健康研究, 2006, 23(3): 66-67. |
| [4] | 夏 敏. 必需微量元素与人体健康 [J]. 广东微量元素科学, 2003, 10(1): 11-16. |
| [5] | 刘旭新. 微量元素铁代谢的研究进展 [J]. 广东微量元素科学, 2001, 8(1): 11-15. |
| [6] | 赵国阳, 徐又佳. 铁过载的研究进展 [J]. 江苏医药, 2012, 38(2): 205-207. |
| [7] | 杨 卉, 曹学兵. 铁与帕金森病相关性研究的近况国外医学: 神经病学神经外科学分册 [J]. 2000, 27(4): 180-183. |
| [8] | 冯玉爽, 徐又佳, 钱忠明. 铁过载与骨质疏松症 [J]. 江苏医药, 2011, 37(11): 1320-1321. |
| [9] | 王 兵, 徐又佳. 铁过载检测在骨质疏松症诊断中的作用 [J]. 中华骨质疏松和骨矿盐疾病杂志, 2012, 5(1): 69-72. |
| [10] | Lei P, Ayton S, Finkelstein D I, et al. Tau deficiency induces parkinsonism with dementia by impairing APP-mediated iron export [J]. Nat Med, 2012, 18(2): 291-295. |
| [11] | Kepp K P. Bioinorganic chemistry of Alzheimer’s Disease [J]. Chem Rev, 2012, 112(10): 5193-5239. |
| [12] | Savelieff M G, Lee S, Liu Y, et al. Untangling amyloid-β, tau, and metals in Alzheimer’s Disease [J]. ACS Chem Biol, 2013, 8(5): 856-865. |
| [13] | 何银峰, 徐又佳. 铁螯合剂在铁过载骨质疏松症中的应用前景 [J]. 国际骨科学杂志, 2011, 32(4): 226-227. |
| [14] | Zhan M, Gao Y H, Li M Y, et al. A selective turn-on fluorescent sensor for FeIII and application to bioimaging [J]. Tetrahedron Lett, 2007, 48(21): 3709-3712. |
| [15] | 杨宏梅, 付红梅. 中药煎煮方法及注意事项 [J]. 中国实用医药, 2010, 5(13): 241. |
 2014, Vol. 45
2014, Vol. 45



