辛夷Magnoliae Flos为木兰科(Magnoliaceae)木兰属Magnolia L. 植物望春花Magnolia biondii Pamp.、玉兰Magnolia denudata Desr. 或武当玉兰Magnolia sprengeri Pamp. 的干燥花蕾,有祛风发散、通鼻窍之功效[1]。现代药理研究表明,辛夷挥发油(volatile oil of MagnoliaeFlos,VOMF)具有收敛和改善微循环作用,以及对过敏性慢反应物、组胺和乙酰胆碱引起的收缩均有对抗作用[2]。但VOMF中所含的a-松油醇为毒性成分,对黏膜和纤毛有较大的剌激性[3]。本课题组前期采用硅胶柱色谱法对VOMF进行分离处理,剔除其中的a-松油醇[3],得到无a-松油醇VOMF。本实验所用制剂用药均为无a-松油醇VOMF。
近年来,已研究开发了许多治疗变异性鼻炎的VOMF新型经鼻给药剂型,如β-环糊精包合物、纳米脂质体等[4,5,6],但查阅文献,尚未见其醇质体制剂的相关研究报道,而醇质体作为包封药物的一种新型载体,与普通脂质体相比其粒径较小、结构稳定、包封率高、变形性高、透过量多,有更好的柔性,易于携带药物穿过黏膜,是良好的鼻腔给药载体[7]。因此,本实验先将剔除a-松油醇的VOMF制备成醇质体,再结合传统鼻用喷雾剂药物定量准确、鼻腔内分布均匀、吸收快、使用方便等特点[8],将其制备成醇质体喷雾剂,并对其质量进行考察,为进一步研究相关制剂提供参考,具有重要的意义。
1 仪器和材料RE—52AA旋转蒸发仪,上海亚荣生化仪器厂;GCMS-QP2010气-质联用色谱仪,日本岛津;78—1型磁力加热搅拌器,江苏省金坛市正基仪器有限公司;FJ—200高速分散匀质机,上海标本模型仪器厂;LG16—W高速离心机,北京医用离心机厂;Zeta sizer ZEN 3600型激光粒度仪,英国Malvern公司;JEM—2000EX透射电子显微镜,日本电子公司;喷雾瓶,西安化玻仪器有限公司。
β-蒎烯(分析对照品,质量分数98%,阿拉丁试剂有限公司);VOMF(水蒸气蒸馏法提取,辛夷药材购自西安市万寿路药材市场,经西北大学胡正海教授鉴定为望春花Magnolia biondii Pamp. 的干燥花蕾,出油率为2.1%);大豆卵磷脂,天津市博迪化工有限公司;聚乙二醇辛基苯基醚(Triton X-100),陕西森佛生物科技有限公司;盐酸麻黄碱(批号050914-1),沈阳第一制药厂;去氧胆酸钠(批号060814,北京华美生物工程公司);无水乙醇(色谱醇);0.22 μm微孔滤膜,上海新亚药业有限公司;其余试剂均为分析纯。
中华大蟾蜍Bufo bufo gargarizans Cantor,普通级,体质量50~60 g,雌雄不限,由西安交通大学实验动物中心提供,许可证号:医动字第08-016。
2 方法和结果 2.1 VOMF醇质体喷雾剂的制备采用注入法[9]制备无a-松油醇VOMF醇质体,将处方量的大豆卵磷脂、挥发油、胆固醇溶于一定量的无水乙醇中,置于600 r/min磁力搅拌器上,维持乳化温度30 ℃,在密闭容器中用注射器以细流状缓慢注入定量的蒸馏水,注射完后继续搅拌30 min,再高速匀质(10 000 r/min)10 min,用0.22 μm微孔滤膜滤过即得,4 ℃保存。取所制得的醇质体分装于10 mL鼻腔给药喷雾瓶中,即得。
2.2 空白醇质体的制备按“2.1”项下方法,不加挥发油,制备空白醇质体。
2.3 包封率和载药量的测定 2.3.1 包封率测定方法建立用GC法测定VOMF醇质体的包封率和载药量[7]。
2.3.2 线性关系考察选取β-蒎烯作为内参物,利用气相色谱仪测定纯β-蒎烯溶液的GC图谱。GC的条件为炉温150 ℃;检测器温度200 ℃;进样器温度240 ℃。精密称取β-蒎烯对照品10 mg,置于10 mL量瓶中,用无水乙醇溶解并稀释至刻度,摇匀,即得质量浓度为1 mg/mL的对照品溶液。分别精密吸取0.2、0.4、0.8、1.2、1.6 mL置于10 mL量瓶中,用无水乙醇稀释至刻度,摇匀。分别精密吸取1 μL,进行GC检测,以色谱峰面积为纵坐标(Y),进样量为横坐标(X)进行线性回归,得回归方程为Y=15 909 679 X+4 709,r=0.999 8,线性范围为20~160 μg/mL。
2.3.3 供试品溶液的制备精密吸取VOMF醇质体0.5 mL于10 mL量瓶中,加入适量Triton X-100超声后定容至刻度,即得供试品溶液。
2.3.4 精密度试验取“2.3.3”项下质量浓度为2.5 mg/mL的供试品溶液,按“2.3.2”中的色谱条件测定,重复进样6次,以β-蒎烯的峰面积计算,其RSD值为1.57%,表明仪器精密度良好。
2.3.5 稳定性试验取“2.3.3”项下质量浓度为2.5 mg/mL的供试品溶液,照上述色谱条件分别在0、2、4、6、8、10、12 h进样,其RSD值为1.36%,结果表明溶液至少在12 h内稳定。
2.3.6 重复性试验取同批样品6份,分别制备供试品溶液并按色谱条件进行测定,记录峰面积,β-蒎烯峰面积的RSD值为1.50%,说明该方法重复性良好。
2.3.7 回收率试验取空白醇质体溶液,分别加入不同量的β-蒎烯对照品溶液于量瓶中,Triton X-100破乳并稀释定容成20、80、160 μg/mL的溶液,每一质量浓度测定3次。测得平均回收率分别为99.02%、98.24%、98.56%,RSD值分别为0.96%、1.34%、1.26%,符合要求。
2.3.8 包封率和载药量测定制备一组相同的VOMF醇质体,把醇质体平均分成2份,其中1份通过高速离心和滤膜滤过法分离,测定溶液中所含的VOMF中β-蒎烯的量(W1)。另1份通过加入一定量的Triton X-100使醇质体充分破坏,释放出包封的VOMF,然后测定总的VOMF中β-蒎烯的量(W2);以W3表示醇质体的总质量,再根据下式计算包封率和载药量。
包封率=(W2-W1) / W2
载药量=(W2-W1) / W3
2.4 正交试验优选处方 2.4.1 试验设计及结果根据预试验结果,以磷脂用量(A)、乙醇用量(B)和胆固醇用量(C)为考察因素,各取3个水平进行L9(34) 正交设计,以包封率和载药量的综合评分为考察指标。评分标准为满分100分,载药量和包封率各占50%;包封率得分以各试验号包封率除最高包封率,再乘100得到,载药量得分按同法计算,综合评分将包封率和载药量2项得分相加即得。采用直观分析方法筛选醇质体的最佳处方。试验设计及结果见表 1,方差分析见表 2。
|
|
表 1 L9(34)正交试验设计与结果 Table 1 Design and results of L9(34) orthogonal test |
|
|
表 2 方差分析 Table 2 Analysis of variance |
由试验结果可知,各考察因素对该醇质体的包封率和载药量双项综合指标中因素A对综合指标的影响最大,具有极显著性;因素B的影响次之,也具有显著性;因素C的影响不具有显著性差异。因此,确定最优处方为A1B3C2,即大豆磷脂用量为1.5%,乙醇用量为36%,胆固醇用量为0.15%,按此处方制得的该醇质体载药量为2.96%。
2.4.2 最优处方验证按正交试验设计得到的优化处方,制备3批无a-松油醇VOMF醇质体,按“2.3.8”项下方法测得包封率分别为58.45%、57.72%、59.48%,平均包封率为(58.55±1.88)%,平均载药量为(2.96±0.04)%。故所制得该醇质体包封率和载药量稳定,所确定的优化工艺合理可行,稳定可靠,具有可操作性和重现性。
2.5 VOMF醇质体的性质考察 2.5.1 形态观察将制备得到的VOMF醇质体样品稀释至35倍,吸取混悬液少许滴于有支持膜的铜网上,稍干后用磷钼酸负染色法染色,滤纸吸铜网边缘多余液体后置于透射电镜下观察样品的大小及形态。由透射电镜(TEM)照片(图 1)可见,VOMF醇质体为近球状小囊泡,外形圆整光滑,形态分布均一。
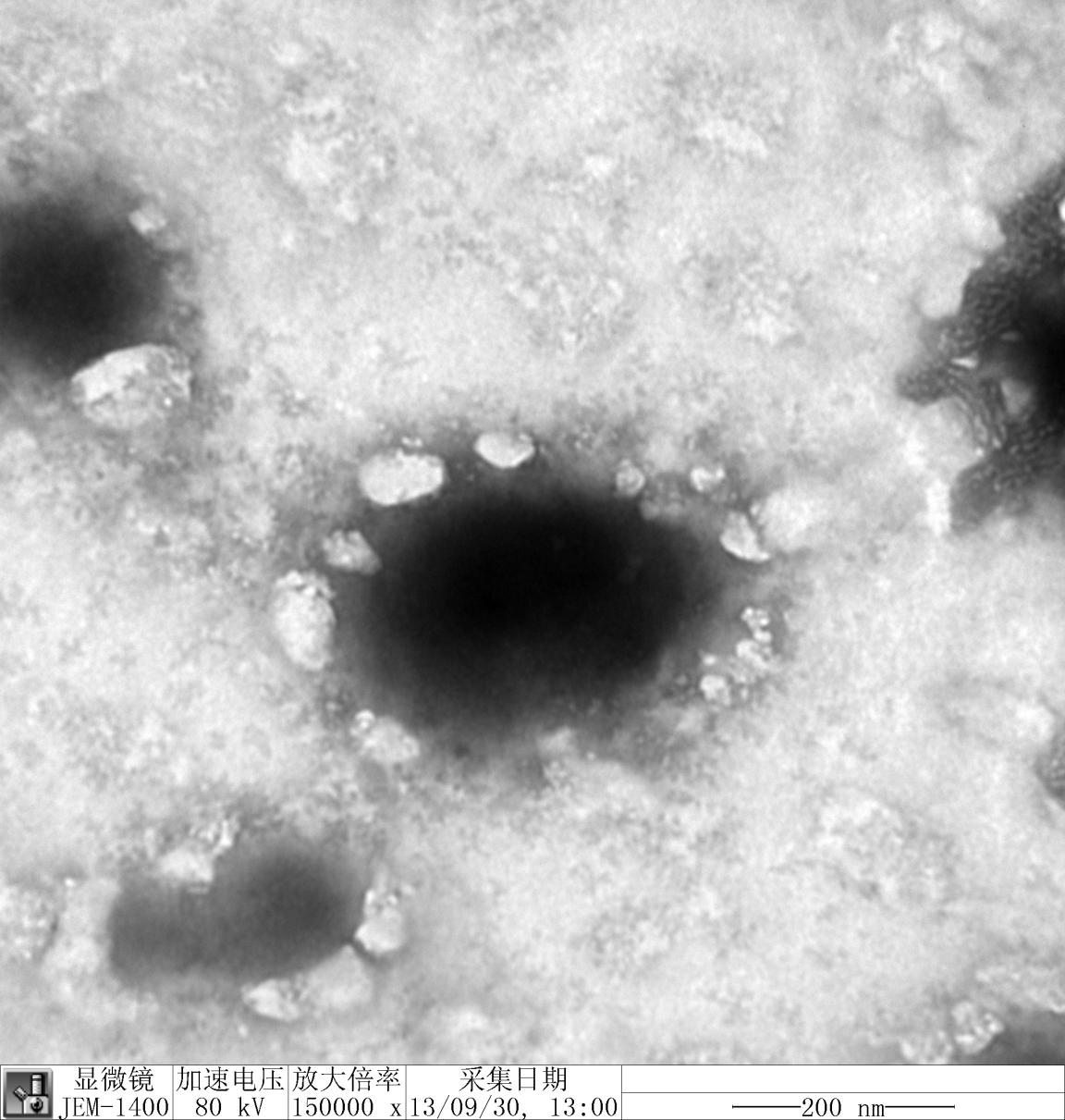 | 图 1 VOMF醇质体电镜照片 Fig. 1 Transmission electron microscope of VOMF ethosome |
取制备得到的适量醇质体,滴入盛样器,采用电位测定仪测定醇质体的Zeta电位(图 2),结果显示Zeta电位为(-55.9±2.1)mV;采用激光粒度仪测定醇质体的平均粒径为(186.7±1.9)nm,粒径分布如图 3-A所示。
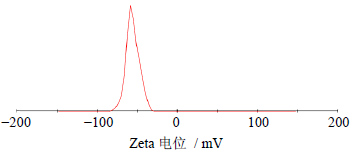 | 图 2 醇质体Zeta电位分布图 Fig. 2 Zeta potentialdistribution of ethosome |
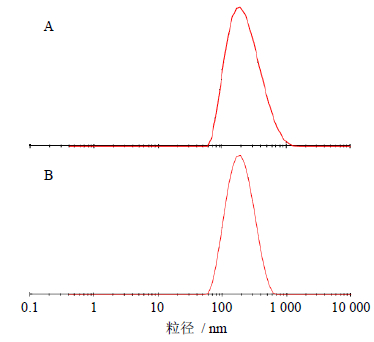 | 图 3 喷雾前 (A) 和喷雾后 (B) 粒径分布图 Fig. 3 Particle size distribution before (A) and after (B) spraying |
(1)pH值测定:取制得的醇质体用精密pH计测定。
(2)过氧化值的测定:采用丙二醛检测法,通过测定磷脂氧化产物丙二醛的量及其与放置时间的关系,间接地考察醇质体膜材的氧化程度,利用丙二醛在酸性条件下与硫代巴比妥酸(TBA)反应生成红色产物,在534 nm处有特异吸收的特点,测定其吸光度(A)值可得出丙二醛的量。具体方法:称取三氯乙酸(TCA)30 g,TBA 0.75 g,加0.25 mol/L盐酸200 mL,温热溶解,滤过后得到TCA-TBA-HCl溶液。精密量取醇质体混悬液0.8 mL,混匀,100 ℃水浴加热30 min,放冷,加入TCA-TBA-HCl溶解,转移至10 mL量瓶中,定容至刻度,混匀后以4 000 r/min的速度离心5 min,以TCA-TBA-HCl试液为空白,测定其534 nm处A值,即为过氧化值。
将4℃保存的醇质体分别在0、1、2、4、6个月定时取样,检测药物包封率、pH值、过氧化值,结果见表 3。由表 3可知,随着放置时间的延长,其包封率及pH值有下降的趋势,过氧化值则有所增加。但各项指标变化不大,说明该醇质体在4 ℃条件下稳定性良好。
|
|
表 3 醇质体的稳定性 (n=3) Table 3 Stability of ethosomes (n=3) |
用激光散射法测定VOMF醇质体喷雾前、后的粒径及粒度分布情况,其结果见图 3。醇质体粒径较小且均匀,喷雾后粒径分布范围明显变窄,160 nm左右的粒子所占的比例明显增加,平均粒径由原来的186.7 nm减少到172.8 nm,多分散指数也由原来的0.207降低到0.195。由结果可知,该醇质体喷雾后粒子更加细小而均匀。
2.6.2 喷雾过程对包封率的影响取“2.4.2”项下制备的3批醇质体用同一喷雾瓶进行雾化,收集喷雾液,测定醇质体喷雾后的平均包封率为(58.59±0.63)%,由结果可知经喷雾器雾化后其醇质体包封率基本不变。
2.7 鼻黏膜纤毛毒性研究中华大蟾蜍35只,随机分为7组,每组5只。以生理盐水为空白对照,选用公认无纤毛毒性的1%盐酸麻黄碱作为阴性对照品,有严重纤毛毒性的1%去氧胆酸钠作为阳性对照品[10,11]。以纤毛运动持续时间(persistent vibration duration,PVD)和纤毛持续运动率(percentage of persistent vibration,PPV)作为指标,综合评价VOMF原油、无a-松油醇VOMF及其醇质体喷雾剂和空白醇质体的鼻黏膜纤毛毒性。将蟾蜍仰卧固定在蛙板上,以止血钳牵拉使其口腔张开,于上腭黏膜处分别滴加上述7组溶液各0.5 mL,使完全浸没上腭,接触0.5 h后用生理盐水冲洗干净,剪取上颚黏膜3 mm×3 mm,用25 ℃生理盐水冲洗干净药物后,小心分离上腭黏膜,随即用生理盐水洗净杂物。然后使纤毛面向上平铺于载玻片上,于黏膜表面滴加生理盐水,盖上盖玻片,光学显微镜下观察纤毛运动情况。将黏膜置于预先用少量蒸馏水饱和的层析缸中,密闭,环境温度25 ℃,此后每隔适当时间取出上颚标本于光学显微镜下观察,记录从给药开始至纤毛运动停止所持续的时间,即PVD。以各给药组的PVD除以生理盐水组的PVD即得PPV,PPV越高,则表示药物对纤毛的毒性越小。由表 4可知,与生理盐水组比较,VOMF原油组的PVD为432 min,具有显著性差异;与VOMF原油组比较,无a-松油醇VOMF组的PVD增加了185 min,PPV也由原来的57.4%增加到82.0%;将无a-松油醇VOMF制备成醇质体喷雾剂后其PPV达到92.2%,与空白醇质体比较无显著性差异。这些结果表明,空白醇质体鼻腔给药无纤毛毒性,VOMF原油组具有显著的纤毛毒性,而无a-松油醇VOMF醇质体喷雾剂组从给药开始至纤毛运动停止所持续的时间明显延长。
|
|
表 4 各组纤毛PVD和PPV ( ±s,n=5)
Table 4 PVDand PPV in each group ( ±s,n=5)
Table 4 PVDand PPV in each group ( ±s,n=5) ±s,n=5)
|
醇质体的平均粒径与药物包封率是评价药物传递系统的重要参数,实验发现乙醇和磷脂量可直接影响醇质体的包封率,且乙醇量过低不利于醇质体对药物的包封,胆固醇在制备过程中可增强醇质体的稳定性,这与相关研究的结论基本一致[12]。本实验制得的醇质体通过电镜观察,其形状规则近似球形,粒径理想。Zeta电位为(-55.9±2.1)mV,表明醇质体粒子表面带负电荷,这在一定程度上阻止了醇质体粒子的聚集,保证了混悬液的稳定性,显示处方工艺可行,但由于是首次将VOMF中的毒性成分a-松油醇剔除后制备成醇质体,其包封率和载药量相对较低,因此,其制备工艺有待进一步提高。
纤毛毒性试验显示,VOMF原油直接鼻腔给药后具有显著的纤毛毒性,而经分离处理后的挥发油成分与VOMF原油相比,纤毛毒性明显下降,纤毛持续运动百分率达到82.0%,这可能与剔除挥发油中的毒性成分密切相关。本实验将其制备成醇质体后基本无纤毛毒性,也表明醇质体可以安全用于鼻腔给药,这与相关研究结论基本一致[13]。
| [1] | 王永慧, 叶 方, 张秀华. 辛夷药理作用和临床应用研究进展 [J]. 中国医药导报, 2012, 9(16): 12-14. |
| [2] | 李 战, 吴 敏. 辛夷和苍耳子的临床药理研究进展 [J]. 上海第二医科大学学报, 2004, 24(5): 393-394. |
| [3] | 豆菁菁. 辛夷挥发油不同活性部位的抗炎抑菌作用及其纳米脂质体的制备 [D]. 西安: 西北大学, 2012. |
| [4] | 杨明霞, 邢建国, 毛新民. 辛蒿凝胶剂挥发油β-环糊精包合物的实验研究 [J]. 中成药, 2004, 26(11): 951-953. |
| [5] | 吴 敏, 刘 娟, 张 欣. 辛夷挥发油纳米脂质体的制备工艺研究 [J]. 中西医结合学报, 2007, 5(3): 314-317. |
| [6] | 李莎莎, 宋艳丽, 危红华, 等. 传明酸传递体的制备及其性质考察 [J]. 中草药, 2013, 44(22): 3141-3146. |
| [7] | 安珂瑶, 孙 勇. 醇质体的研究进展 [J]. 中国药房, 2011, 22(5): 463-465. |
| [8] | 黄瑞红, 肖大立. 盐酸西替利嗪鼻腔喷雾剂质量标准研究 [J]. 现代医药卫生, 2009, 25(20): 3407-3408. |
| [9] | 韩腾飞, 程 亮, 危红华, 等. 盐酸青藤碱醇质体的制备及其性质考察 [J]. 中草药, 2012, 43(7): 1300-1305. |
| [10] | 林华庆, 宋 涛, 王东凯, 等. 利巴韦林鼻用温敏凝胶的鼻腔纤毛毒性研究 [J]. 中国新药杂志, 2007, 16(6): 1258-1260. |
| [11] | 王晓丹, 王 晖, 吴江锋, 等. 复方地西泮对蟾蜍鼻黏膜纤毛毒性作用的研究 [J]. 中药新药与临床药理, 2012, 23(3): 255-258. |
| [12] | 韩腾飞, 闫菁华, 豆婧婧, 等. 甘草次酸醇质体的制备研究 [J]. 西北药学杂志, 2012, 27(1): 64-66. |
| [13] | 宋艳丽, 韩腾飞, 李莎莎, 等. 栀子苷经鼻给药醇质体喷雾剂的制备及其体外鼻黏膜渗透性研究 [J]. 中草药, 2013, 44(9): 1105-1110. |
 2014, Vol. 45
2014, Vol. 45


