王园园, 谭小燕, 胡明华, 马方励, 黄芝瑛, 梁金强. CCK-8法检测小鼠淋巴细胞增殖的条件探讨[J]. 药物评价研究, 2017, 40(2): 206-209.

WANG yuan-yuan, TAN xiao-yuan, HU ming-hua, MA Fang-li, HUANG Zhi-ying, LIANG Jin-qiang. Study on determination conditions for lymphocytic proliferation by CCK-8 method in mice[J]. Drug Evaluation Research, 2017, 40(2): 206-209.

CCK-8法检测小鼠淋巴细胞增殖的条件探讨
王园园1
,
谭小燕2,
胡明华1,
马方励1,
黄芝瑛2,3,
梁金强3

1. 无限极中草药免疫研究中心, 广东 广州 510665;
2. 中山大学药学院, 广东 广州 510006;
3. 中山大学实验动物中心, 广东 广州 510006
摘要:
目的
探索CCK-8法检测小鼠脾淋巴细胞增殖的最佳条件。
方法
采用交叉设计或两因素完全随机设计探索分裂素刀豆蛋白(ConA)或脂多糖(LPS)刺激的脾细胞增殖实验的细胞制备方法、细胞浓度、分裂素浓度、刺激时间、培养基中胎牛血清(FBS)浓度、是否预培养等条件。
结果
制备方法中以轻压制备的脾细胞增殖率高于轻磨;脾细胞浓度以5×106/mL为最佳;ConA浓度为2、5、10 μg/mL,LPS浓度为10、20、50 μg/mL细胞增殖率未见明显差异;刺激时间在48和72 h间脾细胞增殖率未见明显差异;用含10%、15%和20% FBS的培养基培养的脾细胞增殖率未见明显差异;制备的脾细胞当天刺激比第二天刺激增殖率更高。
结论
ConA和LPS刺激的Balb/C小鼠脾细胞增殖实验的最佳条件为,轻压制备脾细胞,脾细胞浓度为5×106/mL,制备当天直接种板,ConA的刺激浓度为2~10 μg/mL,LPS的刺激浓度为10~50 μg/mL。
关键词:
CCK-8
淋巴细胞增殖
脾细胞制备
刀豆蛋白
脂多糖
Study on determination conditions for lymphocytic proliferation by CCK-8 method in mice
WANG yuan-yuan1
,
TAN xiao-yuan2,
HU ming-hua1,
MA Fang-li1,
HUANG Zhi-ying2,3,
LIANG Jin-qiang3

1. Infinite Immune Research Center of Chinese Herbal Medicine, Guangzhou 510665, China;
2. School of Pharmaceutical Science of SUN YAT-SEN University, Guangzhou 510006, China;
3. Laboratory Animal Center of SUN YAT-SEN University, Guangzhou 510006, China
Abstract:
Objective
To study the optimum determination conditions for lymphocytic proliferation by CCK-8 method in mice.
Methods
To study the different influence factors of spleen cell proliferation experiment stimulated by mitogen concanavalin A (ConA) or lipopolysaccharide (LPS), including cell preparation method, lymphocytic density, FBS and stimulating agent concentration in culture medium, and stimulating immediately or 24 h after preparing cell, with cross design or two factor completely randomized design.
Results
Spleen lymphocytic proliferation rate of preparation method by light suppression was higher than that of the light grind. The appropriate concentration of spleen cells was 5 × 106/mL. The proliferation rate has no significant difference after being stimulated for 48 or 72 h by ConA (2, 5, or 10 μg/mL) or LPS (10, 20, or 50 μg/mL) under 10%, 15%, or 20% FBS concentration in culture medium. The proliferation rate of stimulating immediately after preparing cell was higher than that of 24 h after preparing cell.
Conclusion
The optimum conditions of Balb/C mouse spleen cell proliferation assay stimulated by ConA and LPS are as follows:preparation of spleen cells with light pressure, spleen cell concentration of 5×106/mL, direct stimulation with 2-10 μg/mL ConA or 10-50 μg/mL LPS in the day of preparation.
Key words:
CCK-8
lymphocytic proliferation
spleen cell preparation
concanavalin A
lipopolysaccharide
淋巴细胞增殖实验是检测淋巴细胞活性的重要手段,是免疫评价的常用实验,常用方法有MTT法和近年来的CCK-8法。MTT法具经济、安全、简便等特点,外源性MTT通过活细胞线粒体脱氢酶转化为不溶于水的甲臜颗粒,应用DMSO溶解,但过程中可能有溶解不完全、吸出上清液时带走部分细胞等问题,导致出现较大误差,重复性差。在CCK-8(cell counting kit-8)法中,四唑盐-WST-8通过活细胞线粒体脱氢酶转化为高度水溶性的黄色结晶,可直接进行比色,吸光度与活细胞数量呈正比,对细胞毒性小,较MTT法简便,避免了MTT法溶解过程中的缺点,近年来在检测细胞活性中得到广泛应用,但检测淋巴细胞增殖的条件还未完全成熟,本课题组通过交叉设计对应用CCK-8法检测BALB/c小鼠脾淋巴细胞增殖的条件进行了探讨。
1 材料
1.1 实验动物 雄性SPF级BALB/c小鼠,8周龄,体质量18~22 g,由中山大学(大学城)实验动物中心提供,实验动物生产许可证号为SCXK(粤)2011-0029。
1.2 主要试剂 CCK-8试剂盒,购自广州晶欣生物科技有限公司;刀豆蛋白(ConA)和脂多糖(LPS),购自美国Sigma公司。
1.3 主要仪器 Scientific HERA Cell 150i CO2培养箱、Multiskan Ascent多功能酶标仪(美国Thermo公司)。
2 方法
2.1 脾细胞的制备 脱颈椎处死小鼠,无菌取其脾脏,常规制备脾细胞悬液[1]。制备过程中,脾脏剪碎,用一次性注射器活塞在筛网(200目一次性)上轻轻研磨或轻压制备脾细胞。
2.2 ConA或LPS的配制 用RPMI 1640不完全培养基配制20、50、100 μg/mL ConA和100、200、500 μg/mL LPS溶液。
2.3 CCK-8法检测不同分裂素浓度、细胞浓度对小鼠脾细胞增殖的影响 按“2.1”项方法轻轻研磨制备脾细胞,10%胎牛血清(FBS)的RPMI 1640完全培养基适应培养24 h后,用含10% FBS的培养基调整细胞数为适宜浓度(1×106、2×106、5×106、1×107/mL),加入96孔细胞培养板,每孔90 μL。加入10 μL ConA溶液使其终浓度为2、5、10 μg/mL或10 μL LPS溶液使其终浓度为10、20、50 μg/mL,设空白对照(空白培养基,无细胞)和细胞对照孔(无ConA或LPS刺激),各样本设置3个复孔。孵育48 h,孵育结束前4 h,每孔加入10 μL CCK-8,继续培养4 h。
450 nm波长下,酶标仪检测吸光度(A)值。计算各条件下脾细胞的增殖率。
2.4 不同种板方式、孵育时间、细胞制备手法、血清浓度对小鼠脾细胞增殖的影响 按“2.1”项方法,采用轻轻研磨和轻压两种方法制备脾细胞,部分细胞不经适应培养直接种板,另一部分细胞适应培养24 h后种板,用含10%、15%、20% FBS的培养基分别调整细胞数为适宜浓度(2×106和5×106/mL),加入96孔细胞培养板,每孔90 μL。
加入10 μL ConA溶液使其终浓度为5 μg/mL或10 μL LPS溶液使其终浓度为20 μg/mL,设空白对照和细胞对照孔,继续培养48或72 h,CCK-8法检测细胞增殖率,方法同“2.3”项。
3 结果
3.1 不同分裂素浓度、细胞浓度对小鼠脾细胞增殖的影响 在轻磨制备细胞、细胞适应培养24 h、含10% FBS的培养基中孵育48 h的条件下,不同细胞浓度、不同分裂素浓度对BALB/c小鼠脾细胞增殖率的影响如表 1所示,最佳细胞浓度为2×106~5×106/mL。其中5×106/mL细胞浓度的A值在0.35~0.90,属CCK-8细胞反应的线性范围内,而2×106/mL细胞浓度A值在0.18~0.32,A值偏低,趋向于选择5×106/mL细胞浓度。ConA在2、5、10 μg/mL浓度,LPS在10、20、50 μg/mL浓度,细胞增殖率未明显差异。
表 1(Table 1)

表 1 不同分裂素浓度、细胞浓度对小鼠脾细胞增殖的影响(x±s, n=3)
Table 1 Effects of stimulating agent with various concentration and lymphocytic density on proliferation rate in mouse spleen lymphocyte (x±s, n=3)
| 组别 |
浓度/(μg·mL-1) |
细胞浓度10×106 mL-1 |
|
细胞浓度5×106 mL-1 |
|
细胞浓度2×106 mL-1 |
|
细胞浓度1×106 mL-1 |
| A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
| 空白对照 |
- |
0.138±0.030 |
- |
|
0.138±0.030 |
- |
|
0.138±0.030 |
- |
|
0.138±0.030 |
- |
| 细胞对照 |
- |
0.807±0.028 |
- |
|
0.402±0.023 |
- |
|
0.191±0.002 |
- |
|
0.165±0.007 |
- |
| ConA |
2 |
1.007±0.004 |
130 |
0.770±0.065 |
240 |
0.223±0.011 |
161 |
0.169±0.008 |
113 |
|
5 |
1.107±0.021 |
145 |
0.849±0.033 |
270 |
0.275±0.007 |
259 |
0.170±0.004 |
117 |
|
10 |
1.040±0.013 |
135 |
|
0.811±0.047 |
255 |
|
0.335±0.010 |
372 |
|
0.189±0.014 |
186 |
| |
| 组别 |
浓度/(μg·mL-1) |
细胞浓度10×106 mL-1 |
|
细胞浓度5×106 mL-1 |
|
细胞浓度2×106 mL-1 |
|
细胞浓度1×106 mL-1 |
| A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
| 空白对照 |
- |
0.137±0.002 |
- |
|
0.137±0.002 |
- |
|
0.137±0.002 |
- |
|
0.137±0.002 |
- |
| 细胞对照 |
- |
0.807±0.008 |
- |
|
0.324±0.003 |
- |
|
0.189±0.000 |
- |
|
0.167±0.001 |
- |
| LPS |
10 |
0.593±0.038 |
68 |
0.664±0.043 |
281 |
0.262±0.006 |
239 |
0.175±0.010 |
125 |
|
20 |
0.600±0.014 |
69 |
0.706±0.036 |
304 |
0.274±0.011 |
262 |
0.174±0.002 |
124 |
|
50 |
0.645±0.095 |
76 |
|
0.758±0.055 |
331 |
|
0.257±0.016 |
230 |
|
0.175±0.016 |
127 |
|
表 1 不同分裂素浓度、细胞浓度对小鼠脾细胞增殖的影响(x±s, n=3)
Table 1 Effects of stimulating agent with various concentration and lymphocytic density on proliferation rate in mouse spleen lymphocyte (x±s, n=3)
|
3.2 细胞制备后直接种板刺激,不同孵育时间、细胞制备手法、血清浓度对小鼠脾细胞增殖的影响 如表 2所示,在ConA浓度为5 μg/mL或LPS浓度为20 μg/mL、直接种板刺激的条件下,轻压的脾脏制备方法明显优于轻磨,采用轻压方法制备的细胞,经ConA或LPS刺激后,细胞增殖明显,应与轻压对细胞损伤较小有关;且5×106/mL的细胞浓度明显优于2×106/mL,进一步证实了5×106/mL细胞浓度为最合适的浓度;在其他条件保持一致的情况下,48、72 h的脾细胞增殖率无明显差异;FBS在培养基中的浓度(10%、15%、20%)对脾细胞增殖率的影响不明显。
表 2(Table 2)

表 2 细胞制备后直接种板刺激,不同孵育时间、细胞制备手法、血清浓度对小鼠脾细胞增殖的影响(x±s, n=3)
Table 2 Stimulating immediately after preparing cell, effect on proliferation rate in mouse spleen lymphocyte treated with various stimulating time, cell preparation method and concentration of FBS (x±s, n=3)
| 培养基 |
组别 |
孵育48 h轻压 |
|
孵育48 h轻磨 |
| 细胞浓度5×106 mL-1 |
|
细胞浓度2×106 mL-1 |
细胞浓度5×106 mL-1 |
|
细胞浓度2×106 mL-1 |
| A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
| 20%FBS |
空白对照 |
0.132±0.002 |
- |
|
0.132±0.002 |
- |
|
0.131±0.003 |
- |
|
0.131±0.003 |
- |
|
细胞对照 |
0.209±0.004 |
- |
|
0.154±0.003 |
- |
|
0.228±0.006 |
- |
|
0.166±0.001 |
- |
|
ConA |
0.593±0.062 |
599 |
0.213±0.001 |
363 |
0.436±0.024 |
315 |
0.197±0.011 |
192 |
|
LPS |
0.591±0.017 |
597 |
0.214±0.007 |
367 |
0.233±0.001 |
105 |
0.176±0.007 |
131 |
| 15%FBS |
细胞对照 |
0.209±0.003 |
- |
0.160±0.003 |
- |
0.581±0.023 |
- |
0.238±0.004 |
- |
|
ConA |
0.806±0.021 |
872 |
0.249±0.008 |
408 |
0.431±0.011 |
67 |
0.219±0.005 |
82 |
|
LPS |
0.737±0.044 |
783 |
0.254±0.006 |
427 |
0.595±0.023 |
103 |
0.231±0.001 |
94 |
| 10%FBS |
细胞对照 |
0.210±0.003 |
- |
0.167±0.015 |
- |
0.221±0.000 |
- |
0.170±0.001 |
- |
|
ConA |
0.768±0.039 |
808 |
0.235±0.002 |
291 |
0.383±0.017 |
280 |
0.196±0.008 |
167 |
|
LPS |
0.694±0.010 |
715 |
|
0.247±0.021 |
324 |
|
0.473±0.004 |
380 |
|
0.210±0.000 |
203 |
| |
| 培养基 |
组别 |
孵育72 h轻压 |
|
孵育72 h轻磨 |
| 细胞浓度5×106 mL-1 |
|
细胞浓度2×106 mL-1 |
细胞浓度5×106 mL-1 |
|
细胞浓度2×106 mL-1 |
| A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
| 20%FBS |
空白对照 |
0.142±0.010 |
- |
|
0.142±0.010 |
- |
|
0.130±0.002 |
- |
|
0.130±0.002 |
- |
|
对照 |
0.207±0.010 |
- |
|
0.168±0.009 |
- |
|
0.236±0.008 |
- |
|
0.161±0.001 |
- |
|
ConA |
0.458±0.037 |
484 |
0.213±0.008 |
271 |
0.339±0.007 |
197 |
0.180±0.001 |
160 |
|
LPS |
0.596±0.027 |
696 |
0.225±0.016 |
318 |
0.407±0.026 |
261 |
0.175±0.004 |
146 |
| 15%FBS |
细胞对照 |
0.216±0.003 |
- |
0.198±0.012 |
- |
0.208±0.002 |
- |
0.163±0.001 |
- |
|
ConA |
0.621±0.040 |
645 |
0.235±0.021 |
166 |
0.334±0.025 |
264 |
0.188±0.005 |
175 |
|
LPS |
0.670±0.004 |
711 |
0.268±0.023 |
224 |
0.427±0.042 |
384 |
0.174±0.006 |
134 |
| 10%FBS |
细胞对照 |
0.251±0.014 |
- |
0.232±0.034 |
- |
0.202±0.001 |
- |
0.161±0.001 |
- |
|
ConA |
0.666±0.038 |
480 |
0.262±0.034 |
133 |
0.260±0.003 |
182 |
0.174±0.001 |
145 |
|
LPS |
0.771±0.006 |
576 |
|
0.314±0.045 |
190 |
|
0.318±0.003 |
264 |
|
0.169±0.001 |
127 |
|
表 2 细胞制备后直接种板刺激,不同孵育时间、细胞制备手法、血清浓度对小鼠脾细胞增殖的影响(x±s, n=3)
Table 2 Stimulating immediately after preparing cell, effect on proliferation rate in mouse spleen lymphocyte treated with various stimulating time, cell preparation method and concentration of FBS (x±s, n=3)
|
3.3 细胞适应培养24 h,不同孵育时间、细胞制备手法、血清浓度对小鼠脾细胞增殖的影响 表 3总体上进一步证实了表 2的结果,结合表 2和表 3发现,在相同条件下脾细胞制备后直接种板刺激的A值和细胞增殖率明显高于适应培养24 h后再种板刺激。
表 3(Table 3)

表 3 细胞适应培养24 h,不同孵育时间、细胞制备手法、血清浓度对小鼠脾细胞增殖的影响(x±s, n=3)
Table 3 Cell culture for 24 h before stimulating, effects of various stimulating time, cell preparation methods, and concentration of FBS on proliferation rate in mouse spleen lymphocyte (x±s, n=3)
| 培养基 |
组别 |
孵育48 h轻压 |
|
孵育48 h轻磨 |
|
孵育72 h轻压 |
|
孵育72 h轻磨 |
| 细胞浓度5×106 mL-1 |
|
细胞浓度2×106 mL-1 |
细胞浓度5×106 mL-1 |
|
细胞浓度2×106 mL-1 |
细胞浓度5×106 mL-1 |
|
细胞浓度2×106 mL-1 |
细胞浓度5×106 mL-1 |
|
细胞浓度2×106 mL-1 |
| A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
A值 |
增殖率/% |
| 20%FBS |
空白对照 |
0.143±0.012 |
- |
|
0.143±0.012 |
- |
|
0.131±0.002 |
- |
|
0.131±0.002 |
- |
|
0.129±0.003 |
- |
|
0.129±0.003 |
- |
|
0.152±0.007 |
- |
|
0.152±0.007 |
- |
|
细胞对照 |
0.212±0.007 |
- |
0.181±0.013 |
- |
0.259±0.002 |
- |
0.157±0.009 |
- |
0.195±0.004 |
- |
0.149±0.005 |
- |
0.331±0.003 |
- |
0.184±0.008 |
- |
|
ConA |
0.317±0.010 |
251 |
0.221±0.016 |
202 |
0.388±0.010 |
201 |
0.152±0.008 |
81 |
0.237±0.002 |
163 |
0.175±0.004 |
237 |
0.496±0.017 |
192 |
0.194±0.013 |
131 |
|
LPS |
0.347±0.002 |
294 |
0.221±0.022 |
203 |
0.441±0.005 |
243 |
0.167±0.015 |
139 |
0.267±0.003 |
208 |
0.163±0.005 |
172 |
0.539±0.027 |
216 |
0.197±0.009 |
140 |
| 15%FBS |
细胞对照 |
0.177±0.007 |
- |
0.302±0.025 |
- |
0.219±0.005 |
- |
0.155±0.010 |
- |
0.145±0.002 |
- |
0.172±0.070 |
- |
0.270±0.001 |
- |
0.190±0.012 |
- |
|
ConA |
0.220±0.014 |
226 |
0.773±0.043 |
396 |
0.321±0.013 |
215 |
0.159±0.018 |
117 |
0.165±0.004 |
226 |
0.524±0.050 |
920 |
0.341±0.023 |
160 |
0.189±0.007 |
97 |
|
LPS |
0.198±0.007 |
162 |
0.613±0.052 |
296 |
0.321±0.012 |
216 |
0.163±0.006 |
134 |
0.186±0.010 |
357 |
0.495±0.022 |
853 |
0.321±0.045 |
144 |
0.184±0.008 |
84 |
| 10%FBS |
细胞对照 |
0.200±0.018 |
- |
0.315±0.057 |
- |
0.213±0.001 |
- |
0.159±0.004 |
- |
0.177±0.005 |
- |
0.263±0.001 |
- |
0.264±0.005 |
- |
0.199±0.006 |
- |
|
ConA |
0.233±0.017 |
157 |
0.516±0.098 |
217 |
0.315±0.008 |
225 |
0.160±0.019 |
104 |
0.203±0.010 |
154 |
0.582±0.020 |
338 |
0.331±0.014 |
160 |
0.195±0.012 |
92 |
|
LPS |
0.232±0.018 |
155 |
0.543±0.062 |
233 |
0.266±0.012 |
165 |
0.165±0.014 |
122 |
0.189±0.008 |
126 |
0.411±0.009 |
210 |
0.321±0.008 |
151 |
0.208±0.016 |
119 |
|
表 3 细胞适应培养24 h,不同孵育时间、细胞制备手法、血清浓度对小鼠脾细胞增殖的影响(x±s, n=3)
Table 3 Cell culture for 24 h before stimulating, effects of various stimulating time, cell preparation methods, and concentration of FBS on proliferation rate in mouse spleen lymphocyte (x±s, n=3)
|
4 讨论 脾细胞增殖实验受多种条件的影响,如细胞制备方法、种板的细胞浓度、分裂素浓度、血清浓度、刺激时间等,可能与细胞制备后的活性、细胞密度过大抑制生长或培养基营养不足、分裂素本身毒性等因素相关。本研究结果发现,ConA和LPS刺激的Balb/C小鼠脾细胞增殖实验的最佳条件为:轻压制备脾细胞、脾细胞浓度为5×106/mL、制备当天直接种板、ConA的刺激浓度为2~10 μg/mL,LPS的刺激浓度为10~50 μg/mL,刺激时间在48、72 h对脾细胞增殖率无明显影响,用48 h即可,培养基中10%、15%、20% FBS的浓度对脾细胞增殖率无明显影响。
小鼠脾细胞增殖的CCK-8法和文献上MTT法最优条件[1-3]比较发现,分裂素浓度、培养基血清浓度、刺激时间一致,而MTT法的细胞浓度较低,为(1.5~2.0)×106/mL,与本研究结果有一定的差异。
参考文献
| [1] |
徐叔云, 卞如濂, 陈修.
药理实验方法学[M]. 北京: 人民卫生出版社, 2004 .
|
| [2] |
刘民, 马华, 李柏青. MTT法检测小鼠淋巴细胞增殖性反应探讨[J].
中国实验动物学杂志, 1999(3):146–149.
|
| [3] |
林忠宁, 董胜璋, 董书芸, 等. MTT法检测T淋巴细胞增殖性功能的方法探讨与应用[J].
中国卫生检验杂志, 2000(1):8–10.
|
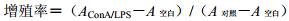
 2017, Vol. 40
2017, Vol. 40


