2. 天津药物研究院 释药技术与药代动力学国家重点实验室, 天津 300193;
3. 河南大学药学院, 开封 475000
2. State Key Laboratory of Drug Delivery Technologies and Drug Metabolism, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China;
3. The Pharmacy Faculty of Henan University, Kaifeng 475000, China
托拉塞米(Torasemide)是一种长效吡啶磺酰脲类降压利尿药[1],主要用于治疗高血压、急慢性心力衰竭、肝硬化腹水、尿崩症和肾衰,为呋塞米的更新换代产品。托拉塞米与呋塞米相比利尿作用更强,效果更持久,可用于呋塞米治疗无效的患者[2-3]。托拉塞米是两性物质,在胃和肠道环境中均有一定的吸收,且半衰期较长,故为避免其在体内的峰谷现象,减少其不良反应,宜将其做成缓释制剂[4]。体外溶出试验是口服固体制剂质量评价的一种重要手段,在某种意义上与制剂的生物利用度有很大的关联性[5-6]。通过评价仿制药与参比制剂在多种pH介质中溶出行为的一致性,有利于控制和提高仿制药质量,降低其体内生物等效性试验的失败率。本研究通过托拉塞米缓释片自制产品与原研产品在5种不同pH值的溶出介质中的释放行为一致性的考察,为其体内一致性评价工作的开展提供一些有益的探索。
1 材料 1.1 仪器LabaLLiance Series Ⅲ高效液相色谱泵、Spectra 100检测器、LabaLLiance HPLC工作站;ZRS-8G智能溶出仪(天津市天大天发科技有限公司);RC12AD溶出试验仪(天津市天大天发科技有限公司);Anke KA-1000飞鸽牌离心机(上海安宁科学仪器厂制造);Sartorius BP211D电子天平(德国赛多利斯公司);Sartorius BS124S电子天平(北京赛多利斯仪器系统有限公司);AS3120超声仪(奥特赛恩斯仪器有限公司);Evolution 220紫外-可见分光光度仪(Thermo Scientific);Mettler(FE20)台式PH计(上海梅特勒-托利多仪器有限公司)。
1.2 药物与试剂托拉塞米对照品(中国食品药品检定研究院,批号100605-200401);原研制剂为Sutril neo(批号H022,由Ferrer Internacional,S.A.公司生产,规格5 mg,铝塑包装);自制托拉塞米缓释片(批号140401,由天津药物研究院有限公司生产,规格5 mg,铝塑包装);盐酸、醋酸、醋酸钠、磷酸、磷酸二氢钾、氢氧化钠和磷酸三钠均为分析纯,甲醇为色谱纯。
2 释放度测定方法 2.1 色谱条件色谱柱为Kromasil C18(250 mm×4.6 mm,5 μm);流动相为甲醇-0.02 mol/L磷酸二氢钾溶液(用磷酸调节pH3.0)(55׃45);检测波长290 nm;柱温35℃;体积流量1.0 mL/min;进样量60 μL。
2.2 释放度测定法方法1:取托拉塞米原研片和自制片,根据2015年版《中国药典》四部通则0931溶出度与释放度测定法(第一法和第二法项下缓释制剂或控释制剂),采用0931溶出度和释放度测定法仪器装置项下第二法装置,分别以水、0.1 mol/L盐酸溶液、pH4.5醋酸盐缓冲液和pH6.8磷酸盐缓冲液500 mL为释放介质,调节转速为50 r/min,依法操作,于0.5、1.0、1.5、2、4、6、8、12、24 h时分别取溶液5 mL,以0.45 μm微孔滤膜过滤,取续滤液2 mL,作为供试品溶液,并及时补充等温等体积的释放介质。照HPLC法,于290 nm波长处测定。
方法2:取托拉塞米原研片和自制片,采用0931溶出度和释放度测定法仪器装置项下第二法装置,调节转速为50 r/min,先于750 mL 0.1 mol/L的盐酸溶液中溶出2 h,再加入等温0.2 mol/L磷酸钠溶液250 mL继续进行试验,依法操作,于0.5、1.0、1.5、2、4、6、8、12、24 h时分别取溶液5 mL,以0.45 μm微孔滤膜过滤,取续滤液2 mL,作为供试品溶液,并及时补充等温等体积的释放介质。照HPLC法,于290 nm波长处测定。
对照品溶液:精密称取托拉塞米对照品10.00 mg于50 mL量瓶中,加入适量甲醇,超声15 min,使其完全溶解,取出,静置至室温,加甲醇稀释至刻度,摇匀;精密量取上述溶液5 mL置50 mL量瓶中,分别以水、0.1 mol/L盐酸溶液,pH4.5醋酸盐缓冲液和pH6.8磷酸盐缓冲液稀释至刻度,摇匀,照HPLC法,于290 nm波长处测定。
3 方法学研究与结果 3.1 释放方法学研究 3.1.1 检测波长的确定精密称取托拉塞米对照品10 mg于50 mL量瓶中,加入适量甲醇,超声15 min,使其完全溶解,取出放至室温,加甲醇稀释至刻度摇匀,精密量取5 mL于50 mL量瓶中,加水(0.1 mol/L盐酸溶液、pH4.5醋酸盐缓冲液或pH6.8磷酸盐缓冲液)稀释至刻度摇匀,配得质量浓度为20.0 μg/mL溶液,照紫外可见分光光度法,于200~400 nm波长处扫描,结果显示供试品溶液在290 nm左右均存在最大吸收,故最终选择290 nm作为检测波长,结果见表 1。
| 表 1 托拉塞米在4种介质中的紫外吸收波长汇总 Table 1 Summary of UV absorption wavelength of torasemide in four kinds of release media |
3.1.2 辅料干扰性试验
称取托拉塞米空白辅料约300 mg于50 mL量瓶中,加入适量甲醇,超声15 min,取出放至室温,加甲醇稀释至刻度,摇匀,3 500 r/min离心15 min,精密移取上清液5 mL于100 mL量瓶中,加水(0.1 mol/L盐酸、pH4.5醋酸盐缓冲液或pH6.8磷酸盐缓冲液)稀释至刻度,摇匀,作为供试品溶液,进样结果表明辅料在290 nm波长处不干扰结果测定。
3.1.3 线性关系考察精密称取托拉塞米对照品10 mg于50 mL量瓶中,加入适量甲醇,超声15 min,使其完全溶解,取出放至室温,加甲醇稀释至刻度摇匀。精密量取5 mL于50 mL量瓶中,加0.1 mol/L盐酸溶液稀释至刻度摇匀,配得质量浓度为20.0 μg/mL溶液,作为母液,精密移取母液0.5、1.0、2.0、3.0、4.0、5.0、6.0 mL于10 mL量瓶中,分别加0.1 mol/L盐酸溶液稀释至刻度摇匀,作为供试品溶液,照HPLC法,各进样60 μL,记录色谱图。以托拉塞米质量浓度为横坐标,峰面积为纵坐标,进行线性回归,得线性方程:A=20 756 C−1 845.1(r=0.999 5),表明本品浓度在1.0~12.0 μg/mL的范围内线性关系良好。
3.1.4 准确度试验精密称取托拉塞米原料药5、8、10、12 mg各3份,置50 mL量瓶中,向各量瓶中加入约300 mg空白辅料,加甲醇适量,超声15 min,使主药完全溶解,取出放至室温,加甲醇稀释至刻度摇匀,3 500 r/min离心10 min,精密量取上清液5 mL于100 mL量瓶中,加0.1 mol/L盐酸溶液稀释至刻度并摇匀,作为供试品溶液;另精密称取托拉塞米对照品10.0 mg,置50 mL量瓶中,加适量甲醇,超声使其溶解,取出放至室温,加甲醇稀释至刻度,摇匀。再精密量取上述溶液5 mL置100 mL量瓶中,加释放介质0.1 mol/L盐酸溶液稀释至刻度,摇匀,作为对照品溶液。照HPLC法,各进样60 μL,记录色谱图。回收率平均值为100.04%,相对标准偏差为0.54%,表明本法准确度良好。
3.1.5 精密度试验取托拉塞米自制片,照“2.3”项下释放度测定方法一,以0.1 mol/L盐酸溶液为释放介质,于1、4和12 h,取续滤液6份作为供试液,另配制对照品溶液,照HPLC法,各进样60 μL,记录色谱图并计算RSD。1、4和12 h的RSD分别为0.99%、1.41%、0.74%,表明本法精密度良好。
3.1.6 滤膜吸附试验取托拉塞米自制片,照“2.3”项下释放度测定方法一,以0.1 mol/L盐酸溶液为释放介质,于1、4和12 h时取样,分别过滤初滤液3 mL和5 mL,取续滤液适量;同时取1、4和12 h释放液适量,进行3 500 r/min离心处理,取上清液,所得上述样品作为供试品,照HPLC法,各进样60 μL,记录色谱图。1、4和12 h释放液过滤3 mL和过滤5 mL样品液与离心样品液相比较,RSD分别为1.59%、0.83%、0.87%,表明滤膜吸附对本品释放度测定无干扰。
3.1.7 溶液稳定性试验取对照品溶液于室温条件下放置,分别于0、1、2、4、8、12、24、36、48 h时测定,记录色谱图,计算峰面积RSD。对照品峰面积RSD为1.44%,表明样品溶液在48 h内稳定性良好。
3.1.8 不同转速下的释放曲线比较取自制片,以0.1 mol/L盐酸溶液500 mL为溶出介质,分别调节转速为50 r/min和75 r/min,照“2.3”项下释放度测定方法一和对照品溶液配制方法取样和配制对照品溶液,照HPLC法,于290 nm波长处测定。考察结果表明,两种转速条件下自制片的溶出行为基本一致(f2=84),差异不显著。桨法常用转速在50~100 r/min,考虑到某些患者胃肠蠕动功能较差等原因,本品释放度试验的转速选择50 r/min。
3.1.9 均一性考察取托拉塞米自制缓释片(批号140401)6片,照“2.3”项下释放度测定方法一,以0.1 mol/l盐酸溶液500 mL作为释放介质,经0.5、1、1.5、2、4、6、8、12、24 h取样,滤过,照HPLC法,各进样60 μL,记录色谱图。6个溶出杯各个取样点RSD均<10%,表明本品均一性良好。
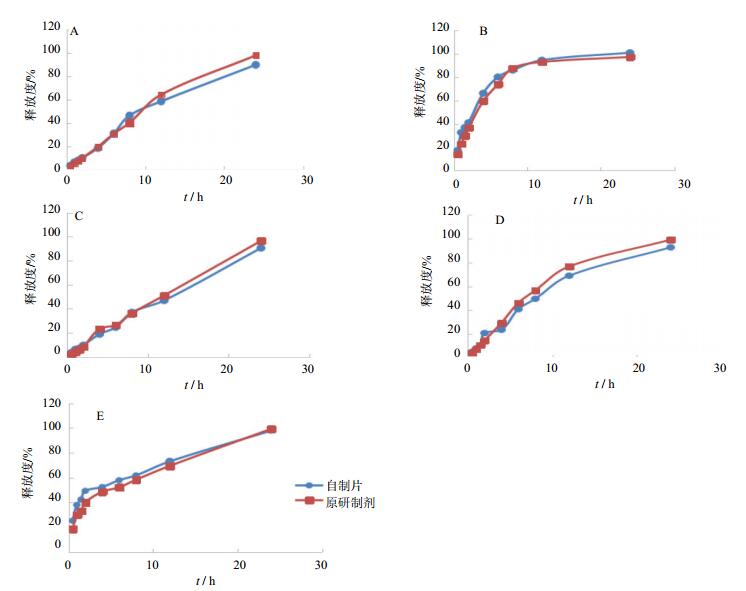
3.2 释放曲线测定结果 3.2.1 自制片与原研制剂释放曲线比较取托拉塞米缓释自制片(批号140401)与原研制剂(批号H022)各6片,照“2.3”项下释放度测定方法测定自制片与原研制剂在5种不同的释放介质中不同时间点的累积释放度,平均累积释放度结果见表 2。托拉塞米缓释自制片与原研制剂在5种不同的释放介质中的释放曲线见图 1。
| 表 2 托拉塞米自制片与原研制剂在5种介质中累积释放度结果比较 Table 2 Comparison on cumulative release percentage of self-prepared Torasemide Sustained-Release Tablet and original preparation in five kinds of release media |
|
A-水;B-0.1 mol/L盐酸溶液;C-pH4.5醋酸盐缓冲液;D-pH6.8磷酸盐缓冲液;E-0.1 mol/L盐酸溶液转pH6.8磷酸盐缓冲液 A-water; B-0.1 mol/L hydrochloric acid solution; C-pH4.5 acetate buffer; D-phosphate buffer pH6.8; E-0.1 mol/L hydrochloric acid solution to pH6.8 phosphate buffer 图 3 托拉塞米缓释自制片与原研制剂在5种不同的释放介质中的释放曲线比较 Fig. 3 Comparison on release curve of self-prepared Torasemide Sustained-Relse Tablet and original preparation in five kinds of release media |
3.2.2 自制片与原研制剂释放相似性比较
采用美国FDA推荐的相似因子(the similarity factor, f2)法[7]对托拉塞米自制缓释片(批号140401)与原研制剂(批号H022)在上述5种释放介质中的释放结果进行相似性比较,f2大于等于50时,认为受试制剂与参比制剂溶出过程相似,f2越趋于100,相似性越好。由于托拉塞米在0.1 mol/L盐酸溶液8 h时释放量已达到85%以上,因此选取1、2、4、6、8 h的释放结果进行对比,其他介质选取1、2、4、6、8、12 h的释放结果进行对比,结果见表 3。
| 表 3 自制片与原研制剂释放行为一致性比较 Table 3 Comparison on release behavior of self-prepared Torasemide Sustained-Release Tablet and original preparation |
4 结论
托拉塞米的pKa有两个:2.24和7.99,是两性物质,因此可推测其在胃、小肠、结肠均有一定的吸收。托拉塞米的半衰期为2.2~5 h,且降压作用可持续24 h,因此可设计成每24 h服用1次的缓释制剂[4]。人体胃肠道环境有很大的个体差异性,因此本研究选择托拉塞米缓释自制片与原研制剂在水、0.1 mol/L盐酸溶液、pH4.5醋酸-醋酸钠缓冲液、pH6.8磷酸盐缓冲液中的释放曲线进行比较。考虑到缓释制剂一般在胃液中2 h排空,因此增加托拉塞米缓释自制片与原研制剂在0.1 mol/L盐酸溶液转pH6.8磷酸缓冲液中的释放曲线的比较,能更全面地反映两组缓释片在人体内的实际吸收情况。
本研究通过相似因子法进行托拉塞米缓释自制片与原研制剂的释放度评价,以确定它们的相似性。受试或参比制剂的药物累积释放度在85%以上的取样点应不多于一个,否则,将会给判定结果带来误差[7]。因此选择0.1 mol/L盐酸溶液中1、2、4、6和8 h时的释放结果进行对比,其他介质选取1、2、4、6、8和12 h的释放结果进行对比,结果显示托拉塞米缓释自制片与原研制剂在水、0.1 mol/L盐酸溶液、pH4.5醋酸-醋酸钠缓冲液、pH6.8磷酸盐缓冲液以及0.1 mol/L盐酸溶液转pH6.8磷酸缓冲液中的f2均大于50,溶出行为相似,从而证明了两组缓释片内在质量相近,也为本品自制片与原研制剂将要进行的人体生物等效性试验提供了依据。
| [1] | 段志浩, 陈慧, 胡廷熹. 托拉塞米注射液临床使用注意事项与配伍禁忌[J]. 上海医药, 2015(19):53–54. |
| [2] | Ogawa R, Stachnik J M, Echizen H. Clinical pharmacokinetics of drugs in patients with heart failure:an update (part 2, drugs administered orally)[J]. Clin Pharmacokinet, 2014, 53(12):1083–1114. doi:10.1007/s40262-014-0189-3 |
| [3] | Arumugam S, Sreedhar R, Miyashita S, et al. Comparative evaluation of torasemide and furosemide on rats with streptozotocin-induced diabetic nephropathy[J]. Exp Mol Pathol, 2014, 97(1):137–143. doi:10.1016/j.yexmp.2014.06.007 |
| [4] | 吉连军.托拉塞米缓释片的研究[D].开封:河南大学, 2007. |
| [5] | 安佰平, 柴龙龙, 柳玉英. 不同厂家双氯芬酸钠缓释胶囊释放曲线比较研究[J]. 中国药业, 2016,25(13):34–36. |
| [6] | 陈加飞, 王平, 赵昕, 等. 国产与原研洛索洛芬钠片的体外溶出曲线一致性的比较[J]. 国际检验医学杂志, 2015,36(2):198–199. |
| [7] | 罗平.尼可地尔缓释片制备工艺及其体内外释药研究[D].武汉:湖北中医药大学, 2015. |
 2017, Vol. 40
2017, Vol. 40

