2. 中国农业科学院农产品加工研究所主食加工技术研究院, 黑龙江 哈尔滨 150040;
3. 聊城大学农学院食品科学与工程系, 山东 聊城 252000;
4. 哈尔滨工业大学化工学院食品科学与工程系, 黑龙江 哈尔滨 150090
2. Institute of Food Science and Technology CAAS/Institute of Staple Food Processing Technology, Harbin 151900, China ;
3. Liaocheng University, Agricultral College, Liaocheng 252000, China ;
4. Department of Food Science and Engineering, Harbin Institute of Technology, Harbin 150090, China
黑木耳Auricularia auricula(L. ex Hook.)Underw.是一种营养价值十分丰富的食用菌[1],黑木耳多糖(AAP)具有抗氧化[2]、免疫增强[3]、抗肿瘤[4]、降血糖[5]等生物活性;红松Pinus koraiensis Sieb. et Zucc.是一种分布于中国东北地区的松科植物[6],松多酚(PKP)具有强抗氧化活性[7];茶多酚(tea polyphenols,TP)是茶叶中的主要生物活性物质[8],具有突出的抗氧化性能和显著的清除自由基能力。通常认为60Coγ辐射对机体的直接伤害是引起DNA损伤,但身体中主成分水会因辐射发生链式反应生成自由基,进而攻击机体产生损伤[9],并可能进一步引起DNA损伤[10]。随着经济的发展,人类不仅受到地壳中放射性核素和宇宙射线等天然辐射的影响,还受到医疗、日常生活中所触及的电器等人工辐射的伤害,因此对辐射氧化损伤的修复是很有必要的。研究发现[11],联合使用抗氧化剂可能发生协同或拮抗作用,使抗氧化效果大于或小于单一抗氧化剂。因此有必要研究抗氧化剂之间的协同增效作用,寻找合理、高效的抗氧化剂进行协同。根据已有预实验,本实验研究PKP和AAP的协同作用,探讨其对辐射引起的氧化损伤的修复作用,考虑到实际应用,选择TP作为阳性药进行对比。
1 材料 1.1 药材及主要试剂黑木耳,购自哈尔滨市南极市场,经王振宇教授鉴定为木耳科木耳属木耳Auricularia auricula(L. ex Hook.)Underw.的子实体;红松采自大兴安岭,经王振宇教授鉴定为松科松属红松Pinus koraiensis Sieb. et Zucc.的球果。
没食子酸标准品(质量分数>99.0%,批号NACC60010),天津百伦斯生物技术有限公司;TP,由总后军需生产技术研究所提供,绿茶提取物,质量分数≥80%。
维生素C(VC)、谷胱甘肽(GSH)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和考马斯亮兰蛋白试剂盒,南京建成生物工程中心;大鼠辅酶Q10(CoQ10)酶联免疫检测试剂盒,上海博耀生物科技有限公司;D-Hanks洗液、RPMI-1640培养液、红细胞裂解液、低熔点琼脂糖、Triton x-100,北京索莱宝科技有限公司;正常熔点琼脂糖,香港基因(GENE)有限公司;溴化乙锭(EB),北京博奥拓达科技有限公司;Tris、Tris-HCl,美国Sigma公司;肌氨酸钠,上海源叶生物有限公司;葡萄糖、苯酚、硫酸、福林酚等试剂均为国产分析纯。
1.2 动物昆明种小鼠,体质量(27±2)g,由黑龙江中医药大学提供,许可证号SYXK(黑)2013-012。
1.3 主要仪器ALC-110.4分析天平,德国艾科勒ACCULAB公司;LEICA DM4000B正置智能荧光显微镜,德国韦茨拉尔·徕卡公司;721分光光度计,上海精密科学仪器有限公司;TGL-16G台式离心机,上海安亭科学仪器厂;MODEL 550酶标仪,美国Bio-rad公司;DYY-5D型电泳仪,北京六一仪器厂。
2 方法 2.1 AAP和PKP的提取分别取黑木耳子实体和红松球果进行机械粉碎得到黑木耳粉和红松球果粉,过80目筛,筛下粉备用。先后用石油醚、醋酸乙酯以1:4的比例浸泡24 h除去其中粗脂肪。去除脂肪后分别用0.1 mol/L NaOH以1:50的料液比,80 ℃、机械搅拌2 h,提取AAP;70%乙醇以1:25的料液比,50 ℃、浸提2 h,提取PKP;离心得上清液,重复提取2次,合并2次提取液。分别在80、50 ℃低压浓缩,黑木耳多糖液缓慢加入4倍体积的无水乙醇,于4 ℃低温放置24 h,收集析出的粗多糖。粗多酚经大孔树脂D101梯度洗脱,纯化得到50%乙醇洗脱片段。最后分别以−70~−80 ℃、0.1~1 MPa进行冻干,干燥粗多糖和粗多酚备用。
2.2 AAP中多糖、PKP和TP中多酚水平检测参考NY/T16762008食用菌粗多糖[12]测定AAP中多糖水平,参考GB/T8313200茶叶中多酚和儿茶素[13]测定PKP和TP中多酚水平。结果显示,AAP含多糖为(81.28±2.54)%,PKP和TP中含多酚分别为(48.30±1.36)%和(84.40±2.24)%。
2.3 分组、给药及模型的制备取60只小鼠,雌雄各半,随机区组设计法分成对照组、模型组、AAP组、PKP组、AP组(AAP与PKP协同组)及TP组(阳性药),每组10只。分组后1 d开始称小鼠体质量,随后每3天称1次。适应性饲养一周后,采用60Coγ射线一次性全身均匀照射,总吸收量4.0 Gy,剂量率1 Gy/min建立辐射模型(对照组除外)。
根据预实验选择最佳剂量,约为半数致死剂量(LD50)百分之一,AAP组ig 75.0 mg/kg(以多糖水平计)AAP,PKP组ig 25.0 mg/kg(以多酚水平计)PKP,AP组ig 37.5 mg/kg AAP+12.5 mg/kg PKP(以多糖、多酚水平计),TP组ig 25.0 mg/kg(以多酚水平计)TP,对照组和模型组ig生理盐水。每天给药1次,连续给药30 d。
给药结束后禁水禁食24 h,称体质量,摘眼球取血,收集血样后2 000 r/min离心10 min,取上层血清备用。脱臼处死,摘取处死后小鼠的脾脏、肝脏、心脏,按1:9的比例加入生理盐水,冰水浴机械匀浆,2 000 r/min离心10 min,取上清液为10%组织匀浆备用。
2.4 抗氧化物质水平和抗氧化酶系活性的测定测定“2.3”项血清及组织匀浆中VC、GSH、CoQ10、MDA、SOD、GSH-Px水平,严格按照试剂盒说明书操作。
2.5 单细胞凝胶电泳(彗星电泳)实验颈椎脱臼处死小鼠后于无菌状态下取出脾脏,用细胞筛网提取脾细胞,加入裂解液去除红细胞,加入适量体积的RPMI-1640培养液得到脾细胞培养液。将1.5%正常熔点琼脂糖(NMPA)凝胶铺于载玻片磨砂面上,小心盖好盖玻片于4 ℃静置10 min后去除盖玻片,取脾细胞悬液和1.0%低熔点琼脂糖(LMPA)凝胶混合液(体积比为1:3),铺于第一层胶上,小心盖好盖玻片于4 ℃静置30 min。凝胶固定后去除盖玻片,于细胞裂解液中4 ℃避光裂解60 min。然后将载玻片水平置于电泳槽中,靠近正极,加入电泳缓冲液避光条件静置30 min后调节电压25 V,电流量300 mA,低温避光电泳30 min。结束后取出载玻片,使用Tris-HCl溶液中和2次,每次15 min。避光晾干后用EB避光染色,避光置于荧光显微镜下观察(滤过波长为590 nm;目镜10×,物镜40×)。随机计数100个细胞,记录彗星尾长。
2.6 统计与分析采用SPSS 17.0统计软件进行统计分析,结果以x±s表示,组间差异采用单因素方差(ANOVA)LSD法分析。
3 结果 3.1 对小鼠体质量的影响如表 1所示,分组后1 d(辐射前6 d)到辐射后30 d的体质量变化,辐射当天体质量于辐射前1 h称取。除对照组外,其他组小鼠体质量在辐射后明显下降(P<0.01),随着给药天数的增加,小鼠的体质量逐渐呈上升趋势。各组与对照组比较,ig AP组使体质量恢复最快,辐射后18 d与模型组比较差异显著(P<0.05),说明开始明显恢复;而TP组与模型组差异不显著。
| 表 1 辐射后给药对小鼠体质量的影响(x±s, n=10) Table 1 Effect on body weight of mice (x±s, n=10) |
3.2 对小鼠MDA水平的影响
MDA是机体膜脂质过氧化最重要的产物,可以通过测定MDA水平了解膜脂过氧化程度[15]。与对照组比较,模型组小鼠在辐射作用下,血清、肝脏、脾脏、心脏中MDA水平均显著升高(P<0.01),表明辐射会明显诱导小鼠形成氧化伤害,且在30 d内不能消除。辐射后给药AP和TP,血清、肝脏、脾脏、心脏中MDA水平与对照组无显著差异,与模型组差异显著(P<0.01);给药AAP和PKP,与模型组比较差异显著(P<0.05、0.01);说明对辐射后小鼠血清、肝脏、脾脏、心脏中MDA水平进行了显著的修复。对比辐射后给药AAP、PKP和AP,给药AP组辐射后小鼠血清、肝脏、脾脏、心脏中MDA水平与对照组差异较小,与模型组差异更大;运用Chou-Talalay联合用药理论证明AAP和PKP联合指数CI<1,可以推测AP组修复效果更优。结果见表 2。
| 表 2 辐射后给药对小鼠血清和器官中MDA水平的修复(x±s, n=10) Table 2 Recovery of MDA contents in serum and organs of mice (x±s, n=10) |
3.3 对小鼠抗氧化物质水平的影响
与对照组比较,模型组血清、肝脏、脾脏、心脏中VC、GSH、CoQ10水平均显著降低(P<0.01),表明辐射会明显诱导小鼠体内抗氧化物质损伤,且在30 d内不能消除。辐射后给药AP和TP,血清、肝脏、脾脏、心脏中VC、GSH、CoQ10水平与对照组无显著差异,与模型组差异显著(P<0.01);说明给药AP和TP对辐射后小鼠血清、肝脏、脾脏、心脏中VC、GSH、CoQ10水平进行了显著的修复。对比辐射后给药AAP、PKP和AP,给药AP组辐射后小鼠血清、肝脏、脾脏、心脏中VC、GSH、CoQ10水平与对照组差异较小,与模型组差异更大;运用Chou-Talalay联合用药理论证明AAP和PKP联合指数CI<1,说明AP组修复效果较好。结果见表 3~5。
| 表 3 辐射后给药对小鼠血清和器官中VC水平的修复(x±s, n=10) Table 3 Recovery of content of VC in serum and organs of mice (x±s, n=10) |
| 表 4 辐射后给药对小鼠血清和器官中GSH水平的修复(x±s, n=10) Table 4 Recovery of GSH contents in serum and organs of mice (x±s, n=10) |
| 表 5 辐射后给药对小鼠血清和器官中CoQ10水平的修复(x±s, n=10) Table 5 Recovery of CoQ10 contents in serum and organs of mice (x±s, n=10) |
3.4 对小鼠抗氧化酶类活性的影响
与对照组比较,模型组小鼠在辐射作用下,血清、肝脏、脾脏(P<0.01)、心脏(P<0.05)中SOD活性显著降低;血清中GSH-Px活性显著降低(P<0.05),表明辐射会显著降低血清、肝脏和脾脏抗氧化酶系活性,对心脏中抗氧化酶系活性影响相对较小,且在30 d内不能消除。辐射后给药AP和TP,血清、肝脏、脾脏中SOD活性与对照组比较差异不显著(P>0.05),与模型组比较,差异极显著(P<0.01),说明给药AP和TP对辐射后小鼠血清、肝脏、脾脏中SOD活性进行了显著的修复;血清中GSH-Px活性与对照组比较无显著差异(P>0.05),与模型组差异显著(P<0.05),说明给药AP和TP对辐射后小鼠血清中GSH-Px活性进行了显著修复。对比辐射后给药AAP、PKP和AP,AP组辐射后小鼠血清、心脏中SOD活性,血清、肝脏、脾脏、心脏中GSH-Px活性与对照组差异较小,与模型组差异更大;运用Chou-Talalay联合用药理论证明AAP和PKP联合指数CI<1,说明AP组修复效果较好。结果见表 6、7。
| 表 6 辐射后给药对小鼠血清和器官中SOD活性的修复(x±s, n=10) Table 6 Recovery of SOD activities in serum and organs of mice (x±s, n=10) |
| 表 7 辐射后给药对小鼠血清和器官中GSH-Px活性的修复(x±s, n=10) Table 7 Recovery of GSH-Px activities in serum and organs of mice (x±s, n=10) |
3.5 对小鼠脾细胞DNA损伤的影响
彗星电泳是评价DNA损伤的一种快捷灵敏的研究方法[14]。彗星电泳的“尾巴”与DNA损伤有极高的相关性(损伤DNA具备一定的修复和存活力)[15],其大小和形态的不同说明了脾细胞DNA损伤程度的不同:尾部较短说明细胞DNA受损较轻,尾部越长说明受损越严重,进一步反映辐射对DNA造成的氧化损伤[16]。如图 1所示,对照组彗星几乎没有“尾巴”,而模型组“尾巴”长;AAP、PKP、AP、TP组也有一定长度的“尾巴”。彗星亮度也会一定程度上反应DNA受损程度,中心DNA水平越低,其彗星亮度越低。对照组彗星亮,而模型组黯淡;AAP、PKP、AP、TP不如对照组亮,但比较模型组都亮。

|
图 1 小鼠脾细胞彗星电泳荧光显微镜照片 Fig. 1 Fluorescence microscope photos of splenocyte using single cell gel electrophoresis assay |
如图 2所示,与对照组比较,模型组彗星尾长度显著增加(P<0.01),说明辐射造成脾细胞DNA严重损伤,且在30 d内不能消除。与模型组和对照组比较,辐射后给药AAP、PKP、AP和TP彗星尾长度有极显著差异(P<0.01),但比较辐射后给药AAP、PKP,AP和TP组彗星尾长度明显降低,说明其效果较好。
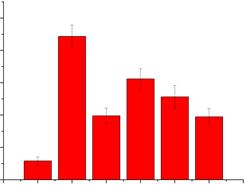
|
与对照组比较:**P<0.01;与模型组比较:##P<0.01 **P < 0.01 vs control group; ##P < 0.05 vs model group 图 2 TP、AAP、PKP和AP对小鼠脾细胞彗星尾长度的影响(x±s, n=10) Fig. 2 Effect of TP, AAP, PKP, and AP on comet tail lengths of mice (x±s, n=10) |
4 讨论
通常认为,电离辐射的生物学影响主要是DNA损伤和其他胞内生物大分子的损伤[17]。当机体受到电离辐射,会直接损伤胞内DNA[18],进而引起细胞凋亡。电离辐射会直接电离DNA或与周围水分子反应诱发自由基(·OH、e-•、H•)损伤[19],因此γ射线会引起DNA氧化损伤[20],造成DNA双键断裂、单键断裂和碱基损伤。同时电离辐射产生的·OH自由基与胞内膜脂质在有氧条件下发生过氧化反应、链式反应最终生成MDA[21],MDA水平的增加会间接说明机体细胞受到了自由基损伤;另外MDA与DNA作用会生成烷基化DNA加合物,从而抑制DNA复制[22]。γ射线影响蛋白质、核酸和复合脂类[23],产生活性氧簇(ROS)及活性氮簇(RNS)自由基[24]。为应对这种氧化损伤,细胞通常会激活细胞内和细胞外抗氧化系统,包括酶和非酶系统,包括SOD、GSH-Px、CAT、还原酶和VC、VE、胡萝卜素、CoQ10、GSH等。
TP是茶叶中多酚类物质的总称,主要为儿茶素类,其中表没食子儿茶素没食子酸酯(EGCG)是抗氧化活性最强的物质[25-26]。TP是公认的具有较强抗氧化作用的物质[27]。TP会显著升高小鼠血清中超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶的水平,提升血浆中GSH水平,降低血清MDA水平[28]。PKP最早被研究的是碧萝芷,是一种从法国海岸松树皮中提取的专利植物化学成分[29]。PKP是单体酚类(儿茶素、表儿茶素和花旗松素)和缩合黄酮(原花青素)的混合体;此外还含有微量的酚酸(如对羟基苯甲酸、原儿茶酸、没食子酸、香草酸、对香豆酸、咖啡酸和阿魏酸)和糖基化产物(黄酮醇或酚酸的吡喃葡萄糖衍生物)作为微量成分[30]。PKP可减少小鼠各脏器中MDA水平,提高CAT、LDH、SOD、GSH-Px活性,增加GSH的水平[7, 31]。AAP由葡萄糖、阿拉伯糖、木糖、甘露糖、岩藻糖和葡萄糖醛酸等单糖组成,能够提高小鼠血清和肝组织中SOD、GSH-Px、CAT酶活性,降低MDA水平[1, 32]。研究表明多种抗氧化剂联合使用的效果可能要大于单一抗氧化剂[11],即可能具有抗氧化协同作用。抗氧化剂协同作用的原理可能是复合抗氧化剂之间通过氧化还原循环相互还原或再生,从而提高总抗氧化活性[33];也可能是多种抗氧化剂基于氧化还原电位差的偶联氧化,降低直接反应的两种抗氧化剂间的电位落差,使反应易于进行[34]。有研究[35-36]发现白藜芦醇、原花青素与黑木耳多糖对体外ABTS+•和DPPH•具有协同清除能力,咖啡酸、儿茶素分别与黑木耳多糖也同样具有协同抗氧化作用。但对植物多酚和真菌多糖对体内协同抗氧化的研究还很少。
本研究中小鼠辐射后体质量明显下降,说明辐射对小鼠产生了严重的机体损伤,使小鼠组织等受到氧化伤害,细胞周期停滞。TP和PKP对恢复体质量作用较小,可能是多酚类物质对胃肠道有一定的刺激;AP对体质量恢复介于PKP和AAP之间,可能是AP一定程度上缓解了PKP带来的胃肠不适[37]。小鼠在辐射作用下,各器官中VC、GSH、CoQ10水平降低,SOD、GSH-Px活性降低,MDA水平升高,彗星尾长度显著增加,并在30 d内不能消除此损伤。辐射后给药PKP、AAP、AP和TP都会一定程度上升高VC、GSH、CoQ10水平,升高SOD、GSH-Px活性,降低MDA水平,减小DNA彗星尾长度,从而反映了对辐射后产生的氧化损伤进行修复。Singh等[38]用彗星实验监测辐射后细胞,发现DNA碎片会随时间延长而减少。说明细胞DNA在辐射后有一定的自我修复能力,尤其是单键断裂能更快修复且更无差错[39],而对比辐射后给药AAP、PKP和AP,AP组对辐射后修复效果较优,说明AAP和PKP在修复辐射后抗氧化损伤有一定协同作用。对比辐射后给药AP和TP,发现在修复辐射后抗氧化酶系和抗氧化物质损伤及脾细胞彗星尾长度上没有显著差异,结合对辐射后小鼠体质量的影响,可以发现AP对辐射后修复效果较优。电离辐射造成的损伤是多途径的,联合使用多糖和多酚可能针对多种途径,协同发挥修复抗氧化系统的功能,在不造成任何毒性下还能有效修复辐射产生的氧化损伤,这为多糖和多酚的开发利用提供了一个新的方向。
本研究表明,比较单一使用AAP和PKP,AP更能显著提高VC、GSH、CoQ10的水平,提高SOD、GSH-Px活性,降低MDA水平,有效清除机体由辐射氧化损伤产生的过量自由基;降低脾细胞彗星尾长度,修复自由基对DNA造成的损伤。对比TP,AP不仅能够很好的恢复体质量,更能很好的修复辐射产生的氧化损伤。联合使用AAP和PKP是对二者应用的一种新方向,据此可以继续开发一种复合功能食品,这在食品保健等研究领域具有广阔的应用前景。
| [1] | 张华.黑木耳中性多糖片段硫酸酯对辐射诱导氧化应激防护作用[D].哈尔滨:哈尔滨工业大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10213-1013045074.htm |
| [2] | Khaskheli S G, Zheng W, Saghir A S, et al. Characterization of Auricularia auricula polysaccharides and its antioxidant properties in fresh and pickled product[J]. Int J Bio Macromol, 2015, 81:387–395. doi:10.1016/j.ijbiomac.2015.08.020 |
| [3] | Wang D Y, Hu Y L, Fan Y P, et al. Immuno-enhancing activity of sulfated Auricularia auricula polysaccharides[J]. Carbohydr Polym, 2012, 89(4):1117–1122. doi:10.1016/j.carbpol.2012.03.082 |
| [4] | Song G L, Du Q Z. Isolation of a polysaccharide with anticancer activity from Auricularia polytricha using high-speed countercurrent chromatography with an aqueous two-phase system[J]. J Chromatogr A, 2010, 1217(38):5930–5934. doi:10.1016/j.chroma.2010.07.036 |
| [5] | 尹红力, 赵鑫, 佟丽丽, 等. 黑木耳多糖体外和体内降血糖功能[J]. 食品科学, 2015,36(21):221–226. |
| [6] | 刘冉, 王振宇, 崔杰, 等. 前体物质和诱导子对红松松多酚合成的影响[J]. 北京林业大学学报, 2013,35(5):22–27. |
| [7] | 黄雨洋.红松多酚分离鉴定及抗氧化抗癌功能研究[D].哈尔滨:东北林业大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10225-1014411651.htm |
| [8] | 桑红源, 王蕾. 茶多酚的开发与利用[J]. 科技信息:科学教研, 2007,24:44–45. |
| [9] | Thotala D, Chetyrkin S, Hudson B, et al. Pyridoxamine protects intestinal epithelium from ionizing radiation-induced apoptosis[J]. Free Radical Bio Med, 2009, 47(6):779–785. doi:10.1016/j.freeradbiomed.2009.06.020 |
| [10] | Cadet J, Wagner J R. Oxidatively generated base damage to cellular DNA by hydroxyl radical and one-electron oxidants:Similarities and differences[J]. Arch Biochem Biophys, 2014, 557:47–54. doi:10.1016/j.abb.2014.05.001 |
| [11] | Bai H, Liu R, Chen H L, et al. Enhanced antioxidant effect of caffeic acid phenethyl ester and Trolox in combination against radiation induced-oxidative stress[J]. Chem-Biol Interact, 2014, 207(25):7–15. |
| [12] | 食用菌粗多糖测定[S]. 2013. |
| [13] | 茶叶中多酚和儿茶素测定[S]. 2015. |
| [14] | Mustapha N. Aqueous extract of Crataegus azarolus protects against DNA damage in human lymphoblast Cell K562 and enhances antioxidant activity[J]. Appl Biochem Biotech, 2014, 172(4):2266–2275. doi:10.1007/s12010-013-0667-3 |
| [15] | Lorenzo Y, Costa S, Collins A R, et al. The comet assay, DNA damage, DNA repair and cytotoxicity:hedgehogs are not always dead[J]. Mutagenesis, 2013, 28(4):427–432. doi:10.1093/mutage/get018 |
| [16] | Collins A, Koppen G, Valdiglesias V, et al. The comet assay as a tool for human biomonitoring studies:The ComNet Project[J]. Mutat Res-Rev Mutat, 2014, 759:27–39. doi:10.1016/j.mrrev.2013.10.001 |
| [17] | Halliwell B, Aruoma O I. DNA-damage by oxygenderived species Its mechanism and measurement in mammalian systems[J]. FEBS Lett, 1991, 281(1-2):9–19. doi:10.1016/0014-5793(91)80347-6 |
| [18] | Saberi A, Salari E, Latifi S M. Cytogenetic analysis in lymphocytes from radiation workers exposed to low level of ionizing radiation in radiotherapy, CT-scan and angiocardiography units[J]. Mutat Res-Gen Toxi En, 2013, 750(1-2):93–95. |
| [19] | Karbownik M, Reiter R J. Antioxidative effects of melatonin in protection against cellular damage caused by ionizing radiation[J]. P Soc Exp Biol Med, 2000, 225(1):9–22. doi:10.1046/j.1525-1373.2000.22502.x |
| [20] | Sudprasert W, Navasumrit P, Ruchirawat M. Effects of low-dose gamma radiation on DNA damage, chromosomal aberration and expression of repair genes in human blood cells[J]. Int J Hyg Envir Hea, 2006, 209(6):503–511. doi:10.1016/j.ijheh.2006.06.004 |
| [21] | Pandey B N, Mishra K. Fluorescence and ESR studies on membrane oxidative damage by γ-radiation[J]. Appl Magn Reson, 2000, 18(4):483–492. doi:10.1007/BF03162295 |
| [22] | Tortosa R, Rovira P S, Tortosa M R. New advances in molecular mechanisms and the prevention of adriamycin toxicity by antioxidant nutrients[J]. Food Chem Toxicol, 2010, 48(6):1425–1438. doi:10.1016/j.fct.2010.04.007 |
| [23] | Einor D, Alquati A B, Costantini D, et al. Ionizing radiation, antioxidant response and oxidative damage:A meta-analysis[J]. Sci Total Environ, 2016, 548-549:463–471. doi:10.1016/j.scitotenv.2016.01.027 |
| [24] | Bursal E, Gülcin I. Polyphenol contents and in vitro antioxidant activities of lyophilised aqueous extract of kiwifruit (Actinidia deliciosa)[J]. Food Res Int, 2011, 44(5):1482–1489. doi:10.1016/j.foodres.2011.03.031 |
| [25] | Naldi M, Fiori J, Gotti R, et al. UHPLC determination of catechins for the quality control of green tea[J]. J Pharmaceut Biome, 2014, 88:307–314. doi:10.1016/j.jpba.2013.08.054 |
| [26] | Zimmermann B F, Gleichenhagen M. The effect of ascorbic acid, citric acid and low pH on the extraction of green tea:how to get most out of it[J]. Food Chem, 2011, 124(4):1543–1548. doi:10.1016/j.foodchem.2010.08.009 |
| [27] | 张晓梦, 倪艳, 李先荣. 茶多酚的药理作用研究进展[J]. 药物评价研究, 2013,36(2):157–160. |
| [28] | Wang D X, Wang Y J, Wan X C, et al. Green tea polyphenol (-) -epigallocatechin-3-gallate triggered hepatotoxicity in mice:Responses of major antioxidant enzymes and the Nrf2 rescue pathway[J]. Toxicol Appl Pharm, 2015, 283(1):65–74. doi:10.1016/j.taap.2014.12.018 |
| [29] | Ni Z, Mu Y, Gulati O. Treatment of melasma with Pycnogenol[J]. Phytother Res, 2002, 16(6):567–571. doi:10.1002/ptr.1085 |
| [30] | Figuero E, Soory M, Cerero R, et al. Oxidant/antioxidant interactions of nicotine, Coenzyme Q10, Pycnogenol and phytoestrogens in oral periosteal fibroblasts and MG 63 osteoblasts[J]. Steroids, 2006, 71(13-14):1062–1072. doi:10.1016/j.steroids.2006.09.003 |
| [31] | 王东.松多酚微球的制备及其对~(60)Co-γ射线辐射防护作用的研究[D].哈尔滨:哈尔滨工业大学, 2015. |
| [32] | 张宁.黑木耳分级多糖制备及抗氧化研究[D].哈尔滨:东北林业大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10225-1011146488.htm |
| [33] | Zhou B, Wu LM, Yang L, et al. Evidence for α-tocopherol regeneration of green tea polyphenols in SDS micelles[J]. Free Radical Bio Med, 2005, 38(1):78–84. doi:10.1016/j.freeradbiomed.2004.09.023 |
| [34] | 胡秀芳, 毛建妹, 蒋丽萍, 等. 茶多酚与其他抗氧化剂的协同作用[J]. 茶叶, 2000,26(2):66–69. |
| [35] | 白海娜, 王振宇, 李辉, 等. 五种浆果多酚与黑木耳多糖复合物的辐射防护作用[J]. 食品工业科技, 2013,16:117–120. |
| [36] | 白海娜, 王振宇, 张华, 等. 多酚类化合物与黑木耳多糖协同抗氧化作用研究[J]. 食品工业科技, 2013,34(22):124–127. |
| [37] | 蒋忠平. 黑木耳的保健功效[J]. 农村新技术, 2012,07:41. |
| [38] | Singh N P, McCoy M T, Tice R R, et al. A simple technique for quantitation of low levels of DNA damage in individual cells[J]. Exp Cell Res, 1988, 175:184–191. doi:10.1016/0014-4827(88)90265-0 |
| [39] | Jeggo P A. A break is not the End; insight into the damage response to DNA double strand breaks[J]. DNA Repair, 2010, 9(12):1217–1218. doi:10.1016/j.dnarep.2010.09.021 |
 2016, Vol. 39
2016, Vol. 39


