2. 成都中医药大学药学院, 四川 成都 611137
2. Pharmacy College, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
宫颈癌是全世界女性第2大常见恶性肿瘤,据估计我国每年有宫颈癌新发病例13.15万,占世界新发病例总数的1/4以上,每年有超过5万患者死亡[1]。侵袭转移是宫颈癌导致患者死亡的重要原因,其扩散途径主要包括直接蔓延和淋巴结转移,仅淋巴结转移就可达19.7%[2],目前并无理想的治疗方法。本实验室前期从蔓荆子中分离得到一个黄酮类化合物紫花牡荆素(casticin,CAT),本研究旨在探讨其是否发挥对宫颈癌HeLa和SiHa细胞诱导凋亡和抑制侵袭转移的作用,以初步评价其临床应用价值。
1 材料 1.1 细胞人宫颈癌HeLa细胞和人子宫颈鳞癌SiHa细胞,均购自南京凯基生物科技发展有限公司。
1.2 药物及主要试剂蔓荆子,购自上海康桥中药饮片有限公司,经中国人民解放军第二军医大学药学院生药学教研室辛海量教授鉴定为马鞭草科植物单叶蔓荆Vitex trifolia L. var. simplicifolia Cham.的果实。参照文献方法[3],采用硅胶柱色谱法从蔓荆子中提取分离化合物CAT备用,质量分数为98.1%。实验前用DMSO溶解,再用培养液稀释至所需浓度(终浓度<0.5%)。
磷酸缓冲液(PBS)、胎牛血清(FBS),美国Hyclone公司;DMEM细胞培养液、二甲基亚砜(DMSO)、四甲基噻唑盐(MTT)、0.25%胰酶和基质胶,美国Sigma公司;链霉素、青霉素双抗液,碧云天生物研究所;罗丹明123,上海翊圣生物科技有限公司。
1.3 主要仪器CKX41倒置显微镜(日本Olympus公司);MCO-15AC CO2恒温培养箱(日本Sanyo生物医学电器公司);Anke TGL-16G台式离心机(上海安亭科学仪器厂);SW-CJ-2FD双人单面超净工作台(苏州空气净化设备厂);Gallios流式细胞仪(美国贝克曼公司)。
2 方法 2.1 细胞培养HeLa和SiHa细胞在含10% FBS、1%链霉素和青霉素双抗液的DMEM细胞培养液中培养,37 ℃、5%的CO2和饱和湿度条件下传代,每2 d换培养液1次,细胞生长成片,相互融合铺满瓶底约80%时进行传代。
2.2 细胞活力测定参照文献方法[4],取对数生长期HeLa和SiHa细胞,0.25%不含EDTA胰酶消化,加入新鲜培养液吹打,调整细胞浓度为2×104/mL,每孔100 μL接种于96孔板中,培养12 h,至细胞铺满板底80%时弃去培养液,加入含不同浓度CAT的培养液(将CAT以全培养基溶解,配制成2.5、5.0、7.5、10.0、20.0 μmol/L),对照组加入无CAT的培养液,每组做6个复孔。
分别于12、24 h进行MTT活性检测。每孔加入0.5%的MTT液20 μL,继续培养4 h后弃上清液,加入150 μL DMSO,振荡10 min。在570 nm波长下,自动酶联免疫分析仪测定吸光度(A)值。
2.3 线粒体膜电位(MMP)的测定将SiHa细胞以5×105/mL浓度接种于6孔板中,每孔2 mL。CAT组加入含5.0、7.5、10.0和20.0 μmol/L CAT的全培养液,对照组加入无CAT的培养液,孵育12 h。吸取培养液备用,胰酶消化,吸弃胰酶,加培养液终止,用1 mL枪头轻轻吹打,至细胞成悬浮状。将细胞悬浮液转移至离心管中,2000 r/min离心5 min,弃培养液。经PBS缓冲液洗涤后加入1 μg/mL的罗丹明123 0.5 mL,37 ℃培养箱内孵育20 min。流式细胞仪检测MMP。
2.4 细胞迁移实验参照文献方法[5],采用划痕试验法观察CAT对细胞迁移能力的影响。将HeLa和SiHa细胞以1×106/mL接种于6孔板,每孔2 mL。待细胞覆盖率达到95%时,用10 μL无菌枪头在孔中央划十字交叉线,PBS洗3次。CAT组加入含1.25和2.5 μmol/L CAT的低浓度血清培养液(含0.5% FBS),对照组加入0.5% FBS培养液。培养12 h弃去培养液,PBS清洗,4%多聚甲醛固定15 min,倒置显微镜下观察十字交叉中心附近,随机选5个视野记录细胞数,以对照组为对照,计算迁移百分比。
2.5 细胞黏附实验将基质胶30 μL加入96孔培养板中,干燥1 h后,37 ℃的PBS液小心冲洗2次,每孔加入含1% FBS的PBS 100 μL,培养箱中孵育1 h,再以PBS液200 μL冲洗两次。HeLa和SiHa细胞用2.5 μmol/L CAT全培养液(对照组加入无CAT的培养液)预处理12 h后,用无血清DMEM培养液制成5×105/mL细胞悬液,加入96孔培养板中,每孔100 μL,培养箱中孵育0.5、1、1.5 h。培养结束后,缓慢吸出培养液,PBS小心冲洗未黏附的细胞2次,加入含2% FBS的DMEM培养液200 μL,MTT法测定A值。以CAT组A值/对照组A值计算黏附率。
2.6 细胞侵袭实验细胞体外侵袭实验采用Transwell小室进行。将HeLa和SiHa细胞用2.5 μmol/L CAT预处理12 h,胰酶消化后配制成5×105/mL的单细胞悬液,加入侵袭小室上层,每孔100 μL,下方小室放置500 μL含20% FBS的DMEM培养液。37 ℃孵育8 h后,取出小室,用湿润棉签擦去底部的基质胶和细胞,甲醛固定10 min,常规HE染色后于200倍光学显微镜下计数膜背面侵袭的细胞数,计数中间和四周5个视野,计算平均数。
2.7 Western blotting法检测nm23-H1和MTA1蛋白表达将5×105/mL浓度的SiHa细胞接种于6孔板中,每孔2 mL。孵育12 h后,CAT组加入含1.25和2.5 μmol/L的CAT培养液,对照组加入无CAT的培养液,继续孵育24 h。收集细胞,参照文献方法[6]进行nm23-H1和MTA1蛋白的表达分析。
2.8 统计学方法数据均以$\bar x \pm s$表示,采用SPSS 15.0统计学软件进行数据分析,多组间比较采用方差分析,两组间比较采用t检验。
3 结果 3.1 对细胞活力的影响本实验考察了5个不同给药浓度(2.5、5、7.5、10、20 μmol/L)和2个不同时间点(12、24 h)CAT对HeLa和SiHa细胞活力的影响。给药浓度大于等于5 μmol/L时,细胞活力被显著抑制,且随给药时间的延长抑制作用愈加明显,与对照组比较差异显著(P<0.01)。结果见图 1。
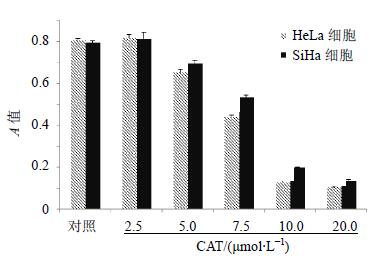
|
图 1 CAT对宫颈癌细胞活力的影响($\bar x \pm s$,n=6) Fig. 1 Effects of CAT on cell viability of HeLa and SiHa cells($\bar x \pm s$,n=6) |
3.2 对SiHa细胞MMP的影响
流式细胞仪检测结果显示,药物作用12 h后,SiHa细胞相对荧光强度明显降低,与对照组比较差异显著(P<0.01)。表明CAT降低了MMP,诱导了细胞凋亡。结果见图 2。
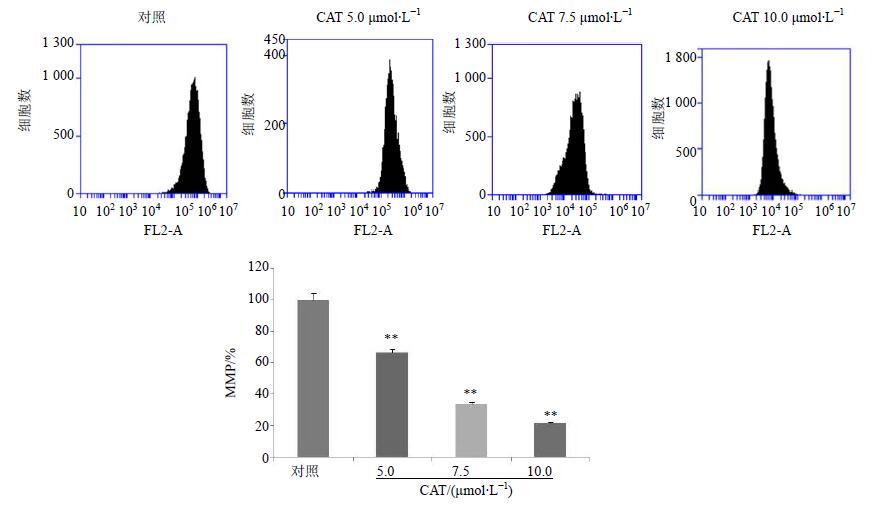
|
图 2 CAT降低SiHa细胞MMP($\bar x \pm s$,n=3) Fig. 2 CAT decreases MMP in SiHa cells($\bar x \pm s$,n=3) |
3.3 对HeLa和SiHa细胞黏附能力的影响
给药组与对照组比较,黏附细胞数明显减少。结果显示,HeLa和SiHa细胞经CAT(2.5 μmol/L)预处理24 h后,黏附能力显著降低(P<0.01)。结果见图 3。
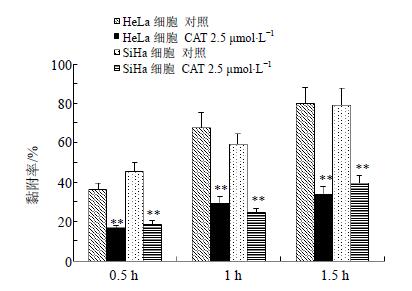
|
图 3 CAT对HeLa和SiHa细胞黏附能力的影响($\bar x \pm s$,n=6) Fig. 3 Effects of CAT on adhesion ability of HeLa and SiHa cells($\bar x \pm s$,n=6) |
3.4 对HeLa和SiHa细胞侵袭能力的影响
细胞在一定时间内穿过基质胶的数量可反映其侵袭能力。结果显示,2.5 μmol/L CAT预处理12 h后,HeLa和SiHa细胞穿过基质胶的数目显著降低,与对照组比较差异显著(P<0.01),结果见图 4。
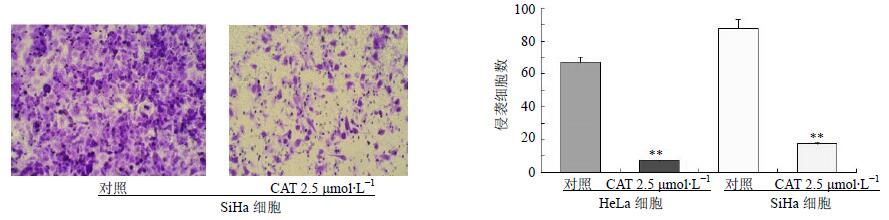
|
图 4 对HeLa和SiHa细胞侵袭能力的影响($\bar x \pm s$,n=6) Fig. 4 Effects of CAT on invasion ability of HeLa and SiHa cells($\bar x \pm s$,n=6) |
3.5 对HeLa和SiHa细胞迁移能力的影响
划痕实验结果显示,经CAT处理12 h后HeLa和SiHa细胞迁移能力显著降低,与对照组比较,细胞迁移数量显著减少,迁移率显著降低,差异显著(P<0.01),且呈剂量相关性,结果见图 5。

|
图 5 对HeLa和SiHa细胞迁移能力的影响($\bar x \pm s$,n=5) Fig. 5 Effects of CAT on migrated HeLa and SiHa cells($\bar x \pm s$,n=5) |
3.6 对SiHa细胞nm23-H1和MTA1蛋白表达的影响
1.25、2.5 μmol/L CAT作用24 h后,增加了nm23-H1蛋白表达,抑制MTA1蛋白表达。与对照组比较均差异显著(P<0.05、0.01)。结果见图 6。

|
图 6 对SiHa细胞nm23-H1和MTA1蛋白表达的影响($\bar x \pm s$,n=3) Fig. 6 Effects of CAT on expression of nm23-H1 and MTA1 proteins in SiHa cells($\bar x \pm s$,n=3) |
4 讨论
宫颈癌为女性第2大恶性肿瘤,具有较高的转移率,而侵袭转移是导致患者死亡的重要原因。西医主要采用手术和放化疗等方法,但和其他恶性肿瘤相似,疗效并不理想,而且有较多的副作用。中药尽管能够延长生命、降低死亡率,但由于大多是粗提制剂,有效成分不明确,作用机制不清楚,造成制剂的安全性、稳定性和有效性得不到保证;药物用量大,口感差,使用不方便,造成病人依从性差,不易推广。
理想的治疗药物应既能抑制肿瘤细胞增殖,又能阻止其侵袭和转移。有报道一些中药成分不同剂量表现出不同的作用,较高剂量能够诱导宫颈癌细胞凋亡,较低剂量则抑制宫颈癌细胞侵袭和转移。如槲皮素以不同浓度(40、60、80、100 μmol/L)作用HeLa细胞24和48 h后,增殖率显著降低,细胞呈凋亡形态学改变,线粒体膜电位明显下降[7]。而以20和40 μmol/L浓度作用HeLa细胞24 h和48 h后显著升高nm23 mRNA表达[8],明显降低细胞黏附率和迁移速度,减少穿膜细胞数[9],表明槲皮素既能通过线粒体途径诱导HeLa细胞凋亡,又可通过促进抑转移基因nm23的表达,抑制细胞的黏附、迁移及侵袭能力,从而发挥抗肿瘤作用。然而,要同时具备这两种作用的单体化合物并不多。
CAT是蔓荆子的主要化学成分之一,属黄酮类化合物。本实验采用经典的体外实验方法,包括MTT法、流式细胞凋亡检测、划痕试验、Transwell法和黏附试验等实验证实,CAT较低剂量即能显著诱导HeLa和SiHa细胞凋亡,明显抑制其侵袭和转移,这种作用可能与调节促转移蛋白MTA1和抑制转移蛋白nm23-H1的表达有关。然而,CAT诱导宫颈癌HeLa细胞凋亡和抑制其侵袭转移的确切分子作用机制尚需进一步研究。
| [1] | 李广太. 子宫颈癌流行病学研究进展[J]. 中华全科医师杂志,2009,8 (8) :515–518. |
| [2] | 蒋乐萍. 宫颈癌患者淋巴结转移的影响因素分析[J]. 实用癌症杂志,2013,28 (6) :731–733. |
| [3] | 辛海量, 胡园, 张巧艳, 等. 正交试验优选蔓荆子提取工艺研究[J]. 药学服务与研究,2006,6 (5) :342–344. |
| [4] | 张欣, 张莹, 杨佩颖, 等. 基于RNA干扰技术探讨消岩汤对肺腺癌A549细胞凋亡的影响[J]. 药物评价研究,2015,38 (3) :288–291. |
| [5] | 张亚楠, 孙继红, 黄新益, 等. 普纳替尼对人血管内皮细胞功能的影响[J]. 药物评价研究,2015,38 (2) :156–160. |
| [6] | Zheng G Y, Qu L P, Yue X Q, et al. Portulacerebroside A induces apoptosis via activation of the mitochondrial death pathway in human liver cancer HCCLM3 cells[J]. Phytochem Lett, 2014, 7 (2) :77–84. |
| [7] | 马朋, 宋晓冬, 闫苗苗, 等. 槲皮素诱导人宫颈癌Hela细胞凋亡的作用[J]. 解剖学杂志,2011,34 (4) :462–465. |
| [8] | 黄晶, 张蔚, 李福敏, 等. 槲皮素对宫颈癌HeLa细胞nm23基因表达的影响[J]. 武汉大学学报:医学版,2009,30 (5) :625–627. |
| [9] | 张峰莉, 张蔚, 陈小妹, 等. 槲皮素以及槲皮素联合顺铂对子宫颈癌细胞黏附、迁移和侵袭的影响[J]. 中华妇产科杂志,2008,43 (8) :619–621. |
 2016, Vol. 39
2016, Vol. 39


