通用名:Lesinurad
商品名:Zurampic®
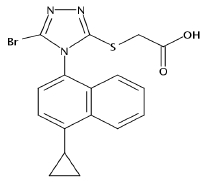
化学名:2-[[5-bromo-4-(4-cyclopropyl-1- naphthalenyl)-4H-1,2,4-triazol-3-yl]thio]- acetic acid
CAS:878672-00-5
分子式:C17H14BrN3O2S
结构式:见图 1
|
图 1 Lesinurad的结构 Fig. 1 Structure of Lesinurad |
相对分子质量:404.28
原研公司:阿斯利康(AstraZeneca)
适应症:痛风,高尿酸血症
给药途径:口服
2 相关背景痛风是因遗传性或获得性病因导致嘌呤代谢紊乱所引起的一类疾病,是由尿酸钠或尿酸结晶沉积于机体组织所引起的有一种或多种病变的临床综合征。随着饮食结构变化等因素,近年来痛风发病率显著上升且呈年轻化趋势。2010年,美国成年人患痛风率为3.9%,全美约830万患者饱受痛风折磨,影响患者的生活质量[1]。目前临床治疗急性痛风发作首选秋水仙碱一类抗炎药物,控制痛风发作依靠别嘌呤醇、非布司他等黄嘌呤氧化酶抑制剂及苯溴马龙等尿酸重吸收抑制剂。
阿斯利康公司于2015年12月22日获得美国食品药品监督管理局(FDA)批准,Lesinurad(200 mg)作为全球首个尿酸盐重吸收转运因子(URAT1)抑制剂,联合黄嘌呤氧化酶抑制剂(如别嘌呤醇、非布司他)治疗高尿酸血症相关的痛风。其是一种选择性尿酸再吸收抑制剂,可阻断URAT1转运,通过使尿酸排泄正常化及降低尿酸的血清水平来缓解疼痛症状,为广大痛风患者带来了福音[2]。
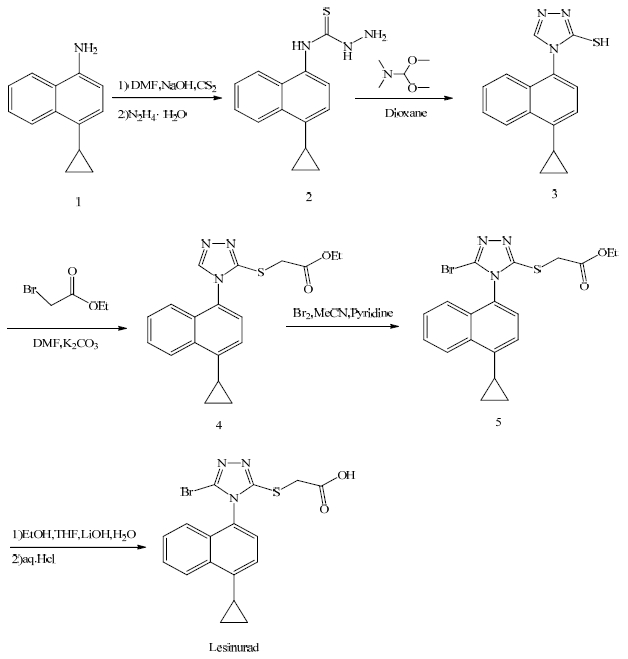
3 合成路线[3, 4]4-环丙基-1-萘胺在二甲基甲酰胺(DMF)溶媒体系中由CS2和NaOH活化后与水合肼回流反应,处理后得到化合物2。将化合物2与N,N-二甲基甲酰胺二甲基缩醛于二氧六环中回流反应,处理后得化合物3。化合物3溶于DMF,K2CO3作为碱与溴乙基乙酸乙酯发生取代反应制得硫醚化合物4。化合物4在三氮唑2位发生溴化反应得化合物5,化合物5由LiOH水解后处理得目标产物Lesinurad。合成路线见图 2。
|
图 2 Lesinurad的合成路线 Fig. 2 Synthesis route of Lesinurad |
体外实验表明任何浓度下的Lesinurad都不能改变黄嘌呤氧化酶或嘌呤核苷磷酸化酶的活性。Lesinurad通过抑制URAT1受体和有机阴离子转运体OAT4的活性从而阻断近端肾小管对尿酸的重吸收,这是尿酸排泄的重要调节机制[5]。Lesinurad作用于爪蛙卵母细胞的URAT1受体抑制尿酸摄取的最小抑制浓度(IC50)值为52.5 mmol/L。Lesinurad抑制OAT4活性的能力由人胚肾HEK293细胞在6-羧基荧光素转运载体下稳定表达情况来评价(羧基荧光素=5 mmol/L)。Lesinurad阻断了人胚肾HEK293细胞依赖OTA4的协助扩散(50 mmol/L),且被赋形剂处理后细胞的无载体运输相对荧光单位较Lesinurad处理的细胞要高出6倍。Lesinurad依靠通过OTA4抑制尿酸转运活性的IC50值为5 mmol/L。因此,Lesinurad有相同的潜力抑制URAT1受体和OTA4受体[6]。
5 药动学Ⅰ期临床试验评估健康禁食受试者单剂量口服100、400、600 mg的Lesinurad和健康非禁食受试者口服5、25、100、200 mg的疗效。禁食组给药0.7 h达峰浓度(Cmax),非禁食组的为1.2 h。同时,Lesinurad的清除率在各种给药模型中非常恒定。24 h内,Lesinurad以原型排泄到尿液中约占20%~50%[7]。
在另一项I期临床试验中,给予健康受试者口服Lesinurad溶液或速释胶囊10 d(1次/d,每次100~400 mg)[7]。结果禁食状态下,剂量达到400 mg,Lesinurad在体内代谢不完全,有适度的累积。
此外还对肾损伤模型进行了药效学评估,在一项Ⅰ期非盲临床试验中,评价分别单剂给予Lesinurad(200 mg)健康受试者(7人)、轻度肾损伤者(8人)、中度肾损伤者(6人)、重度肾损伤者(3人)[8]。结果,达峰时间(Tmax)在0.75~1.5 h,受肾损伤程度影响较大;轻度至重度肾损伤受试者的Cmax值约为健康受试者的130%、119%和112%;肾清除率分别为84%、15%、10%。另有试验证明轻度肾损伤对Lesinurad的体内代谢影响不大[9]。
6 临床评价 6.1 Ⅰ期临床在Ⅰ期临床试验中,采用双盲、空白对照、随机研究法分别对单剂量、多剂量、Lesinurad与非布司他药物组合,非盲法对Lesinurad与别嘌醇药物组合进行试验,评价降低血尿酸水平的能力。
单药单剂量给药,血尿酸降低的阈剂量为25 mg,剂量达400~600 mg时血尿酸降低程度在27%~31%[7]。多剂量(10 d)给药,血尿酸降低程度,100、200、400 mg分别为15%、30%、45%[7]。与40 mg非布司他联合用药,Lesinurad剂量为200、400 mg时血尿酸降低程度分别为58%和70%[10]。与300 mg别嘌醇联合用药,400、600 mg的Lesinurad血尿酸降低程度分别为45%和55%[11]。试验结果表明,Lesinurad起效剂量较高,联合使用别嘌醇及非布司他等抑制尿酸合成药可明显降低血尿酸水平。
在评价安全性的一项Ⅰ期临床试验中[7],对禁食和非禁食健康受试者单剂及多剂量给药,Lesinurad仅引起的轻度至中度不良反应,无致死或停止试验等严重不良事件发生,某些实验室参数(生命体征、心电图等)也无显著改变。多剂量给药组及安慰剂组均出现如腹痛、腹泻、咽痛、头痛、头晕、背痛、鼻咽炎及四肢酸痛等不良反应,因此证明Lesinurad安全性良好。痛风患者使用Lesinurad与非布司他联合用药,最常见的不良反应为消化不良和头痛,无严重不良事件发生[12]。
6.2 Ⅱ期临床在一项双盲、安慰剂对照、随机的Ⅱ期临床试验中,评价痛风患者给予Lesinurad 200、400 mg,1次/d给药1周;别嘌醇300 mg,1次/d给药2周;或两药组合对血尿酸水平的影响。单用Lesinurad组尿酸排泄水平由约440 mg增至约620 mg(正常值);单用别嘌醇则显示尿酸排泄减少,由约400 mg降至约250 mg;联合用药则降至正常排泄水平(约620 mg)[13]。对血尿酸的影响,联合用药比单用Lesinurad 200 mg的降低血尿酸水平提高51%,400 mg的为56%;比单用300 mg剂量别嘌醇降低血尿酸的水平提高36%[11]。试验证明联合用药对于增加尿酸排泄和降低血尿酸水平有更好效果。
在另一项双盲、安慰剂对照、随机、多中心的Ⅱ期临床试验中,123名血尿酸平均水平≥9.2 mg/mL的痛风患者给予Lesinurad,将其分为3个治疗组(200 mg给药4周;200 mg给药1周,400 mg给药3周;200 mg给药1周,400 mg给药1周,600 mg给药2周)[13],结果显示逐渐增加剂量使血尿酸回归正常率分别为13%、42%和60%,说明增加剂量对血尿酸的控制起到积极作用。
在一项双盲、安慰剂对照、随机、多中心的以208名耐受别嘌醇的痛风患者(血尿酸≥6 mg/dL)为对象的Ⅱ期临床试验中,将受试者分为3个治疗组给予Lesinurad(200 mg给药4周;200 mg给药1周,400 mg给药3周;200 mg给药1周,400 mg给药1周,600 mg给药2周)和别嘌醇,观测血尿酸水平[13]。结果表明给予Lesinurad后,3个治疗组血尿酸正常率分别为71%、76%和87%,说明对别嘌醇耐受的痛风患者在加服不同剂量的Lesinurd后,血尿酸回归正常率随剂量升高而升高。
在一项长期给药试验中,Lesinurad与别嘌醇联合用药治疗28周的患者在终末期血尿酸达标率为78%,Lesinurad单独用药治疗44周的患者在终末期血尿酸达标率为90%,给予安慰剂和别嘌醇的对照组达标率仅55%[14]。说明长期使用可以明显控制血尿酸水平,预防痛风发作。
6.3 Ⅲ期临床2015年6月,在第16届欧洲抗风湿病联盟年会上发布了3个Ⅲ期临床试验结果。报告指出降低血尿酸和尿酸结石面积与痛风发作呈正相关。经过12个月后,平均血尿酸为3.0 mg/dL的患者平均尿酸结石的减小率为60%,期间接受痛风发作治疗的占12.2%[15]。2015年11月,第79届美国风湿病学会上的报告指出将697名患者分为安慰剂+别嘌醇、Lesinurad 200 mg+别嘌醇、Lesinurad 400 mg+别嘌醇3个试验组,6个月后3组患者的肌酐清除率为90 mL/min的比例分别为21.4%、60.4%、70.4%;肌酐清除率为60 mL/min的比例分别为33.8%、59.5%、66.7%。考虑到不同肾功能的影响,3个试验组内的平均血肌酐清除率大体一致[16]。会议还报告一项数据,终末期血尿酸均值为3、3~4、4~5、5~6、6 mg/dL的患者需要接受痛风急性发作治疗的比例分别为12.2%、16.1%、19.9%、20.5%和19.5%;终末期血尿酸均值为≈3、3、≈5、5 mg/dL的与治疗相关的不良事件发生率为78.8%、76.6%、78.4%和75.7%,其中严重不良事件发生率为6.7%、6.5%、5.3%和7.3%[17]。
2012年1月,一项针对评价单用Lesinurad对耐受或禁忌黄嘌呤氧化酶抑制剂的痛风患者的Ⅲ期临床试验共招募214名受试志愿者。2013年12月,一项相关研究报告指出血尿酸平均值在6个月时达6 mg/dL的比例,Lesinurad组较安慰剂高;但是Lesinurad组更易出现血肌酐升高及肾相关不良事件。2015年6月,在第16届欧洲抗风湿病联盟年会中报告此项临床试验另一关键数据:给药6个月后Lesinurad组血尿酸达5 mg/dL者占14%,安慰剂组的为0%,Lesinurad组血尿酸达4 mg/dL者占3.7%,安慰剂组的为0%[18]。
2012年1月,一项针对痛风患者的Lesinurad与非布司他联用的Ⅲ期临床试验共招募约330名受试志愿者。积极的数据在2014年8月报告,400 mg剂量Lesinurad与非布司他联用6个月的血尿酸低于5 mg/dL的受试者比例高于单用非布司他治疗受试者[19]。2015年6月,在第16届欧洲抗风湿病联盟年会中报告此项临床试验另一关键数据:在第12个月,患者血尿酸为5、4、3 mg/dL的比例在200 mg Lesinurad+非布司他组的分别为56.5%、46.2%、31.1%;400 mg Lesinurad+非布司他组的分别为60.6%、56%、42.2%;安慰剂+非布司他组的分别为41.3%、16.5%、5.5%。结果显示Lesinurad+非布司他的耐受性较好[20]。2015年11月,在第79届美国风湿病学会年会上发布在核心研究和延伸研究期对痛风结石的影响的数据,指出在12个月核心期、6个月延伸期、12个月延伸期中,200CROSS组的痛风石面积减少率分别为49%、61.7%和64.1%;200CONT组分别为54.8%、60%、66.3%;400CROSS组分别为0.5%、36%和44.1%;400CONT组分别为58.6%、70.2%、72.4%。痛风急性发作在延伸期的CORSS组有所升高,在持续治疗组无升高迹象[21]。
7 结语约90%的日负荷尿酸盐均被肾脏滤过并重吸收入血,该过程是由特殊的阴离子转运因子介导的。该转运过程位于肾小管近端小管顶部细胞中,是尿酸重吸收的重要影响因素。URAT1受体是目前治疗痛风研究的热门药物靶点,其活性可被苯溴马隆、丙磺舒、洛沙坦、磺吡酮等促尿酸排泄药抑制。Lesinurad选择性地抑制URAT1受体,抑制尿酸在肾小管中的重吸收,从而降低血尿酸水平,达到缓解痛风症状的作用。
临床研究表明Lesinurad分别与非布司他、别嘌醇联合用药可以平稳降低痛风患者尿酸水平,且对别嘌醇和非布司他耐受的高尿酸血症及痛风患者有明显的降低尿酸作用。
随着全球范围内痛风发病率的上升,Lesinurad在日益增长的药品市场中有望成为重要角色。以Lesinurad为主导的复方药物可能会成为全球医师的一款治疗高尿酸血症及通风的首选药物,有关其疗效与安全性的评价仍在进行,后续报道会层出不穷。
| [1] | 于一云, 薛 愉, 朱小霞, 等. 急性痛风性关节炎的药物治疗及选择 [J]. 上海医药, 2015, 36(11): 14-18. |
| [2] | 耿艳艳, 于 冰, 徐为人, 等. 新型痛风治疗药物lesinuard sodium [J]. 现代药物与临床, 2014, 29(6): 685-689. |
| [3] | 王 鹏, 李丕旭, 谷向永. 痛风治疗药Lesinurad的制备方法及Lesinurad中间体 [P]. 中国: 103524440, 2014-01-22. |
| [4] | 田 禾, 蔡文卿, 谢亚非, 等. lesinurad的合成工艺研究 [J]. 现代药物与临床, 2015, 30(1): 1-7. |
| [5] | Yeh L, Tamai I, Hamatake R, et al. Mode of action of RDEA594 as a uric acid lowering agent in humans following multiple doses of its prodrug RDEA806 [J]. Ann Rheum Dis, 2008, 67(Suppl II): 249. |
| [6] | Tan P K, Hyndman D, Liu S, et al. Lesinurad (RDEA594), A novel investigational uricosuric agent for hyperuricemia and gout. blocks transport of uric acid induced by hydrochlorothiazide [J]. Ann Rheum Dis, 2011, 70(Suppl 3): 187. |
| [7] | Yeh L, Kerr B, Shen Z, et al. Safety, pharmacokinetics, and serum uric acid lowering effect of rdea594, a novel uricosuric agent, in healthy volunteers [J]. Ann Rheum Dis, 2009, 68(Suppl III): 320. |
| [8] | Kerr B, Shen Z, Yeh L, et al. Pharmacokinetics and serum urate lowering effect of RDEA-594, a novel URAT1 inhibitor, in gout patients and subjects with varying degrees of renal impairment [J]. Clin Pharmacol Ther, 2011, S93. doi:10.1038/clpt.2010.335. |
| [9] | Hagerty D, Kerr B, Shen Z, et al. Pharmacokinetics, efficacy and safety of lesinurad, a novel URAT1 inhibitor, in individuals with mild to moderate renal impairment [J]. Arthritis Rheum, 2011, 63(Suppl)10: 1030. |
| [10] | Yeh L, Kerr B, Shen I, et al. RDEA-594, A novel URAT1 inhibitor, shows significant additive urate lowering effects in combination with febuxostat in both healthy subjects and gout patients [OL]. (2011-03-05) [2015-12-21]. http://www.ardeabio.com/assets/001/5137.pdf. |
| [11] | Shen Z, Yeh L, Kerr B, et al. RDEA594, A novel uricosuric agent, shows significant additive activity in combination with allopurinol in gout patients [OL]. [2011-03-05] (2015-12-21). https://www.researchgate.net/publication/266173740. |
| [12] | Fleischmann R, Shen Z, Yeh L T et al. Lesinurad (RDEA594), A novel oral uricosuric agent, in combination with febuxostat shows significant additive urate lowering effects in gout subjects with 100% response achieved for all combination dose regimens [J]. Ann Rheum Dis, 2011, 70(Suppl 3): 188. |
| [13] | Perez-Ruiz F, Hingorani V, Welp J, et al. Efficacy and safety of a range of doses of RDEA594, a novel uricosuric agent, as a single agent in hyperuricemic gout patients: multicenter, randomized, double-blind, placebo-controlled, phase 2 experience [J]. Ann Rheum Dis, 2010, 69(Suppl 3): 121. |
| [14] | Perez-Ruiz F, Sundy J, Krishnan E, et al. Efficacy and safety of Lesinurad (RDEA594), a novel uricosuric agent, given in combination with allopurinol in allopurinol-refractory gout patients: randomized, double-blind, placebo-controlled, phase 2b study [J]. Ann Rheum Dis, 2011, 70(Suppl 3): 104. |
| [15] | Sundy J, Perez-Ruiz F, Krishnan E, et al. Efficacy and safety of Lesinurad (RDEA594), a novel uricosuric agent, given in combination with allopurinol in allopurinol-refractory gout patients: preliminary results from the randomized, double-blind, placebo-controlled, phase 2b extension study [J]. Ann Rheum Dis, 2015, 74(Suppl 3): 771. |
| [16] | Terkeltaub R, Perez-Ruiz F, Storgard C, et al. Relationship between sustained lowering of serum urate levels and improvements in gout flares and tophus area: pooled exploratory analysis of gout subjects receiving lesinurad and xanthine oxidase inhibitor combination therapy [J]. Arthritis Rheumatol, 2015, 67(Suppl 10): 2524-2525. |
| [17] | Saag K G, Bardin T, So A, et al. Analysis of Gout subjects receiving lesinurad and allopurinol combination therapy by baseline renal function [J]. Arthritis Rheumatol, 2015, 67(Suppl 10): 2524-2525. |
| [18] | Tausche A K, Alten R, Dalbeth N, et al. Lesinurad monotherapy in gout patients intolerant to xanthine oxidase inhibitors (light): a randomized, double-blind, placebo-controlled, 6-month phase iii clinical trial [J]. Ann Rheum Dis, 2015, 74(Suppl 2): 769. |
| [19] | AstraZeneca announces top-line results from the phase iii programme of Lesinurad in combination with xanthine oxidase inhibitors in gout patients [OL]. (2014-08-13) [2015-12-21]. http://www.astrazeneca.se/pressrum/pressmedde landen-och-nyheter/Article/astrazeneca-announces-topline-results-from-the-phase-iii. |
| [20] | Dalbeth N, Jones G, Terkeltaub R, et al. Lesinurad, a novel selective uric acid reabsorption inhibitor, in combination with febuxostat, in patients with tophaceous gout: the crystal phase iii clinical trial [J]. Ann Rheum Dis, 2015, 74(Suppl 2): 778. |
| [21] | Dalbeth N, Jones G, Terkeltaub R, et al. Efficacy and safety in patients with tophaceous gout receiving lesinurad and febuxostat combination therapy: interim analysis of an extension study [J]. Arthritis Rheumatol, 2015, 67(Suppl 10): 2836-2837. |
 2016, Vol. 39
2016, Vol. 39

