2. 沈阳药科大学 基于靶点的药物设计与研究教育部重点实验室, 辽宁 沈阳 110016
2. Key Laboratory of Structure-based Drug Design and Discovery, Ministry of Education, Shenyang Pharmaceutical University, Shenyang 110016, China
良好的水溶性对药物在人体内的药代、药动学特性具有重要的影响,最终决定药物疗效能否发挥,而该特性又是评价一个药品能否最终成功上市的重要方面之一[1]。所以水溶性在药物研发中至关重要。水溶性是化合物的一种基本理化特性,水溶性大小没有严格的范围界定,对于低剂量就能发挥药效的化合物,低的水溶性就可以达到治疗效果;而过高的水溶性也可能带来脂溶性过低的问题[2]。理想的药物应该是化合物离子化程度适宜,亲水性和亲脂性处于最适的状态,从而达到最佳的治疗效果[2]。良好的水溶性可以提高化合物的药效,改善药物在人体内的药动学特性,增加化合物的成药性,从而满足理想药物应具备的高效、低毒[3]、良好的药代动力学性质[4]的条件。
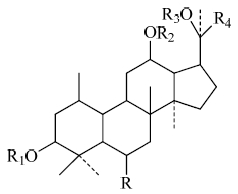
人参皂苷类化合物是人参、三七、西洋参的主要有效成分,具有相同的基本结构,其母核结构大部分是由17个碳原子组成的四元环,根据C-6位取代基连接-OH的情况,达玛烷型人参皂苷可分为原人参二醇型(H)和原人参三醇型(OH)两种类型,见图 1。
|
图 1 达玛烷型人参皂苷的母核结构 Fig. 1 Stem nucleus of dammarane-type ginsenosides |
人参皂苷类化合物中的类固醇骨架具有亲脂性,可以与亲水性基团结合,从而使其既具有亲脂性又具有亲水性[5]。亲水基团位于细胞膜的结构中,包括磷脂极性头和带有β-OH的胆固醇。类固醇骨架与其疏水性的侧链发生反应,细胞膜的β-OH基团极性头与骨架上带有的亲水性基团发生作用使细胞膜的流动性发生变化,从而使细胞膜的功能发生改变,导致细胞发生反应。这些反应影响了达玛烷类化合物在细胞内发挥药效,而这些反应主要受到达玛烷类化合物结构上的亲水性基团的影响,因此,水溶性对人参皂苷的活性具有很重要的影响。
大多数人参皂苷及其苷元已被证明有很好的抗癌活性[6, 7],且苷元活性强于皂苷[8, 9, 10],人参皂苷及其物理和化学修饰物的亲脂性使其具有广泛的药理活性和较强的抗癌活性,但是该类化合物的水溶性较差,生物利用度较差,限制了其在临床上的应用[11]。因此,开展人参皂苷类化合物水溶性提升方法的研究,即通过对其进行物理和化学修饰方法,如成盐、引入极性基团、降低不饱和度、氨基酸酯化、糖基化、脂肪酸酯化、制成水溶性聚合物、制成微球和制成自微乳释药系统等来提高水溶性,对于创新药物的研发有重要的学术意义和广阔的应用前景。
1 化学方法提高人参皂苷水溶性的化学方包括成盐、引入极性基团、降低不饱和度、氨基酸酯化、糖基化、二元酸酯化等。
1.1 成盐成盐是改善药物物理化学性质,提高成药性的重要方法之一。利用大部分药物分子酸碱特性,形成相应的盐类化合物,可增加化合物的离子水合能,而达到促进溶解的目的。从理论上讲,人参皂苷类的硫酸化修饰是在路易斯碱溶液中由SO3H+取代羟基中的H+,经中和得到硫酸酯盐[12, 13]。目前对人参皂苷(元)硫酸化的研究较少。其硫酸化特点是先形成硫酸酯再形成硫酸酯盐。王鲁等[14, 15]对人参总皂苷进行硫酸化修饰采用的方法是氯磺酸-吡啶Wolfrom法,通过此方法成功得到2个人参皂苷Rh2硫酸化钠盐衍生物,分别是C-20位-OH被取代和C-3位葡萄糖的-OH被取代的产物,使其抗癌、抗病毒活性和免疫活性得到了提高。高焕等[16]观察到人参皂苷经硫酸化修饰后可提高其抗新城疫病毒活性。史公良等[9]阐述了硫酸化人参皂苷Rh2提高了水溶性,从而提高了抗肿瘤活性。李艳艳[17]根据人参皂苷的体内代谢机制合成了20(R)-人参二醇-3β-琥珀酸钠、20(R)-人参三醇-3β,6α-二琥珀酸钠和新人参二醇-3β,12β-二琥珀酸钠,其中新人参二醇-3β,12β-二琥珀酸钠的抗肿瘤作用较强。成盐对增加药物的水溶性具有十分重要的影响和广泛的应用,可以作为药物首选的提升水溶性的方法和依据。
1.2 引入极性基团引入极性基团可以增加化合物的亲水作用,是一个热力学过程。引入的极性基团可以是含有N、O原子的直连或环状基团,如胺类、醇类、杂环、酸碱等可离子化片段。张严磊[18]和王鹏[19]对三七总皂苷水解产物人参二醇及人参三醇进行咪唑类衍生化结构修饰,得到了具有良好活性的新型化合物,并进行了人参二醇和人参三醇不同位置的咪唑类衍生物的结构修饰。
1.3 降低不饱和度研究发现通过减少化合物结构中芳香体系,可以减小化合物晶体中的分子间作用力,从而达到改善化合物水溶性的目的。黄樱[20]采用二氧化铂作为催化剂,成功得到了人参皂苷Rh2和Rg3的还原产物。宋彬彬[21]对西洋参茎叶总皂苷进行了组合催化氢化,得到了包括人参皂苷Rh2、原人参二醇、人参皂苷Rg3、人参皂苷Rb1、人参皂苷Re在内的催化氢化衍生物化合物库,并对其产物进行了酸条件催化水解,也得到了酸催化水解的化合物库,创造出了大量新的达玛烷型人参皂苷类衍生物。
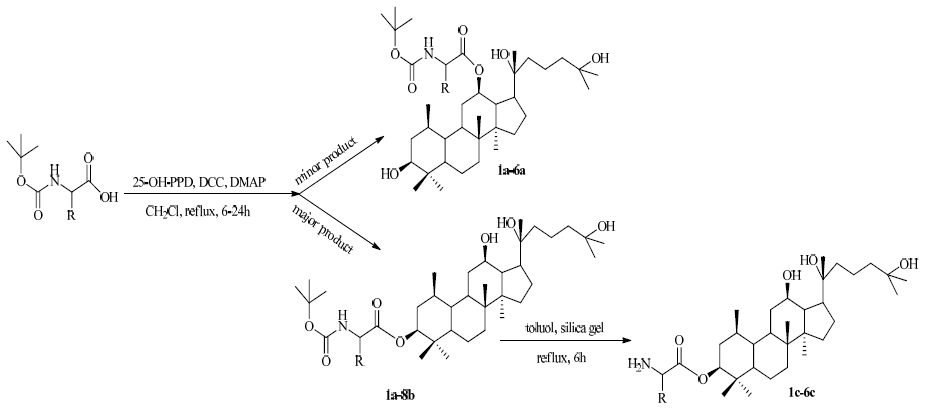
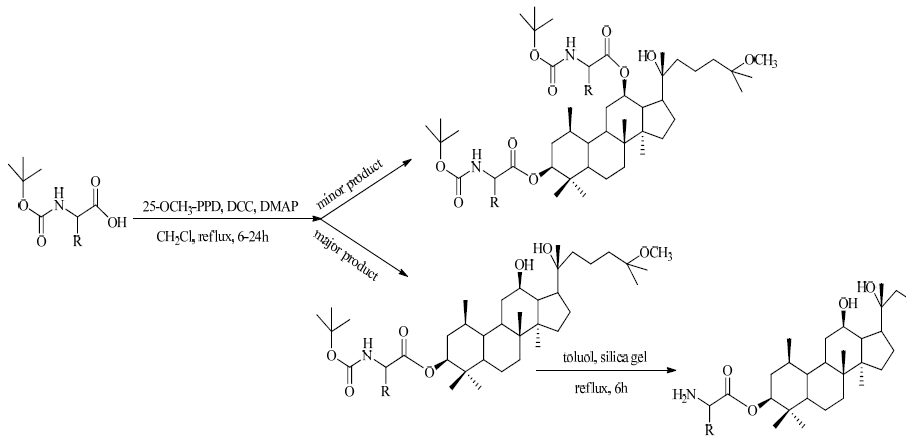
1.4 氨基酸酯化由于氨基酸具有良好的水溶性和代谢性质,其氨基酸前药既具有很好的水溶性,成酯后又具有适中的可水解性,因此化合物的氨基酸酯化结构修饰占有重要的地位。Wang等[22]在20(R)-达玛烷-3β,12β,20,25-四醇(25-OH-PPD)的基础上连接氨基酸,使其活性大大提升,介绍了酰化的原人参二醇(PPD)的合成的方法,结构以及与链接基团的大小与活性的关系,其中也介绍了氨基酸衍生物活性,其3位连接阿拉伯糖活性最好,众多氨基酸衍生化产物中不用叔丁氧羰基保护的氨基酸衍生化产物活性强于被保护的氨基酸衍生化产物,水解掉叔丁氧羰基的衍生产物活性更强,其中C-3取代活性增强,C-12位取代活性减弱,见图 2。刘雅飞[23]采用MTT法评价了各修饰产物的抗肿瘤活性。与25-OCH3-PPD相比,氨基酸修饰的化合物有更好的抗肿瘤活性,相对分子质量较小的氨基酸以及叔丁氧羰基氨基酸衍生化,可以有效提高衍生物对人前列腺癌晚期细胞的抑制作用。其合成方法主要是以25-OCH3-PPD为原料,二环己基碳二亚胺、4-二甲氨基吡啶为催化剂,在室温下与叔丁氧羰基保护的氨基酸反应得到不同位置取代的叔丁氧羰基保护的氨基酸衍生物。叔丁氧羰基保护的氨基酸衍生物在甲苯溶液中以硅胶为催化剂,120 ℃加热回流8 h,得到C-3位取代的氨基酸衍生物,见图 3。
|
图 2 2,5-OH-PPD氨基酸衍生化合成路线 Fig. 2 Synthesis of esters of 25-OH-PPD with amino acids |
|
图 3 25-OCH3-PPD氨基酸衍生化合成路线 Fig. 3 Synthesis of esters of 25-OCH3-PPD with amino acids |
刘继华等[24]通过酯化反应将氨基酸连接到了以上两种皂苷上,从而进行了氨基酸酯化结构修饰,得到了一系列新的氨基酸化衍生物,提高了化合物的水溶性。而这些衍生物可以作为先导化合物进入体内,然后代谢脱去氨基酸后发挥药效。
1.5 糖基化极性较大的单糖和二糖也可用于结构修饰,改善水溶性。人参皂苷Rg3(2个糖基)、Rh2(1个糖基)和Ck(1个糖基)具有很好的抑制不同类型癌细胞增殖的作用,它们可与常规化疗药物协同使用而到达增强化疗药物疗效的作用[25, 26, 27, 28]。杨宁等[29]综述了3类糖苷化方法,并对比总结各个方法的优劣之处,阐述了糖苷化能改变化合物的生物活性、稳定性、水溶性、以及与受体分子的相互识别和结合特性,另外还能降低或除去内源和外源有毒物质的毒性。李荣耀[30]利用Au(I)催化剂,用邻炔基苯甲酸糖作为供体进行了达玛烷型人参皂苷Rb1糖苷化结构修饰。其合成过程为先保护受体的3位和12位,然后形成20位的1个糖苷键,再用乙酰基替换12位的保护基,然后再形成20位上的另1个糖苷键。然后将3位保护基脱去,继而形成在3位上的两个糖苷键,最后脱去保护基,获得人参皂苷Rb1。糖基化结构修饰的研究对于药物研发有很好的拓展思路和借鉴意义。
1.6 二元酸酯化通过二元酸酯化形成前药是很常见且很有价值的提高水溶性的方法之一。二元酸酯制备方便,容易在体内水解,通过此方法引入水溶性基团后可作为很好的前药[31, 32, 33]。Wang等[31]对25-OH-PPD的R1位进行了二元羧酸芳酰基的结构修饰,张锐等[32]对PPD的R2位进行了二元羧酸芳酰基的结构修饰,冷吉燕等[33]利用丁二酸对PPD进行结构修饰得到了二元酸成酯化合物。这种脂肪酸侧链效应规律对以后研究人参皂苷类化合物结构修饰及构效关系具有重要意义,为新药研发奠定基础[5]。
2 物理方法 2.1 制成微球20(S)-原人参二醇具有较强的抗抑郁作用,陈玉玺[34]将20(S)-原人参二醇制备药物磷脂复合物及复合物纳米粒子,再以药物和复合物纳米粒子分别制备聚乳酸-羟基乙酸共聚物(PLGA)微球,对两种微球进行体外释放评价,并对体外释放较好的药物微球进行了大鼠体内初步药动学研究。结果,药物微球在给药后第15 d时血浆中检测不到药物,20(S)-原人参二醇原料药及PLGA微球在大鼠体内动力学过程均符合单室模型,半衰期(t1/2)由0.17 d延长到2.97 d,达峰时间(Tmax)由14.4 min增加至0.7 d,平均驻留时间(MRT)也增至4.55 d,体现了明显的缓释特征。
2.2 制成自微乳释药系统20(S)-PPD口服生物利用度低,在一定程度上限制了其在临床疗效的发挥。王冰[35]首次以难溶性天然来源活性成分20(S)-PPD为模型药物,运用现代药剂学技术手段,以自微乳释药系统为载体,制备了能有效提高药物溶解度、明显改善生物利用度的口服20(S)-PPD自微乳制剂。该制剂不仅可改善治疗效果,而且能增加患者的顺应性,有望被开发成新型抗抑郁或抗肿瘤药物。
2.3 制成纳米混悬剂李之韬等[36]采用溶剂蒸发法,以白蛋白作为稳定剂制备原人参二醇纳米混悬剂,采用大鼠在体单向肠灌流法评价原人参二醇纳米混悬剂的大鼠在体肠吸收特性。结果,原人参二醇纳米混悬剂在整个肠段都有吸收,且吸收速率常数(Ka)与渗透系数(Peff)均大于原人参二醇原药,制成原人参二醇纳米混悬剂能够提高药物的水溶性与在体肠吸收,其转运机制可能为主动转运或促进扩散。
3 结语近年来的研究发现难溶性药物越来越多,其中天然药物中的人参皂苷类化合物的水溶性问题越发凸显。水溶性是人参皂苷类药物重要的药动学影响因素之一,水溶性的提高能够改善人参皂苷类药物的溶出度,从而促进其在人体内的吸收,提高临床治疗效果,因此人参皂苷类化合物水溶性提升方法越来越受到国内外的关注。
通过化学修饰和物理方法改善水溶性的成效非常明显,目前研究热点主要集中在成盐,引入极性基团、降低不饱和度、氨基酸酯化、糖基化、二元酸酯化,以及制成微球以及自微乳释药系统等方面。化学方法通过对药物化合物的分子结构进行改造和修饰,通过酸碱反应、酯化、还原、成苷和一些其他的分子对接方法达到了改变药物结构对水的亲和力,从而改变水溶性的目的,具有亲水性效果明显提高的优点。物理方法通过制成微球与自微乳系统,在不改变药物化合物分子结构的条件下,提高水溶性的同时具有缓慢释药的特点,增加了药物的顺应性。人参皂苷类化合物的水溶性与其母核的结构类别、羟基数目、双键数目、所连接基团的数量与性质以及基团与母核结合的位置等因素有关。充分理解和掌握这些研究策略,对指导人参皂苷类药物研发将起到事半功倍的效果,为先导化合物的发现和创新药物的研究提供有价值的参考。
近年来随着药学领域中新技术、新方法的不断发现与发展,人参皂苷类难溶性药物的溶解度问题逐渐得到解决,随着研究的深入将会更好地发挥其抗病作用,给广大患者带来福音。
| [1] | 栗 增, 王 江, 周 宇, 等. 先导化合物结构优化策略(三)——通过化学修饰改善水溶性 [J]. 药学学报, 2014, 49(9): 1238-1247. |
| [2] | Guo Z. Strategy of molecular design of drugs: the unification of macro-properties and micro-structures of a molecule [J]. Acta Pharmaceutica Sinica, 2008, 43: 227-233. |
| [3] | Liu H, Wang J, Lin D, et al. Lead compound optimization strategy (2)—structure optimization strategy for reducing toxicity risks in drug design [J]. Acta Pharmaceutica Sinica, 2014, 49: 1-15. |
| [4] | Wang J, Liu H. Lead compound optimization strategy (1)—changing metabolic pathways and optimizing metabolism stability [J]. Acta Pharmaceutica Sinica, 2013, 48: 1521-1531. |
| [5] | 刘雅飞, 崔玉娜, 赵余庆, 等. 基于抗肿瘤活性的达玛烷型人参皂苷(元)结构修饰 [J]. 中草药, 2013, 44(9): 1203-1210. |
| [6] | Attele A S, Wu J A, Yuan C S. Ginseng pharmacology: multiple constituents and multiple actions [J]. Biochem Pharmacol, 1999, 58(11): 1685-1693. |
| [7] | Gillis C N. Panax ginseng pharmacology: a nitric oxide link? [J] Biochem Pharmacol, 1997, 54(1): 1-8. |
| [8] | 张春红, 李向高, 张连学, 等. 温度和酸的种类对人参二醇得率的影响 [J]. 特产研究, 2005, 18(4): 18-20. |
| [9] | 史公良, 童然珣, 赵余庆. 人参稀有抗肿瘤皂苷制备方法的研究 [J]. 中国现代中药, 2006, 8(6): 31-34. |
| [10] | Wang W, Zhao Y Q. Ray B, et al. In vitro anti-cancer activity and structure–activity relation ships of natural products isolated from fruits of Panax ginseng [J]. Cancer Chemother Pharmacol, 2007, 59(5): 589-601. |
| [11] | 朱 伟, 付本懂, 王 鲁, 等. 人参皂苷-Rh2的硫酸化衍生物鉴定及其对小鼠腹腔巨噬细胞功能的影响 [J]. 中国兽医学报, 2011, 31(3): 394-398. |
| [12] | 韦旭斌, 王 鲁, 付本懂, 等. 20(S)-人参皂苷Rh2硫酸化修饰及其硫酸酯钠分离鉴定方法 [P]. 中国: 101440114A(P), 2009-05-27. |
| [13] | Reed M J, Potter B V L. Steroid 3-O-sulphamate derivatives as inhibitors of oesterone sulphatase [P]. US: 6949561B1, 2005-09-27. |
| [14] | 王 鲁, 申海清. 人参总皂苷硫酸化修饰及分析 [J]. 中国兽医杂志, 2009(6): 23-24. |
| [15] | 王 鲁, 郭志廷, 付本懂, 等. 硫酸化人参总皂苷的制备及其对鸡外周淋巴细胞增殖的影响 [J]. 中兽医医药杂志, 2007(4): 4-7. |
| [16] | 高 焕, 韩立秋, 胡 林, 等. 硫酸化人参皂苷体外抗新城疫病毒作用 [J]. 中草药, 2011, 42(12): 2492-2496. |
| [17] | 李艳艳. 人参皂苷的结构修饰及其体外抗肿瘤活性的研究 [D]. 长春: 吉林大学, 2012, 21-23. |
| [18] | 张严磊. 小桐子化学成分研究及人参二醇、人参三醇结构修饰研究 [D]. 昆明: 云南大学, 2010, 43-55. |
| [19] | 王 鹏. 人参二醇及人参三醇咪唑类衍生物合成研究 [D]. 昆明: 云南大学, 2009, 18-31. |
| [20] | 黄 樱. PtO2催化氢化二醇型人参皂苷及其产物的水解、分离和鉴定 [D]. 扬州: 扬州大学, 2005, 25-26. |
| [21] | 宋彬彬. 西洋参茎叶皂苷组合催化氢化及其产物的研究 [D]. 扬州: 扬州大学, 2007,19-35. |
| [22] | Wang P, Bi X L, Guo Y M, et al. Synthesis and anti-tumor evaluation of novel 25-hydroxyproto- panaxadiol analogs incorporating natural amino acids [J]. Steroids, 2013, 78(2): 203-209. |
| [23] | 刘雅飞. 25-OCH3-PPD氨基酸衍生物的结构优化及构效关系研究 [D]. 沈阳: 沈阳药科大学, 2014, 10-38. |
| [24] | 刘继华, 刘金平, 李平亚, 等. 人参皂苷 Rh2的氨基酸衍生物的合成 [A]. 2010年中国药学大会暨第十届中国药师周论文集 [C]. 北京: 2010. |
| [25] | Hasegawa H, Sung J H, Matsumiya S, et al. Reversal of daunomycin and vinblastine resistance in multidrug-resistant P388 leukemia in vitro through enhanced cytotoxicity by triterpenoids [J]. Planta Med, 1995, 61(5): 409-413. |
| [26] | Yue P Y, Wong D Y, Wu P K, et al. The angiosuppressive effects of 20(R)-ginsenoside Rg3 [J]. Biochem Pharmacol, 2006, 72(4): 437-445. |
| [27] | Wang C Z, Aung H H, Ni M, et al. Red American ginseng:ginsenoside constituents and antiproliferative activities of heat-processed Panax quin-quefolius roots [J]. Planta Med, 2007, 73(7): 669-674. |
| [28] | Yu Y, Zhou Q, Hang Y, et al. Antiestrogenic effect of 20S-protopanaxadiol and its synergy with tamoxifen on breast cancer cells [J]. Cancer, 2007, 109(11): 2374-2382. |
| [29] | 杨 宁, 杨世林, 赵余庆, 等. 稀有人参皂苷糖苷化合成方法的研究进展 [J]. 现代药物与临床, 2014, 29(5): 574-582. |
| [30] | 李荣耀. 人参皂苷的合成尝试 [D]. 郑州: 郑州大学, 2013: 19-55. |
| [31] | Wang W, Rayburn E R, Zhao Y Q, et al. Novel ginsenosides 25-OH-PPD and 25-OCH3-PPD as experimental therapy for pancreatic cancer: Anticancer activity and mechanisms of action [J]. Cancer Lett, 2009, 278(2): 241-248. |
| [32] | 张 锐, 徐华丽, 于小风, 等. 20(S)-原人参二醇对荷瘤裸鼠化疗的增效减毒作用 [J]. 吉林大学学报: 医学版, 2009, 35(2): 195-200. |
| [33] | 冷吉燕, 付 军, 王继萍. 20(S)-原人参二醇对肝癌血管内皮生长因子及碱性成纤维细胞生长因子蛋白表达的影响 [J]. 临床肝胆病杂志, 2008, 24(1): 42-43. |
| [34] | 陈玉玺. 20(S)-原人参二醇微球的制备及评价 [D]. 上海: 上海中医药大学, 2013, 24-58. |
| [35] | 王 冰. 20(S)-原人参二醇自微乳释药系统的制备和体内外评价 [D]. 上海: 上海中医药大学, 2011, 2-56. |
| [36] | 李之韬, 王向涛, 郑 欢, 等. 原人参二醇纳米混悬剂的大鼠在体肠吸收研究 [J]. 药物评价研究, 2015, 38(2): 175-179. |
 2016, Vol. 39
2016, Vol. 39



