2. 军事医学科学院毒物药物研究所, 抗毒药物与毒理学国家重点实验室, 国家北京药物安全评价研究中心, 北京 100850;
3. 广东药学院 实验动物中心, 广东 广州 510006
2. National Beijing Center for Drug Safety Evaluation and Research, State Key Laboratory of Medical Countermeasures and Toxicology, Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing 100850, China;
3. Center of Laboratorial Animals, Guangdong Pharmaceutical University, Guangzhou 510006, China
阿片类物质在临床上常用于术后镇痛治疗。吗啡(Morphine)作为阿片类的代表性物质,镇痛作用极强,对持续性钝痛、间断性锐痛以及内脏绞痛均具有良好疗效,且起效迅速、作用持久。但是,吗啡的低血压、恶心、呕吐,以及严重的致依赖性副作用,令其临床应用受到极大限制。众所周知,吗啡能导致严重的躯体依赖及精神依赖。躯体依赖是指能产生兴奋、失眠、流泪等明显的戒断症状;精神依赖是指能对药物产生强烈的欣快感而导致的强迫性觅药行为。吗啡滥用已造成严重的社会问题和经济问题,寻找有效对抗或减弱吗啡依赖的药物具有重要意义。我国传统中药具有多靶点、多环节、低毒副作用等特点,因而具有重要研究价值和优势。目前,国内多种中药复方已证实具有戒毒治疗作用,如济泰片、消舒合剂、延阳戒毒丸、毒瘾消胶囊、复方延胡索颗粒等,已应用于临床,而这些中药复方中均含延胡索成分。
延胡索为罂粟科植物延胡索Corydalis yanhusuo W. T. Wang的干燥块茎[1],《雷公炮炙论》记载,“治心痛欲死,速觅元胡”。延胡索具有很强的镇痛、镇静、降压和抗心律失常作用,临床上常用作内脏痛、神经痛等的治疗[2]。近年来实验证明,延胡索的复方以及单体在对抗成瘾药物的疼痛、失眠、焦虑等方面具有显著疗效[3]。延胡索的主要活性成分为异喹啉生物碱[4],其中的延胡索乙素水平并非最高,为0.03%~0.11%[5],却是目前为止发现的主要生物活性成分。延胡索乙素由左旋和右旋延胡索乙素两种异构体组成,研究表明左旋延胡索乙素(l-tetrahydropalmatine,l-THP)能显著降低大鼠的慢性神经病理性疼痛[6],提高化疗痛大鼠的痛阈值[7]。对于躯体和精神依赖的研究,也有证据表明l-THP是延胡索发挥作用的主要有效成分,l-THP能改善吗啡依赖大小鼠催促戒断症状[8],抑制大鼠可卡因自身给药行为[9],加速大鼠吗啡条件性位置偏爱(conditioned place preference,CPP)效应的消退[10],而右旋体无类似作用[11]。另一活性成分延胡索甲素(corydaline,Cor)质量分数为0.02%~0.16%,因其具有与延胡索乙素相似的化学结构,因此推测为另一有潜力的生物活性单体。已有研究证明,Cor能有效抑制坐骨神经痛模型大鼠的热痛觉敏感症与冷板的异位性疼痛[12],但其抗依赖效应尚无相关报道。
本研究通过建立吗啡依赖大鼠催促戒断、旷场实验以及行为敏化模型,综合评价、比较Cor和l-THP的抗吗啡躯体依赖和精神依赖的作用,为筛选延胡索抗吗啡依赖有效中药成分提供实验依据。
1 材料 1.1 动物SD大鼠,体质量160~180 g,北京维通利华实验动物技术有限公司提供,动物合格证号SCXK(京)2012-0001。饲养于军事医学科学院国家北京药物安全评价研究中心,室温20~25 ℃,湿度40%~70%,12 h/12 h明暗交替,自由摄食摄水。饲养方式为群养,每笼5~6只。实验前至少适应环境3 d。
1.2 药品吗啡,购于青海制药厂有限公司,批号20110801,质量分数为99.7%;纳洛酮,购于Sigma公司,批号SLBN3866V,质量分数为98%;吗啡和纳洛酮实验前用生理盐水配制成所需浓度。Cor,购于Sigma公司,批号B00227137,质量分数为98%;l-THP,购于成都植标化纯生物技术有限公司,批号140301,质量分数为98%;Cor和l-THP实验前用稀硫酸溶解,配制成所需浓度后NaOH调节pH值为6.0。
1.3 仪器大鼠戒断症状行为观察箱,军事医学科学院实验仪器厂;BigBehv-LA大鼠通用自发活动视频分析系统,上海吉量软件科技有限公司。
2 方法 2.1 对吗啡依赖大鼠戒断反应的影响SD大鼠按体质量随机分为对照组、模型组、Cor(40、80 mg/kg)组和l-THP(5.0、10.0 mg/kg)组,每组10只,雌雄各半。模型制备参照文献方法[13],药物的剂量选择参照文献[8]并结合预实验。模型大鼠连续sc吗啡,1天2次,每天7:30和19:30注射。吗啡剂量逐日递增:第1天,5 mg/kg;第2、3天,10 mg/kg;第4、5天,15 mg/kg;第6、7天,20 mg/kg;第8、9天,25 mg/kg。第9天仅7:30注射1次。对照组相应时间sc等体积生理盐水。第9天吗啡末次注射后,记录大鼠体质量,90 min后各给药组ip相应剂量药物,同时对照组和模型组给予等体积的生理盐水。30 min后所有大鼠均ip纳洛酮(4 mg/kg)促瘾,1~2 min后即可诱发戒断症状。观察催促后60 min内大鼠戒断反应症状,观察结束后记录体质量的变化(降低)。戒断症状评分标准[14]:跳跃、湿狗样摇体、扭体、摇头、打哈欠、扫尾:0次计0分,1~5次计1分,6~10次计2分,>10次计3分;齿颤、咀嚼(次与次之间至少间隔3 s):0次计0分,1~10次计1分,11~20次计2分,>20次计3分;激惹(以尖叫为准)、流涎、流泪、毛发直立、眼睑下垂、腹泻:无症状计0分;轻度计1分;中度计2分;重度计3分。
2.2 旷场实验自发活动行为学实验参照文献方法[15],药物剂量选择参照文献[16, 17]并结合预实验。所有大鼠给药前放入自发活动测试箱中预适应环境3 d,每天1次,每次60 min,测试前大鼠适应环境15 min。各组大鼠按要求给药后,应用大鼠通用自发活动视频分析系统每10 min记录1次,连续测定60 min内大鼠的自主活动情况。
2.2.1 对吗啡诱导的大鼠自发活动的影响SD大鼠按体质量随机分为对照组、模型组、Cor(5、10 mg/kg)组和l-THP(2.5、5.0 mg/kg)组,每组8只,雌雄各半。测试前各给药组大鼠ip相应剂量的药物,对照组和模型组大鼠ip等体积生理盐水,30 min后除对照组sc生理盐水,其余各组均sc吗啡(10 mg/kg),立即测定60 min内大鼠的自发活动情况。
2.2.2 对大鼠自发活动的影响SD大鼠按体质量随机分为对照组、Cor(10、20、40 mg/kg)组和l-THP(2.5、5.0、10.0 mg/kg)组,每组10只,雌雄各半。各组大鼠分别ip生理盐水或相应药物,给药30 min后立即测定60 min内大鼠的自主活动情况。
2.3 对吗啡依赖大鼠行为敏化效应的影响SD大鼠按体质量随机分为对照组、模型组、Cor(5、10 mg/kg)组和l-THP(2.5、5.0 mg/kg)组,每组8只,雌雄各半。行为敏化实验参照文献[18],所有大鼠给药前放入自发活动测试箱中预适应环境3 d。在行为敏化形成期,大鼠每天上午适应环境15 min后,sc吗啡或生理盐水,放入测试箱中检测60 min的自主活动。吗啡注射方案如下:第1天在7:00 sc吗啡(10 mg/kg)1次;第2天分别在7:00和19:00 sc吗啡(10 mg/kg)2次;第3、4天分别在7:00和19:00 sc吗啡(20 mg/kg)2次。各给药组、对照组在给予吗啡30 min前ip相应药物或生理盐水。
2.4 统计学分析数据均以x±s表示,采用SPSS 19.0软件进行统计分析。方差齐性检验后采用单因素方差分析(One-Way ANOVA)进行组间差异分析,如F值差异显著(P≤0.05),用Dunnett’s T检验进行组间比较。
3 结果 3.1 对吗啡依赖大鼠戒断反应的影响吗啡连续9 d递增给药后,纳洛酮催促戒断,大鼠出现湿狗样摇体、齿颤、咀嚼、流涎和流泪等戒断症状。与对照组比较,模型组戒断症状评分显著升高(P<0.01),纳洛酮催促1 h后大鼠体质量明显降低(P<0.01),说明吗啡致大鼠戒断模型制备成功;与模型组比较,l-THP(5.0、10.0 mg/kg)能剂量相关性改善大鼠戒断症状,10 mg/kg剂量组差异显著(P<0.05);Cor(40、80 mg/kg)对戒断症状有改善趋势,但差异不显著。Cor和l-THP对吗啡降低大鼠体质量效应有改善趋势,但差异不显著。结果见图 1。
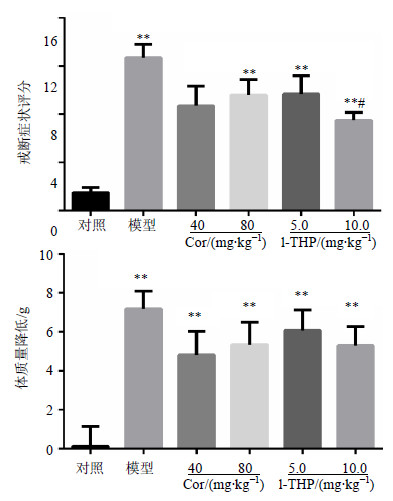 |
与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 *P < 0.05 **P < 0.01 vs control group;#P < 0.05 vs model group 图 1 Cor和l-THP对吗啡依赖大鼠戒断反应的影响 (x±s, n = 10)Fig. 1 Effcets of Cor and l-THP on withdrawal symptoms in morphine-treated rats (x±s, n = 10) |
与对照组比较,模型组的自发活动显著升高(P<0.05);与模型组比较,Cor(5、10 mg/kg)和l-THP(2.5、5.0 mg/kg)预处理均能显著降低吗啡诱发的大鼠高活动性行为(P<0.01),其运动水平甚至低于对照组(P<0.05、0.01)。结果见图 2。
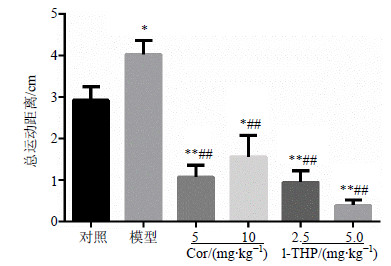 |
与对照组比较:*P<0.05 **P<0.01;与模型组比较:##P<0.01 *P < 0.05 **P < 0.01 vs control group; ##P < 0.01 vs model group 图 2 Cor和l-THP对吗啡致大鼠自发活动增强效应的影响 (x±s, n = 8)Fig. 2 Effcets of Cor and l-THP on locomotion in morphine- treated rats (x±s, n = 8) |
为了考察延胡索两种单体对吗啡依赖大鼠活动性的调节效应是否与其自身的镇静效应有关,单次给予不同剂量的Cor(10、20、40 mg/kg)及l-THP(2.5、5.0、10.0 mg/kg),30 min后测定60 min内大鼠的自主活动情况。与对照组比较,Cor 20 mg/kg及以下剂量对大鼠自发活动无影响,而40 mg/kg能显著降低大鼠的自发活动(P<0.05);l-THP在5.0 mg/kg及以下剂量对大鼠自发活动无影响,而剂量为10.0 mg/kg时大鼠的自发活动显著降低(P<0.01),说明Cor(5.0、10 mg/kg)和l-THP(2.5、5.0 mg/kg)对吗啡诱发的大鼠高活动性行为的降低作用为正常剂量下产生的效应,与因剂量过高产生的镇静作用无关。同时提示10.0 mg/kg的l-THP对戒断症状的改善作用可能与高剂量产生的镇静、安定作用有关。结果见图 3。
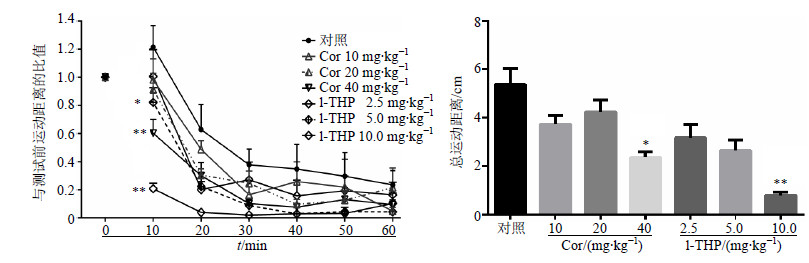 |
与对照组比较:*P<0.05 **P<0.01 *P < 0.05 **P < 0.01 vs control group 图 3 Cor和l-THP对大鼠自发活动的影响 (x±s, n = 10)Fig. 3 Effcets of Cor and l-THP on locomotion in rats (x±s, n = 10) |
连续4 d给予吗啡处理,监测大鼠行为敏化形成期的活动性。与对照组比较,模型组第1天至第4天的活动性均有显著提高(P<0.05、0.01),表明吗啡诱导大鼠行为敏化模型制备成功。与模型组比较,Cor 5 mg/kg剂量组仅在第1天显著降低吗啡诱发的大鼠高活动性行为(P<0.01),第2、3天仍有抑制作用,但差异不显著;Cor 10 mg/kg剂量组在第1、3、4天显著降低吗啡诱发的大鼠高活动性行为(P<0.05、0.01);l-THP 2.5、5.0 mg/kg剂量组在第1至第4天均能显著降低吗啡诱发的大鼠高活动性行为(P<0.05、0.01),并呈剂量依赖性。结果见图 4。
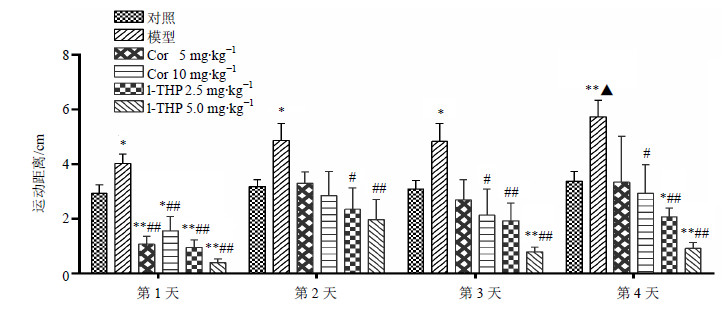 |
与对照组比较:*P<0.05 **P<0.01;与模型组比较:##P<0.01;与第1天模型组比较:▲P<0.05 *P < 0.05 **P < 0.01 vs control group; ##P < 0.01 vs model group; ▲P < 0.05 vs model group on 1st day 图 4 Cor和l-THP对吗啡依赖大鼠行为敏化形成的影响 (x±s, n = 8)Fig. 4 Effcets of Cor and l-THP on fomation of behavioral sensitization in morphine-treated rats (x±s, n = 8) |
目前,国内外评价药物依赖性的动物行为评价方法,一般分为躯体依赖和精神依赖实验两大类。在评价药物是否具有依赖性或评价药物是否能对公认的依赖药物有治疗作用时,应结合躯体依赖和精神依赖动物模型。其中,躯体依赖实验包括自然戒断和催促戒断实验。催促戒断是指在动物对药物形成依赖后,用拮抗剂加快戒断症状的发生,观察动物的戒断症状并进行综合评分。催促戒断实验动物模型建立周期短、戒断症状发生快、持续时间短,常用于评价躯体依赖。旷场实验是用于评价动物的自发活动的经典行为学实验。在精神药理学研究中,用于检测药物是否对动物行为产生影响,其特点为操作简单,适合早期筛选。行为敏化是精神依赖性评价的常用动物模型,是指反复、间断给予依赖性药物后,动物的活动性增加的现象[19]。行为敏化与药物成瘾、复吸和渴求密切相关,是评价药物致依赖潜力和干预作用的重要行为学实验。本研究利用吗啡催促戒断、旷场实验、行为敏化动物模型,对延胡索生物活性单体的抗吗啡依赖作用进行更深入的研究,分析、比较Cor和l-THP对吗啡成瘾的调节作用,对筛选延胡索有效成分抗吗啡依赖提供实验依据。
本研究在躯体依赖性实验中,建立了吗啡依赖大鼠催促戒断模型,l-THP(10.0 mg/kg)能显著改善大鼠戒断症状,而Cor剂量达80 mg/kg时对戒断症状仍无显著改善,且两者对吗啡依赖导致的体质量降低效应均无显著影响,说明l-THP有部分抗吗啡躯体依赖作用,而Cor不产生抗吗啡躯体依赖作用。在精神依赖性实验中,旷场实验结果显示,Cor(5、10 mg/kg)和l-THP(2.5、5.0 mg/kg)均能显著降低吗啡诱发的大鼠高活动性行为,Cor起效剂量明显高于l-THP;同时也观察到,延胡索两单体处理组大鼠的活动水平均低于对照组。为此,本研究对单独分别给予各剂量的延胡索单体进行测试。结果表明Cor(40 mg/kg)和l-THP(10.0 mg/kg)抑制大鼠的自发活动行为,Cor和l-THP分别在20 mg/kg和5.0 mg/kg剂量以下对大鼠活动性无明显影响。证明两中药单体抑制急性吗啡诱导的大鼠自发活动并非高剂量条件下药物的镇静效应所致,因此在行为敏化模型也在不影响大鼠自发活动的剂量下进行。在行为敏化动物模型中,Cor(5、10 mg/kg)和l-THP(2.5、5.0 mg/kg)在行为敏化形成期内能显著降低吗啡诱发的大鼠高活动性行为,且l-THP具有剂量依赖性。综合自发活动和行为敏化实验结果,提示Cor和l-THP具有降低吗啡精神依赖的作用,但在相同剂量下,Cor的疗效明显低于l-THP。
研究表明,l-THP能作用于多巴胺(DA)系统,作为DA受体阻滞剂[20, 21],逆转阿片类药物促进DA释放,发挥镇静安定、镇痛等作用;而多巴胺系统所构成的奖赏环路,是药物依赖效应的核心理论。在对多巴胺受体的亲和力而言,Cor和l-THP虽然有相似的化学结构,如有相同的四氢异喹啉母核,但Cor较l-THP在B环C13上多1甲基连接;且与Cor比较,l-THP的N+朝下,手性(C14)-H朝向上方,更有利于N+与DA受体残基上-COO-形成离子对结合[22]。Cor B环上的-CH3与苯环形成微弱的超共轭给电子效应,减弱了N+的吸电子能力,从而与DA受体亲和力减弱。虽然两单体的抗吗啡依赖效应的机制尚不完全清楚,但这些化学结构方面的差异可能是导致Cor和l-THP效价水平差异的原因。
中药复方配伍是中医用药的特色,随着中药国际化需求,中药单体和其作用机制研究也在逐渐受到重视。吗啡成瘾的作用机制复杂,而中药多靶点、多途径治疗恰能解决西药单一治疗的缺点。对具抗吗啡依赖效应的中药开发可先从中药单体以及其作用机制方面进行研究。本研究证明l-THP具有抗吗啡躯体依赖和精神依赖作用,Cor也具有抗吗啡精神依赖潜力,而两者的抗依赖临床应用前景还有待更深入的研究。对于Cor与l-THP的合用疗效是否优于单独使用,Cor与l-THP对脑区中递质、受体及信号传导系统等的影响,以及开发延胡索其他具抗吗啡依赖作用的单体,还有待进一步研究。
| [1] | 中国药典[S]. 一部. 2015: 196. |
| [2] | 李玉和. 延胡索药对治疗痛证的临床应用[J]. 辽宁中医杂志, 2010, 37(12): 2346-2347. |
| [3] | 胡 晨, 莫志贤, 王瑞丞. 延胡索戒毒作用研究进展[J]. 医药导报, 2007, 26(8): 914. |
| [4] | 贺 凯, 高建莉, 赵光树. 延胡索化学成分、药理作用及质量控制研究进展[J]. 中草药, 2007, 38(12): 1909-1912. |
| [5] | 王登峰, 罗 云. HPLC法同时测定延胡索中3种生物碱类成分的含量[J]. 中国药房, 2012, 23(31): 2951-2953. |
| [6] | 王殊秀, 冷玉芳, 高向梅, 等. 延胡索乙素对大鼠慢性神经病理性疼痛的影响[J]. 临床麻醉学杂志, 2012, 28(7): 705-707. |
| [7] | 宫登辉, 江永祥, 郑卫红, 等. 左旋延胡索乙素对化疗痛大鼠痛阈的影响及其在脊髓水平的机理研究[J]. 中药药理与临床, 2013, 29(5): 27-29. |
| [8] | 葛晓群, 张洪泉, 周华珠, 等. 四氢原小檗碱同类物缓解吗啡戒断症状作用的实验研究[J]. 中国药物依赖性杂志, 1999, 8(3): 182-184. |
| [9] | Xi Z X, Yang Z, Li S J, et al. Levo-tetrahydropalmatine inhibits cocaine's rewarding effects: experiments with self-administration and brain-stimulation reward in rats[J]. Neuropharmacology, 2007, 53(6): 771-782. |
| [10] | 余守洋, 杨培润, 钱 刚, 等. 延胡索及L-THP对吗啡条件性位置偏爱大鼠奖赏环路多巴胺系统的影响及比较[J]. 中国中药杂志, 2013, 38(22): 2928-2932. |
| [11] | Jin G Z, Xu S X, Yu L P. Different effects of enantiomers of tetrahydropalmatine on dopaminergic system[J]. Sci Sin B, 1986, 29(10): 1054-1064. |
| [12] | 何钟德. 延胡索甲、乙素对坐骨神经痛大鼠止痛作用及其抗TRPV-1机理的研究[D]. 广州: 广州中医药大学, 2012. |
| [13] | Parvizpour A, Charkhpour M, Habibi-asl B, et al. Repeated central administration of selegiline attenuated morphine physical dependence in rat[J]. Pharmacol Rep, 2013, 65(3): 593-599. |
| [14] | Ling G S, Tappe N S, Inturrisi C E. Methadone induced physicaldependence in the rat[J]. Life Sci, 1984, 34(7): 683-690. |
| [15] | Schiørring E, Hecht A. Behavioral effects of low, acute doses of morphine in nontolerant groups of rats in an open-field test[J]. Psychopharmacology (Berl), 1979, 64(1): 67-71. |
| [16] | 赵 娜, 王 亮, 朱 杰, 等. 左旋四氢巴马汀降低MA引起的小鼠行为敏化及ERK磷酸化表达的增加[J]. 中国药物依赖性杂志, 2010, 19(5): 413-438. |
| [17] | 刘艳丽, 颜玲娣, 亓 佳, 等. l-四氢巴马汀抑制羟考酮引起小鼠行为敏化的实验研究[J]. 中国药理学通报, 2007, 23(12): 1613-1617. |
| [18] | Fu Z, Yang H, Xiao Y, et al. The gamma-aminobutyric acid type B (GABA B) receptor agonist baclofen inhibits morphine sensitization by decreasing the dopamine level in rat nucleus accumbens[J]. Behav Brain Funct, doi: 10.1186/1744-9081-8-20. |
| [19] | Robinson T E, Berridge K C. Incentive-sensitization and addiction[J]. Addiction, 2001, 96(1): 103-114. |
| [20] | Huang K, Dai G Z, Li X H, et al. Blocking L-calcium current by 1-tetrahydropalmatine in single ventricular myocyte of guineapigs[J]. Acta Pharmacol Sin, 1999, 20(10): 907-911. |
| [21] | Wang J B, Mantsch J R. L-Tetrahydropalamatine: a potential new medication for the treatment of cocaine addiction[J]. Future Med Chem, 2012, 4(2): 1-16. |
| [22] | Tang Y, Chen K X, Jiang H L, et al. Molecular modeling of interactions between tetrahydroprotoberberines and dopamine receptors[J]. Acta Pharmacol Sin, 1996, 17(1): 8-12. |
 2016, Vol. 39
2016, Vol. 39


