肾脏是人体药物代谢和排泄的最重要器官,由于其特殊的结构和功能,对药物毒性作用极具易感性。当前,药物肾毒性已成为临床前药物中止研发和临床不良反应的主要原因。据估计,药物造成的肾损伤占所有急性肾损伤病例的19%~25%,对患者的身心健康造成极大危害[1]。目前临床前试验中常用的肾功能评价指标,如血清尿素氮(BUN)和肌酐(Cr),灵敏度较差。研究发现,当肾小球滤过率下降至正常值的50%以下,常用评价指标才表现出明显的升高,对于大多数早期的肾损伤往往不能及时作出诊断[2, 3]。因此,探寻能早期、快速、准确地评价药物肾毒性的方法已成为新药研发中的一个重要问题。
肾损伤分子-1(Kim-1)是由肾脏近曲小管上皮细胞分泌的一种跨膜1型糖蛋白,属于免疫球蛋白基因超家族成员,在正常肝脏和肾脏等组织中有微量表达[4]。在肾脏受损后,肾近曲小管上皮细胞中Kim-1表达明显增强,并大量释放进入尿液,使得尿液中Kim-1水平增加;研究证实,在急性肾小管坏死患者的肾脏活检标本中发现Kim-1的表达显著增加,其尿液水平也有所升高。目前,尿液Kim-1已作为一种无创性肾小管毒性生物标志物应用于临床实践中[4, 5]。为了进一步研究Kim-1在预测药物的肾脏毒性中的灵敏度和特异性,本研究在庆大霉素诱导Wistar大鼠急性肾损伤模型中系统地评价尿液Kim-1的诊断性能,并与传统肾功能指标进行比较。
1 材料 1.1 药物及主要试剂庆大霉素(美国AppliChem公司,批号0Q0055633);Luminex液相芯片大鼠肾毒性MILLIPLEX®MAP试剂盒,(美国Merck Millipore公司)。
1.2 仪器7060型全自动生化分析仪,日本日立公司;Luminex200TM液相芯片分析平台,美国Luminex公司。
1.3 动物及饲养条件雄性VAF级8~9周龄Wistar大鼠,体质量230~270 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK-京-2007-0001。放置万级屏障系统饲养,每笼3只,自由饮食饮水。温度20~26 ℃,相对湿度40%~70%,每小时换气8~10次,每天光照与黑暗各12 h。
2 方法 2.1 大鼠急性肾损伤模型的制备大鼠经1周检疫驯化合格后,根据体质量随机分为3组:对照组及庆大霉素低、高(60、120 mg/kg)剂量组,每组24只。庆大霉素组ip给药,给药体积5 mL/kg,每天给药1次,连续给药10 d,对照组大鼠给予等体积的生理盐水。
2.2 生物样本的采集给药第2、4、8、11 d分别对每组6只大鼠进行解剖。每次解剖前,将各组6只大鼠放入代谢笼中收集16 h过夜尿,4 ℃、1 500 r/min离心10 min,上清分装用于后续生物标志物检测;戊巴比妥钠(45 mg/kg)麻醉大鼠后,自下腔静脉采集血液,3 000 r/min离心10 min,分离血清用于后续BUN和Cr测定;解剖大鼠,取左右肾脏。
2.3 组织病理学评分取左、右肾脏,固定后经修块取材,依次进行脱水、包埋、切片以及苏木精-伊红(HE)染色,最后镜检进行病理学评分。分级标准参照文献[6],包括无(−)、极轻度(+)、轻度(++)、中度(+++)、重度(++++)和极重度(+++++)。
2.4 传统肾功能指标的检测使用日立7060型自动生化仪检测血清BUN和Cr水平、尿液Cr水平。
2.5 Luminex液相芯片检测尿液Kim-1水平严格按照试剂盒说明书操作,在96孔板中依次加入质控、标准品和已稀释尿液样本,每孔25 μL,随后每孔加入25 μL生物素化谷胱甘肽巯基转移酶(GST)、25 μL混合微珠。封板后4 ℃摇床过夜(16~18 h)。洗板后每孔加入检测抗体50 μL,室温放置1 h。每孔加入50 μL链霉亲和素藻红蛋白,室温放置30 min后洗板,每孔加入125 μL鞘液,在摇床上重悬微珠5 min,最后在Luminex仪器上读板,根据标准曲线计算Kim-1浓度,并使用同时期Cr数据进行标准化。
2.6 统计学分析不同时间点各标志物分析结果以x±s表示,采用SPSS 20.0软件进行单因素方差分析,并制作受试者操作特性曲线(ROC),以肾脏组织病理学损伤作为金标准,使用MedCalc 12.7.7软件进行各标志物间的ROC曲线下面积(AUC)统计分析,以评价各标志物的灵敏度和特异性。
3 结果 3.1 大鼠肾脏组织病理学损伤除第2天个别大鼠出现极轻度的肾小管上皮细胞损伤外,肾小管上皮细胞的变性、坏死表现出明显的时间和剂量相关性。随给药剂量及给药时间的增加,庆大霉素组出现病变的动物数增加,病变程度也随之加重。结果见表 1。
| 表 1 大鼠连续ip庆大霉素的肾脏组织病理学检查结果 Table 1 The histopathological findings of kidneys from rats following continuous ip with gentamicin |
与对照组比较,庆大霉素低、高剂量组大鼠尿液Kim-1水平在给药第4天即出现显著升高(P<0.05),分别为对照组的1.8、3.4倍,增幅程度明显优于传统的BUN和Cr,并且随着给药时间和剂量的增加呈现出升高的趋势。至给药第11天,尽管60 mg/kg组平均增幅高达54.7倍,但由于个体差异较大,导致与对照组比较差异不显著,而120 mg/kg组的Kim-1平均值在第11天为对照组83.7倍,与对照比较差异显著(P<0.01)。结果见图 1。
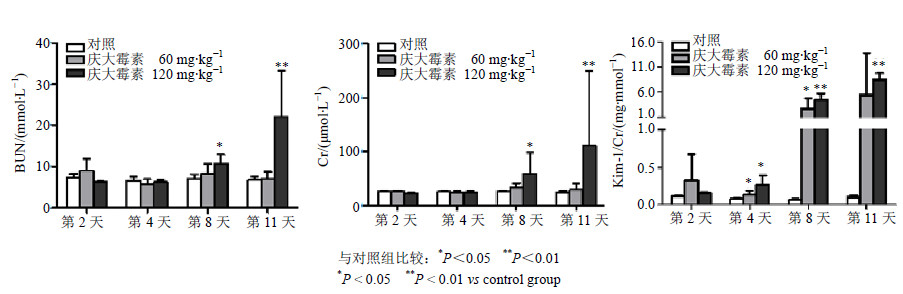 |
与对照组比较:*P<0.05 **P<0.01 *P < 0.05 **P < 0.01 vs control group 图 1 大鼠连续ip庆大霉素后血清BUN、Cr以及尿液Kim-1的水平变化 (x±s, n = 6)Fig. 1 Changes of serum BUN, Cr and urinary Kim-1 in rats following continuous ip injection with gentamicin (x±s, n = 6) |
ROC分析结果显示尿Kim-1的AUC值高达0.915,95%置信区间为0.804~0.974,显著高于传统评价指标BUN(0.740,95%置信区间为0.600~0.852,P=0.017)和Cr(0.719,95%置信区间为0.577~0.835,P=0.009),进一步证实Kim-1诊断性能的灵敏度和特异性高于BUN和Cr。
4 讨论本研究中,选择庆大霉素作为肾毒性药物建立大鼠急性肾损伤模型。文献报道,给予40 mg/kg以上剂量的庆大霉素即可引起明显的肾损伤[7]。组织病理学结果表明,连续10 d ip 60、120 mg/kg庆大霉素后,在给药第8天大鼠肾脏出现预期组织病理学改变,从而证实了实验的有效性。在第2天部分动物出现极轻度肾小管上皮细胞的变性、坏死,可能是由于动物间个体差异,偶发的背景性病变。
与文献一致[8, 9, 10],本研究发现,在庆大霉素诱导大鼠急性肾损伤模型上,传统的肾损伤生物标志物血清BUN和Cr的敏感性相对较差。在给药第8天,一些大鼠肾脏已出现明显损伤,而血清中BUN和Cr并没有异常变化。相比较,自第4天起,大鼠肾脏未出现组织病理变化时,尿液Kim-1浓度已发生显著性升高,具有一定前驱效应,可用于肾损伤的早期诊断。
本研究发现,尿液中Kim-1水平自第4天起持续上升,表现出明显的给药剂量及时间相关性,ROC分析也表明尿Kim-1高达0.915,显著高于BUN和Cr,进一步证实Kim-1优于传统肾功能评价指标。本研究仅有一种肾毒性药物建模,考虑到不同药物引起肾毒性作用机制不同,应在更多的药物急性肾损伤模型中评价其灵敏度和特异性。
近些年,随着生物技术尤其是组学技术的不断发展,很多发达国家已将开发高效的安全性生物标志物列为未来医药发展的重点。国际性上两个重要的研究组织即国际生命科学学会健康和环境科学研究所(LSI/HESI)、关键路径研究所(C-Path)成立了药物安全性预测联盟,正在积极开展一系列新的肾毒性生物标志物的筛选和验证工作。目前,美国食品药品监督管理局和欧洲药品管理局已批准包括尿Kim-1在内8种肾损伤生物标志物可用于药物的临床和临床前安全性评价中,补充传统肾功能指标与肾脏组织病理分析结果[11]。而中国药物肾毒性生物标志物研究起步较晚,为了尽快推动这些新的生物标记物纳入我国药物临床前安全性评价体系中,应在今后开展更多的生物标志物验证研究。
| [1] | Luyckx V, Naicker, S. Acute kidney injury associated with the use of traditional medicines [J]. Nat Clin Pract Nephrol, 2008, 4(12): 664-671. |
| [2] | Bellomo R, Ronco C, Kellum J A, et al. Acute renal failure - definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group [J]. Crit Care, 2004, 8(4): R204-212. |
| [3] | Han W K, Waikar S S, Johnson A, et al. Urinary biomarkers in the early diagnosis of acute kidney injury [J]. Kidney Int, 2008, 73(7): 863-869. |
| [4] | Bonventre J V. Kidney injury molecule-1: a translational journey [J]. Trans Am Clin Climatol Assoc, 2014, 125: 293-299. |
| [5] | Vaidya V S, Ozer J S, Dieterle F, et al. Kidney injury molecule-1 outperforms traditional biomarkers of kidney injury in preclinical biomarker qualification studies [J]. Nat Biotechnol, 2010, 28(5):478-485. |
| [6] | Kelleher S P, Robinette J B, Miller F, et al. Effect of hemorrhagic reduction in blood pressure on recovery from acute renal failure [J]. Kidney Int, 1987, 31(3): 725-730. |
| [7] | Mingeot-Leclercq M P, Tulkens P M. Aminoglycosides: nephrotoxicity [J]. Antimicrob Agents Chemother, 1999, 43(5): 1003-1012. |
| [8] | Ozer J S, Dieterle F, Troth S, et al. A panel of urinary biomarkers to monitor reversibility of renal injury and a serum marker with improved potential to assess renal function [J]. Nat Biotechnol, 2010, 28(5): 486-494. |
| [9] | Hoffmann D, Fuchs T C, Henzler T, et al. Evaluation of a urinary kidney biomarker panel in rat models of acute and subchronic nephrotoxicity [J]. Toxicology, 2010, 277(1-3): 49-58. |
| [10] | 申 俊, 刘 妍, 张金晓, 等. 肾损伤分子-1、丛生蛋白和胱抑素C对庆大霉素诱导的大鼠肾损伤早期预测的研究 [J]. 药物评价研究, 2011, 34(4): 251-254. |
| [11] | Dieterle F, Sistare F, Goodsaid F, et al. Renal biomarker qualification submission: a dialog between the FDA-EMEA and Predictive Safety Testing Consortium [J]. Nat Biotechnol, 2010, 28(5): 455-462. |
 2016, Vol. 39
2016, Vol. 39


