2. 总后卫生部药品仪器检验所, 北京 100071;
3. 军事医学科医学院毒物药物研究所, 抗毒药物与毒理学国家重点实验室, 国家北京药物安全评价研究中心, 北京 100850
2. Institute for Drug Control of PLA, Beijing 100071, China;
3. National Beijing Center for Drug Safety Evaluation and Research, State Key Laboratory of Toxicology and Medical Countermeasures, Academy of Military Medical Sciences, Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing 100850, China
何首乌为蓼科(Polygonaceae)植物何首乌Polygonum multiflorum Thunb.的干燥块根,常用于解毒、截疟、补肝肾、益精血、乌须发,为滋补延年佳品[1],在中国应用广泛。但近年来,关于何首乌及其制剂引起不良反应的报道大量增加,国内外文献报道有关何首乌肝损伤病例约150例[2, 3],影响到我国中药产业的发展。2006年,英国和澳大利亚等药监部门先后发布了何首乌肝损伤警告信息;据此,2013年,我国药监部门对含首乌制剂肝损伤也发出警戒。为了我国中药产业的发展,亟待阐明何首乌肝损伤的物质基础及相关机制。
与化学药物比较,中药的毒性相对较小,都是发生在较大剂量、长期服用的情况下。以前对于何首乌的研究都是采用传统的致肝损伤药物脂多糖(LPS),通常需超大剂量(40~60 g/kg)及长期给药(4~12周)[4, 5],但从临床肝损伤病例来看,何首乌所引发的肝脏毒性,存在与机体的免疫系统相关、特异质等特点。由于中药的复杂性,不同药物可通过不同的机制导致肝损伤,而代谢特异质是药物性肝损伤的主要机制之一,肝脏各种免疫增强剂引起的炎症反应导致肝损伤,与CYP450表达、活性以及对肝脏活动的调节有关[6]。因此,要了解药物致肝损伤机制,需先了解药物在肝中的代谢特 点[7],细胞色素P450(cytochrome P450,CYP450)是生物体内主要的I相药物代谢酶[8],其诱导和抑制作用是药物引起不良反应的主要原因[9]。在CYP450亚族当中,由于CYP1A2高保守性和易感性,最适合代替主要人肝细胞型号[10];CYP2E1能激活许多内源性物质转化为肝毒性物质[11];CYP3A1在多种外源性物质和药物的代谢中起到至关重要的作用,是最重要最丰富的CYP450酶[12]。
因此,本研究采用目前较广泛诱导肝损伤的诱导剂LPS,LPS可以激活免疫系统和炎症细胞,释放自由基和炎症因子放大炎症反应,模拟与临床接近的何首乌致大鼠肝毒性模型,同时研究何首乌乙醇提取液(alcohol extract of P. multiflorum,AEP)对大鼠肝脏CYP450酶活性及对各亚型蛋白表达的影响,了解何首乌与药物合用的相互作用,以期为临床合理用药及监测提供试验依据。
1 材料 1.1 药物及主要试剂AEP(由解放军302医院全军中医药研究所肖小河教授课题组提供;其何首乌生药购自北京绿色药源公司,由肖小河教授鉴定为何首乌Polygonum multiflorum Thunb.的干燥块根;应用冷沉浸法,50%乙醇2次提纯,2次提取物混合后得生药量为3 g/mL的溶液,批号13101701。);LPS(Sigma公司,批号L2880);对乙酰氨基酚(acetaminophen,APAP,北京曙光药业有限公司,批号H11020830)。
RIPA裂解液P0013B、BCA蛋白浓度测定试剂盒P0010A(上海碧云天生物技术有限公司);PMSF(蛋白酶抑制剂,罗氏);Super ECL超敏发光液试剂盒P1010(普利莱基因技术有限公司);动物组织S9组分分离试剂盒、大鼠CYP450亚酶CYP1A2、CYP2E1、CYP3A1活性荧光定量检测试剂盒(上海杰美基因医药科技有限公司);CYP1A2(批号ab22717)、CYP2E1(批号ab28146)、CYP3A1(批号ab22733)、GAPDH(批号ab9485)、HRP标记的羊抗鼠IgG抗体(ab97051)均购于Abcam公司;Goat anti-mouse IgG antibody(HRP)购于arigo 公司。
1.2 动物100只SPF级雄性SD大鼠,体质量(200±20)g,购于北京维通利华实验动物科技有限公司,合格证号SCXK(京)2012-0001。饲养于国家北京药物安全评价研究中心GLP实验室,12 h/12 h明/暗光照周期,温度(20~24)℃,提供过滤的饮用水,自由饮食。该实验室已通过国际实际动物评估和认可委员会认证。
1.3 仪器XT-2000iv自动血液分析仪(日本Sysmex公司);Centrifuge 5415D离心机(Eppendorf公司);Victor 1420多功能酶标仪(美国Perkin Elmer公司);电泳仪(美国Bio-RAD公司);HH-2数显恒温水浴锅(常州国华电器有限公司);SF-300型塑料薄膜封口机(温州市兴业机械设备有限公司)。
2 方法 2.1 动物分组及何首乌药肝模型的制备100只SD雄性大鼠随机分为:对照组、APAP组、LPS组、(LPS+APAP)组、AEP组、(LPS+AEP)组,对照组与LPS组每组20只,其余各组每组15只。LPS组、(LPS+APAP)组和(LPS+AEP)组大鼠按体质量尾iv给予4 mg/kg LPS;2 h后,APAP及(LPS+APAP)组分别ig给予625 mg/kg APAP;AEP及(LPS+AEP)组ig 6 g/kg(相当于临床给药剂量的11倍)AEP,每天1次,连续给药7 d。
2.2 血清ALT、AST和ALP水平及肝脏系数的检测选取造模后2和14 h、5和8 d 4个时间点,对各组5只大鼠称体质量、腹主动脉采血,3 000 r/min,离心10 min,置于全自动生化分析仪测定上清中的测定ALT、AST和ALP的量。并活检取肝脏,计算肝脏系数(肝脏系数=100×肝质量/体质量)。
2.3 肝组织病理学检测给药结束后,大鼠禁食12 h,经5%戊巴比妥钠ip麻醉,取适量肝脏组织,放入4%多聚甲醛溶液固定后,石蜡包埋,制成石蜡肝脏样本,切片机切成4 μm厚度,常规脱蜡水化,经苏木精-伊红(HE)染色后光镜检查。
2.4 荧光法测定AEP对LPS诱导大鼠肝脏CYP 450酶活性的影响大鼠安乐死后,取出肝脏组织,用生理盐水反复冲洗去除血液;取部分组织称质量,放进预冷的1.5 mL锥形离心管,加入适量的(1 g组织需要10 mL)清理液清洗1次;移入一个液氮冻存管,即刻放入液氮罐过夜,次日取出即刻碾碎组织成粉末;放进一个1.5 mL锥形离心管,加入3 mL预冷的平衡液,涡旋震荡5 s,充分混匀;即刻放入预冷的玻璃匀浆器,在冰槽里用研磨棒匀化组织(约80下);移入1.5 mL锥形离心管,4 ℃、15 000×g超速离心机离心1 h;即刻移取上清液分装到新的0.2 mL离心管,利用荧光法测定各亚酶活性,严格按照各试剂盒说明书进行操作。
2.5 Western blotting检测AEP对LPS诱导大鼠肝脏CYP450亚酶蛋白表达的影响称取部分肝脏组织剪切成细小的碎片,取适量裂解液,使用前数分钟加入PMSF蛋白酶抑制剂,每20 mg组织加入150 μL裂解液,用玻璃匀浆器匀浆,充分溶解后,14 000×g离心3~5 min,取上清分装于0.2 mL的锥形离心管中,采用BCA试剂盒于562 nm处测定样品蛋白浓度。采用12%的SDS-PAGE分离总蛋白,蛋白质转移到PVDF膜,5%的脱脂奶粉室温封闭1 h,将膜放入杂交袋中,加入一抗CYP1A2、CYP2E1、CYP3A1、GAPDH 4 ℃孵育过夜,使抗原抗体充分结合。隔天,将膜从杂交袋中取出,用TBST洗涤3次,再放入加有二抗的器皿中室温孵育1 h,用ECL化学发光试剂盒进行检测,以目的蛋白吸光度(A)值与内参A值的比值表示某样品目的蛋白的相对水平。
2.6 统计学分析数据以x±s表示,采用SPSS 19.0及GraphPad Prism 6软件进行分析。采用单因素方差分析进行方差齐性检验,方差齐时用LSD法进行组间比较,方差不齐时采用Dunnett’s T 3法进行组间比较。
3 结果 3.1 对大鼠体质量的影响(LPS+AEP)组从给予LPS后2 h至第8天与对照组和AEP组比较体质量下降(P<0.05);(LPS+APAP)组和(LPS+AEP)组从第2小时到14小时体质量与LPS组比较差异不显著;LPS组和(LPS+AEP)组第14小时及第5、8天体质量分别显著低于对照组和AEP(P<0.05)。然而,到第8天,LPS组与(LPS+AEP)组比较,大鼠体质量明显恢复正常(P<0.05)。结果见图 1。
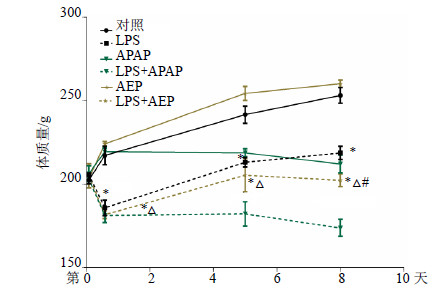 |
与对照组比较:*P<0.05;与LPS组比较:#P<0.05;与AEP组比较:△P<0.05 *P < 0.05 vs control group; #P < 0.05 vs model group; △P < 0.05 vs AEP group 图 1 AEP对药肝模型大鼠第2和14小时、5和8天体质量变化的影响(x±s, n = 5)Fig. 1 Effect of AEP on body weight change of rats at 2 and 14 h, and days 5 and 8 (x±s, n = 5) |
经LPS诱导2 h后,与对照组比较,LPS组大鼠肝脏系数显著升高(P<0.05),说明LPS激活免疫细胞可引起大鼠肝脏肿胀;一直持续到第14小时,在第14小时,LPS、(LPS+APAP)和(LPS+AEP)组与对照组比较,肝脏系数均差异显著(P<0.05);第5天,与对照组比较,LPS组肝脏系数逐渐恢复,APAP组、(LPS+APAP)组和(LPS+AEP)组肝脏系数显著升高(P<0.05);第8天,LPS组和AEP组肝脏系数与对照组基本接近;与LPS组和对照组比较,(LPS+APAP)组和(LPS+AEP)组肝脏系数显著升高(P<0.05)。各组肝脏系数分别用与各个时间点对照组平均数的比值表示,见图 2。
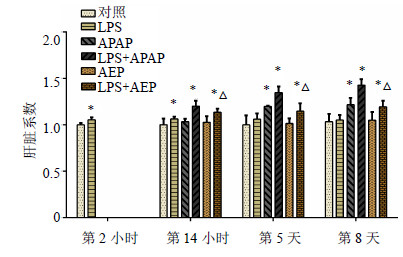 |
与对照组比较:*P<0.05;与AEP组比较:△P<0.05 *P < 0.05 vs control group; △P < 0.05 vs AEP group 图 2 AEP对各组大鼠第2和14小时、5和8天的肝脏系数的影响 (x±s, n = 5)Fig. 2 Evolution of liver to body weight ratio in each group during experiment at 2 and 14 h, and days 5 and 8 (x±s, n = 5) |
经LPS诱导2 h后,与对照组比较,LPS组大鼠血清ALT、AST和ALP水平升高;给药第5和8天,LPS组ALT、AST、ALP没有显著变化;第8天,(LPS+AEP)组血清ALT、AST、ALP值在正常范围内变化,与LPS组比较,差异不显著;而APAP组及(LPS+APAP)组血清ALT、AST、ALP值升高,(LPS+APAP)组与LPS组比较,ALT、ALP值差异显著(P<0.05),结果见表 1。
| 表 1 AEP对大鼠不同时间点血清ALT、AST、ALP水平的影响 Table 1 Effect of AEP on serum ALT, AST, and ALP of rats in different time points |
HE染色组织病理学检查发现,经LPS诱导2 h后,LPS组大鼠肝实质微小肉芽肿。第8天,LPS组肝细胞结构恢复正常;AEP组肝细胞结构正常;(LPS+AEP)组显著肝细胞变性,局部慢性炎性灶;APAP组可见肝细胞变性,小灶状坏死;(LPS+APAP)组肝细胞大范围片状呈灶性坏死。结果见图 3。
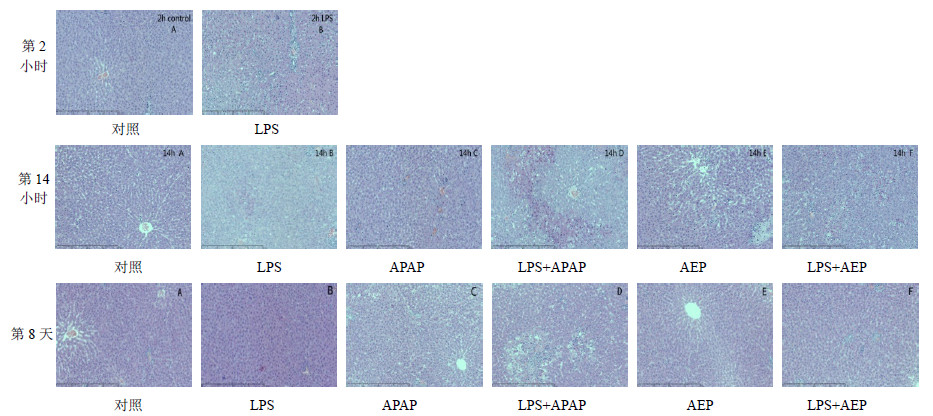 | 图 3 第2、14小时及第8天大鼠肝脏病理学检查Fig. 3 Pathologic changes of liver tissues of rats at 2 and 14 h, and day 8 |
大鼠肝脏经LPS诱导2 h后,与对照组比较,肝脏CYP1A2、CYP2E1和CYP3A1酶活性显著降低(P<0.05),可知LPS诱发的免疫作用与抑制CYPs酶活性有关;第14小时,与对照组比较,LPS组和(LPS+AEP)组大鼠肝脏这3种酶的活性下降(P<0.05);第5天,与对照组比较,LPS组CYP450亚酶活性无显著变化,而APAP组、(LPS+APAP)组大鼠肝脏CYP450亚酶活性升高(P<0.05);而(LPS+AEP)组大鼠肝脏CYP450亚酶活性下降(P<0.05);第8天,与对照组比较,LPS组大鼠肝脏CYP450亚酶活性无显著变化,(LPS+AEP)组大鼠酶活性显著下降(P<0.05),其中CYP1A2活性较CYP2E1和CYP3A1下降明显,(LPS+AEP)组与LPS组比较,3种酶活性差异显著(P<0.05)。结果表明,AEP产生的肝脏毒性与抑制CYP1A2、CYP2E1、CYP3A1的活性有关,结果见图 4。
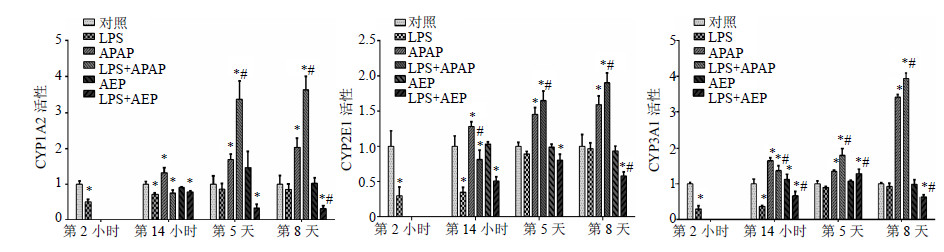 |
与对照组比较:*P<0.05;与LPS组比较:#P<0.05 *P < 0.05 vs control group; #P < 0.05 vs model group 图 4 AEP对各组大鼠肝脏CYPs酶活性在第2、14小时、5、8天变化情况的影响 (x±s, n = 5)Fig. 4 Effect of AEP on CYP1A2, CYP2E1, and CYP3A1 activity at 2 and 14 h, and days 5 and 8 during LPS activated in rats (x±s, n = 5) |
大鼠肝脏经LPS诱导2 h后,与对照组比较,肝脏CYP1A2蛋白表达显著降低(P<0.05);第14小时,与对照组比较,LPS组、(LPS+APAP)组和(LPS+AEP)组CYP1A2蛋白表达降低(P<0.05);第5天,与对照组比较,LPS组和AEP组CYP1A2蛋白表达无显著变化,而APAP组、(LPS+APAP)组和(LPS+AEP)组蛋白表达显著降低(P<0.05);第8天,与对照组比较,APAP组、(LPS+APAP)组和(LPS+AEP)组蛋白表达显著降低(P<0.05),AEP组无显著变化;从第8天检测结果可知,(LPS+AEP)组与正常组相比CYP1A2蛋白表达显著降低,且与LPS组比较有显著性差异(P<0.05),说明AEP经LPS诱导致肝损伤与抑制CYP1A2蛋白的表达有关。结果见图 5。
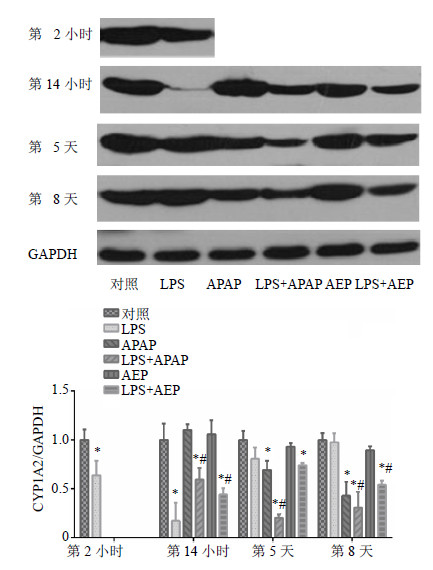 | 图 5 各组大鼠肝脏CYP1A2蛋白在第2、14小时和5、8天表达变化情况 (x±s, n = 3)Fig. 5 Evolution of CYP1A2 protein expression in each group during experiment at 2 and 14 h, and days 5 and 8 (x±s, n = 3) |
大鼠肝脏经LPS诱导2 h后,与对照组比较,肝脏CYP2E1蛋白表达显著降低(P<0.05);第14小时,与对照组比较,LPS组、(LPS+APAP)组和(LPS+AEP)组CYP2E1蛋白表达显著降低(P<0.05);第5天,各组与对照组比较蛋白表达无显著影响;第8天,APAP组和(LPS+APAP)组与对照组比较,CYP2E1蛋白表达显著降低(P<0.05),AEP组和(AEP+LPS)组与对照组比较,CYP2E1蛋白表达无显著变化;在第14小时,(LPS+AEP)组与LPS组比较,CYP2E1蛋白表达升高(P<0.05),说明AEP经LPS诱导致肝损伤与CYP2E1蛋白表达无关。结果见图 6。
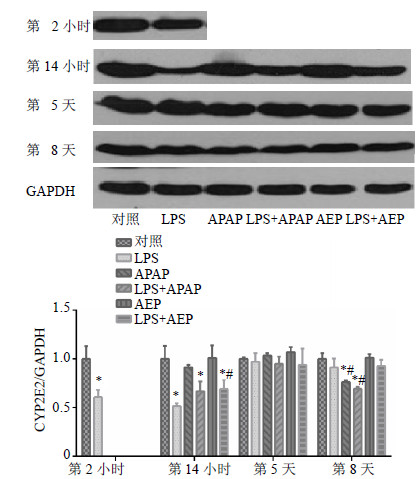 | 图 6 各组大鼠肝脏CYP2E1蛋白在第2、14小时和5、8天表达变化情况 (x±s, n = 3)Fig. 6 Evolution of CYP2E1 protein expression during experiment at 2 and 14 h, and days 5 and 8 (x±s, n = 3) |
第14小时,LPS组、(LPS+APAP)组和(LPS+AEP)组与对照组比较,CYP3A1蛋白表达显著降低(P<0.05);第5和8天,APAP组和(LPS+APAP)组与对照组比较,CYP3A1蛋白表达显著降低(P<0.05),而AEP组和(LPS+AEP)组与对照组比较无明显变化;且在各个时间点,(LPS+AEP)组与LPS组比较,CYP3A1蛋白表达无显著变化;第8天,(LPS+APAP)组与LPS组比较,CYP3A1蛋白表达显著降低(P<0.05)。结果见图 7。
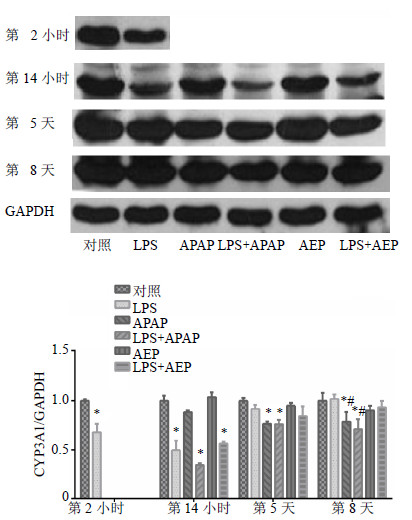 | 图 7 各组大鼠肝脏CYP3A1蛋白在第2、14小时、5、8天表达变化情况 (x±s, n = 3)Fig. 7 Evolution of CYP3A1 protein expression during experiment at 2 and 14 h, and days 5 and 8 (x±s, n = 3) |
本研究结果表明,经LPS诱导2 h后与对照组比较,大鼠体质量显著下降,肝脏组织轻微肿胀,生化指标ALT、AST和ALP显著升高,肝脏组织结构可见肝细胞灶性坏死,到第8天肝组织结构正常;AEP组体质量与对照组比较差异不大,肝脏组织未见肿胀现象,生化指标未见明显变化,肝组织
结构正常;而经LPS诱导的AEP组在第14小时大鼠体质量减轻,生化指标显著升高,肝细胞变性,小灶状坏死,在第8天同样发现大鼠体质量减轻,肝细胞变性,小灶状坏死。结果显示,单独给予LPS诱导组的SD大鼠和单独给予AEP的大鼠在第8天肝组织结构正常,而经LPS诱导的AEP组大鼠出现肝损伤,由此该新型何首乌致大鼠肝损伤模型已经成功建立[13],与目前常用何首乌致肝损伤动物模型比较,新模型与临床更为相近。
模型成功建立后,本课题研究了大鼠肝脏经LPS诱导后,AEP对大鼠CYP450主要亚型活性及蛋白表达的影响,结果显示,AEP使得肝药酶CYP1A2、CYP2E1、CYP3A1等亚型活性抑制,亚酶活性抑制使得机体代谢速度减慢,打破药物与其代谢产物之间的平衡,增高血药浓度或引起蓄积,导致药物不良反应或毒性反应的发生,引起肝损伤。所以临床上经CYP1A2、CYP2E1和CYP3A1代谢的药与何首乌合并用药时,应考虑到可能存在潜在的代谢性药物相互作用,应当适当减少用药剂量,必要时进行血药浓度监测。在蛋白水平上,通过抑制大鼠肝脏CYP1A2蛋白的表达,稳定CYP2E1和CYP3A1酶蛋白的表达,但是不排除其在基因水平起调控作用,CYP450亚酶的表达和活性可通过关键转录因子活化产生诱导效应,其中CYP3A1和CYP1A2的诱导可分别通过孕烷受体、组成性雄烷受体(CAR)、芳香烃受体(AhR)介导实现[14]。此实验结果与张[15]和王[16]实验中何首乌抑制CYP1A2酶活性和蛋白表达结果一致。有文献报道长期重复给予何首乌有效成分二苯乙烯苷、蒽醌类和鞣质等能致肝细胞产生可逆性损伤[17, 18, 19],其代谢产物与肝细胞内的蛋白质等大分子物质共价结合或造成细胞质膜变性引起肝损伤,因此,经LPS诱导大鼠肝脏细胞后,可以触发何首乌在短期低剂量下引发肝损伤,其毒性的发生及LPS诱发的免疫作用与大鼠肝脏CYP450亚型CYP1A2、CYP2E1、CYP3A1酶活性被抑制和CYP1A2蛋白表达被抑制有关,但其肝损伤作用机制是否因为转录因子的调控还有待进一步研究。
| [1] | Lei X, Chen J, Ren J, et al. Liver damage associated with Polygonum multiflorum Thunb.: a systematic review of case reports and case series[J]. Evid Based Complement Alternat Med, 2015, dio:10.1155/2015/459749. |
| [2] | Kyoung A J, Hyun J M, Seung S Y, et al. Drug-induced liver injury: twenty five cases of acute hepatitis following ingestion of Polygonum Multiflorum Thunb.[J]. Gut Liver, 2011, 5(4): 493-499. |
| [3] | Mazzanti G, Batinelli L, Daniele C, et al. New case of acute hepatitis following the consumption of Shou Wu Pian, a Chinese herbal product derived from Polygonum multiflorum[J]. Ann Intern Med, 2004, 140(7): W30. |
| [4] | 常 青, 赵海娟, 李 春, 等. 制首乌联合定量运动对大鼠肝脏微循环及肝功能的影响[J]. 中国药物警戒, 2014, 11: 193-197. |
| [5] | 王 涛, 王佳颖, 江振洲, 等. 何首乌水提物大鼠连续灌胃给药28 d 肝毒性研究———胆汁淤积相关性分析[J]. 中国中药杂志, 2012, 37(10): 1445-1450. |
| [6] | Yang Y, Wong S E, Lightstone F C. et al. Understanding a substrate'sproduct regioselectivity in a family of enzymes: a case study of acetaminophen binding in cytochrome P450s[J]. PLoS One, 2014 Feb 3; 9(2): e87058. doi: 10.1371/journal.pone.0087058. eCollection 2014. |
| [7] | Deng R, Yang T, Wang Y, et al. CYP2E1 RsaI/PstI polymorphism and risk of anti-tuberculosis drug-induced liver injury: a meta-analysis[J]. Int J Tuberc Lung Dis, 2012, 16(12): 1574-1581. |
| [8] | Lee W Y, Zhou X, Or P M, et al. Tanshinone I increases CYP1A2 protein expression and enzyme activity in primary rat hepatocytes[J]. Phytomedicine, 2012, 19(2):169-176. |
| [9] | Uno S, Endo K, Ishida Y, et al. CYP1A1 and CYP1A2 expression: Comparing ‘humanized' mouse lines and wild-type mice; comparing human and mouse hepatoma-derived cell lines[J]. Toxicol Appl Pharmacol, 2009, 237(1): 119-126. |
| [10] | Yao X, Wang B, Gu Y, et al. Effects of bicyclol on the activity and expression of CYP450 enzymes of rats after partial hepatectomy[J]. Acta Phar. Sinica, 2011, 46(6): 656-663. |
| [11] | Istrte M A, Nussler A K, Michel Eichelbaum M, et al. Regulation of CYP3A4 by pregnane X receptor: The role of nuclear receptors competing for response element binding[J]. Biochem and Biophys Res Commun, 2010, 393(4): 688-693. |
| [12] | Huang Y , Zheng S L, Zhu H Y, et al. Effects of aescin on cytochrome P450 enzymes in rats[J]. J Ethnopharmacol, 2014, 151(1): 583-590. |
| [13] | Fan X, Wang J B, Xie L H, et al. A new animal model for Polygonum multiflorum Thunb-induced liver injury in rats and its potential mechanisms[J]. Toxicol Res, 2015, 4(4): 1-34. |
| [14] | Tompkins L M, Wallace A D. Mechanisms of cytochrome P450 induction[J]. J Biochem Mol Toxicol, 2007, 21(4):176-181. |
| [15] | Wang Y Y, Yang J, Liu H, et al. Effects of tetrahydroxystilbene glucoside on mouse liver cytochrome P450 enzyme expressions[J]. Xenobiotica, 2015, 45(4): 279-285. |
| [16] | Zhang Y, Ding T, Diao T, et al. Effects of Polygonum multiflorrum on the activity of cytochrome P450 isoforms in rats.[J]. Pharmazie, 2015, 70(1): 47-54. |
| [17] | 胡锡琴, 禚 君, 李娅琳, 等. 何首乌中二苯乙烯苷对大鼠肝酶及蛋白的影响[J]. 辽宁中医杂志, 2011, 38(5): 998-990. |
| [18] | 胡锡琴, 李 敏, 杨红莲. 何首乌中鞣质与二苯乙烯苷不同配比对大鼠肝功能指标的影响[J]. 上海中医药杂志, 2011, 45(4): 56-59. |
| [19] | 孙向红, 孙玉维, 李 红, 等. 何首乌主要成分大黄素、大黄算和二苯乙烯苷对肝细胞、肝癌细胞的影响[J]. 现代中西医结合杂志, 2010, 19(11): 1315-1319. |
 2016, Vol. 39
2016, Vol. 39


