2. 天津市医药集团技术发展有限公司, 天津 300193
2. Tianjin Pharmaceutical Tech-Development Co., Ltd., Tianjin 300193, China
通用名:卡利拉嗪(cariprazine)
商品名:Vraylar®
化学名:trans-N-{4-[2-[4-(2,3-dichloro-phenyl) piperazine-1-yl]ethyl]cyclohexyl}-N′,N′-dimethylurea
CAS:839712-12-8(Cariprazine)、1083076-69-0(cariprazine HCl)
分子式:C21H32Cl2N4O
结构式:见图 1
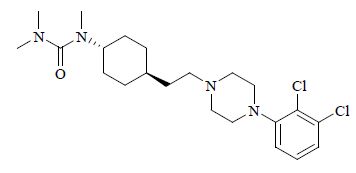
|
图 1 卡利拉嗪的结构 Fig. 1 Structure of cariprazine |
相对分子质量:427.42
原研公司:阿特维斯(Actavis)公司,匈牙利吉瑞大药厂(Gedeon Richter Plc)
适应症:精神分裂症,双相躁郁症
给药途径:口服
2 相关背景研究发现抗精神病药物都有拮抗多巴胺D2受体(D2R)的作用,且典型抗精神病药物的作用效价与引起锥体外系反应(EPS)的效价同阻滞D2R的作用呈正相关[1]。典型抗精神病药物如氟哌啶醇与D2R的亲和力很高,这可能是它们对阳性症状疗效较好和易发生EPS的原因之一,而选择性D2R拮抗剂舒必利对精神分裂症有效,由此推断D2R可能与典型和非典型抗精神病药物的药理作用机制均相关。还有研究表明与健康组相比,精神分裂症患者D2R的基线水平增高[1]。Dubertret等[2]在对D2R遗传多态性的研究中发现与正常对照组相比,精神分裂症患者的A2等位基因明显过量。
一般而言,在临床用药剂量下,典型抗精神分裂药物对D2R的阻断为65%,当阻断比例过高时(80%)往往导致EPS发生及负性症状的恶化,限制了其临床应用。非典型抗精神分裂药物除作用于D2R外,对D3受体(D3R)、D4受体及5-HT2A、α1肾上腺素受体等也有亲和力,尤其对D3R亲和力较高,如强效D2R、D3R混合型拮抗剂磺胺必利[3, 4]。部分研究者认为,非典型抗精神分裂药物发挥抗精神分裂药效的同时避免出现EPS的药理基础主要在于其对中脑边缘D3R的选择性阻断。除此之外,D3R基因第一外显子ser9gly的多态性与精神分裂发病率具有相关性,也表明D3R与精神分裂密切相关[5]。
对D3R克隆后的研究发现,能阻断D2R的抗精神病药物也能阻滞D3R。D3R既是自身受体,又是突触后受体。用非放射性原位杂交组织化学法鉴定发现,精神分裂症患者纹状体D3R数目增加,而抗精神病药物可使其数目减少[6]。精神患者接受不同疗程的药疗,死后尸检也表明D3R密度没有明显改变,而未服药治疗患者的腹侧纹状体内D3R明显增加。因此,D3R成为抗精神病药的重要靶点。药物调节D3R密度可能是抗精神病治疗的作用机制之一,它与抗精神病药结合有助于阴性症状的缓解。
卡利拉嗪由阿特维斯(Actavis)公司与匈牙利吉瑞大药厂(Gedeon Richter)联合开发,是首个报道应用于抗精神分裂研究的D3R/D2R部分激动剂,兼具优先结合D3R和DA部分激动剂的特点,其D3R/D2R选择性约为10倍。美国食品药品监督管理局(FDA)已经于2015年9月批准卡利拉嗪上市,用于治疗狂躁或混合发作的第一型双极性情感障碍,以及成年精神分裂症患者。该药拥有一项2027年到期的化学物质及组分专利保护。
3 合成路线[6]4-硝基环己基乙酸在水溶液中采用10%Pd/C催化氢化,室温反应3 d至原料反应完全,处理后得白色固体,然后将其加入1 mol/L盐酸乙醚溶液,浓缩析晶得到反式异构体的盐酸盐2的结晶,过滤干燥得白色固体,将化合物2用二氯甲烷溶解,加入三乙胺碱化,然后室温条件下与二碳酸二叔丁酯反应24 h得到化合物3。以甲苯为溶剂,氮气保护条件下,将二异丁基氢化铝慢慢滴加到用干冰冷却至−78℃的化合物3的溶液中,滴加完毕继续保温反应至不再冒泡,甲醇淬灭,后处理得到化合物4。以1,2-二氯乙烷为溶剂,将化合物4与5在三乙酰氧基硼烷存在下反应24 h,制备得到化合物6。以二氯甲烷为溶剂,室温条件下化合物6与三氟乙酸反应16 h后,再用羟基铵溶液调至pH 10,然后以三乙胺为碱在氮气保护条件下与二甲基胺甲酰氯反应得到化合物1(cariprazine),见图 2。
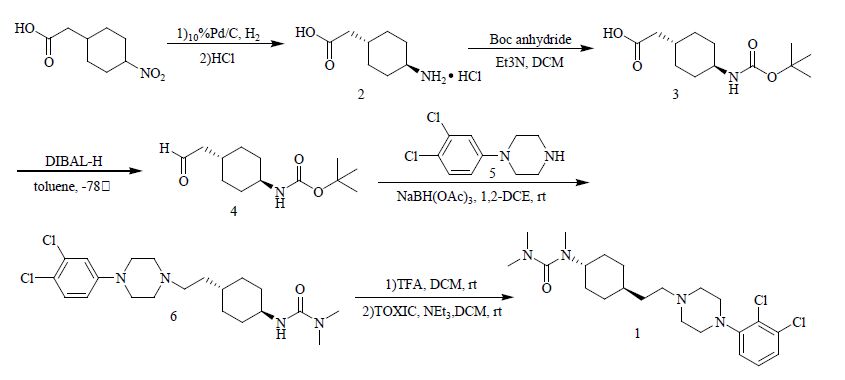
|
图 2 卡利拉嗪的合成路线 Fig. 2 Synthesis route of cariprazine |
与许多D2和5-HT2A受体拮抗剂的抗精神病药物不同,卡利拉嗪属于D2R和D3R部分激动剂,而且它对D3R表现出了高亲和力。卡利拉嗪对D3R的高选择性可能减少与其他抗精神病药物相关的副作用。因为D3R主要位于腹侧纹状体且不会产生EPS,而作用于位于背侧纹状体的多巴胺受体的药物则易产生[7]。在大鼠和猴的脑部研究中观察到,卡利拉嗪也作用于5-HT1A受体,但其亲和力低于多巴胺受体 [7, 8]。
此外,卡利拉嗪在东莨菪碱所致学习记忆障碍的大鼠水迷宫试验中表现较好,说明卡利拉嗪能够产生认知效应,但其作用机制目前正在研究;尽管还需要更为深入的研究,但仍可认为是D3R的选择性拮抗剂性质所致[7]。这一结果对于改善精神分裂
症患者的认知功能障碍症状是非常有意义的。
卡利拉嗪同时具有部分激动剂和拮抗剂的性能取决于内源性多巴胺的水平。当内源性多巴胺水平较高时,卡利拉嗪作为拮抗剂通过阻断多巴胺受体而起效。当内源性多巴胺水平偏低时,卡利拉嗪主要作为激动剂,使多巴胺受体活性增加[9]。在用猴子所做的试验中,卡利拉嗪剂量增加导致了剂量相关以及特异性结合的饱和性降低现象,在最高剂量(300 μg/kg)下,D2/D3R的占据率达到94%,而在最低剂量(1 μg/kg)下,上述受体的占据率仅有5%[8]。
4.2 药动学卡利拉嗪具有较高的口服生物利用度,为脂溶性药物,因此在人体中较易穿过血脑屏障[10]。其大鼠的口服生物利用度为52%(剂量为1 mg/kg)[11]。
卡利拉嗪的活性是其自身以及它的两个主要的活性代谢产物——去甲基卡利拉嗪(DCAR)和二去甲基卡利拉嗪(DDCAR)所产生,两种代谢产物与卡利拉嗪药理等效。在一项为期12周的Vraylar多剂量给药实验中,卡利拉嗪和DCAR的平均浓度在第1周到第2周达到平稳状态,DDCAR的平均浓度在第4周到第8周才接近稳定状态。若以达到稳定状态的时间为依据,根据平均浓度时间曲线估算半衰期,卡利拉嗪为2~4 d,DDCAR的为1~3周。主要活性代谢物DDCAR达到稳定状态的时间是根据患者的情况改变的,一些患者在12周的治疗结束时仍不能达到稳定状态,在12周治疗结束时,DCAR和DDCAR的平均浓度分别约为卡利拉嗪的30%和400%。
Vraylar停药后,卡利拉嗪、DCAR和DDCAR血浆浓度均已多指数的方式下降。从最后1个剂量开始,DDCAR的平均血浆浓度在1周内下降到大约50%,卡利拉嗪和DCAR的平均浓度下降到该数值仅用了约1 d时间,进而于1周后下降到约10%;而DDACR的血浆浓度则用了约4周时间下降到10%。在卡利拉嗪1 mg单一剂量的实验中,停药8周后仍可检测到微量的DDCAR。
多剂量给药Vraylar后,卡利拉嗪、DCAR和DDCAR的血浆暴露按比例增加,这一数值超出了治疗剂量范围。
5 临床评价 5.1 Ⅰ期临床在随机、双盲、安慰剂对照和平行分配的卡利拉嗪Ⅰ期临床试验中,129名18~50岁的精神分裂症患者以1.5~18 mg序贯多剂量1次/d给药,旨在评估该项治疗对心肌复极的安全性和耐受性。结果高剂量组中约15%的患者由于不良反应而在早期终止了研究,低剂量组为9%,安慰剂组为5%。服用卡利拉嗪的不良反应主要有静坐不能及便秘。
目前,Gedeon Richter公司正在针对卡利拉嗪缓释片和速释胶囊(均为每日一到两个规格给药)对血压水平的影响以及其他不良反应的对比进行相应的Ⅰ期临床试验研究。
5.2 Ⅱ期临床以下是一项针对急性发作期精神分裂症患者的、安慰剂和阳性对照的固定剂量Ⅱ期临床试验研究情况[12]:试验对象为732例18~60岁的精神分裂症患者,他们在长达7 d的清除期内未经任何相关治疗。患者被随机分为:卡利拉嗪分别1.5、3.0、4.5 mg/d组,利培酮或安慰剂4.0 mg/d组,周期为6周,在此基础上再增加2周的安全性随访期,在安全性随访期间不接受任何药物治疗。在清除期以及双盲治疗的前4周,患者留院观察。此后,由现场调查员根据患者的状态决定其为住院治疗还是门诊治疗,这期间所有患者均会被随访。
协议规定的主要终点是卡利拉嗪的固定剂量组与安慰剂组相比,阳性与阴性症状量表(PANSS)总评分从基线到6周的变化。治疗采用序贯多重比较试验程序和末次观测值结转法(LOCF)分析。次要终点是临床总体印象评价量表评分(CGI-S)从基线到6周的变化。第6周末采用LOCF分析可以观察到卡利拉嗪所有剂量组与安慰剂组相比,在PANSS总体评分上差异均有统计学意义(P<0.001)的改善(1.5、3、4.5 mg/d的卡利拉嗪改变值分别为7.5、8.9和10.4)。采用相同的分析方法,卡利拉嗪所有剂量组与安慰剂组相比,在CGI-S中同样得到了显著的统计学意义上的改善。与此同时,作为阳性对照的利培酮组相对于安慰剂组在上述评分中同样得到了统计学意义上的改善。
最终有64%的患者完成了该项研究,结果显示 利拉嗪整体耐受性良好;在因不良反应而终止试验的患者中,安慰剂组的比例要高于试验治疗组和阳性对照治疗组(安慰剂组为15%,卡利拉嗪1.5、3.0、4.5 mg/d组分别为10%、5%和8%,利培酮组为9%)。在每个卡利拉嗪剂量组均观察到的最常见的不良反应有失眠,EPS、静坐不能、镇静、恶心、头晕和便秘。
在另一项随机、双盲、安慰剂对照,灵活剂量组的Ⅱ期临床试验[13]中,对双相抑郁症患者每日单次剂量给药卡利拉嗪,评价其疗效、安全性和耐受性。他们在至少1周的清除期内未经抗精神分裂治疗。来自美国临床站点,年龄为18~65岁的试验对象共233例,被随机分配到3个治疗组(0.25~0.75 mg/d卡利拉嗪或1.5~3.0 mg/d或安慰剂组。主要终点为从基线到8周在蒙哥马利抑郁评定量表(MADRS)总分上治疗组较安慰剂组的变化。虽然药物治疗组和安慰剂组之间的总体差异没有统计学意义,但在试验过程中与安慰剂相比,研究中的高剂量组有临床相关的治疗效果。此外,对卡利拉嗪的耐受性试验数据支持在这一患者人群中作进一步深入研究。在高剂量治疗组中,大约有9%的患者因为不良反应中止了试验,而安慰剂组的这一比例为3%。
5.3 Ⅲ期临床两项随机、双盲(6周)、安慰剂对照的Ⅲ期临床试验分别用于评价固定剂量(3.0、6.0 mg/d,代号NCT01104766)和灵活剂量(3.0~6.0、6.0~9.0 mg/d,代号NCT01104779)卡利拉嗪治疗成人精神分裂症急性发作的疗效、安全性和耐受性[14]。上述试验的主要终点和次要终点分别为PANSS和CGI-S总评分从基线到第6周的变化,这些数据使用重复测量的混合效应模型进行分析。
患者被随机分组:NCT01104766试验共617人,包括安慰剂组153人,卡利拉嗪3.0 mg/d组155人,卡利拉嗪6.0 mg/d组157人,阿立哌唑组152人。NCT01104779试验共446人,包括安慰剂组147人,卡利拉嗪3.0~6.0 mg/d组151人,卡利拉嗪6.0~9.0 mg/d组148人。与安慰剂相比,卡利拉嗪从基线至第6周的PANSS总分有了非常明显的改善:最小二乘均数差(LSMD)为−6.0(3.0 mg/d,P=0.004 4),−6.8(3.0~6.0 mg/d,P=0.002 9),−8.8(6.0 mg/d,P<0.000 1)和−9.9(6.0~9.0 mg/d,P<0.000 1)。在CGI-S中,卡利拉嗪的表现也明显优于安慰剂:LSMD为−0.4(3.0 mg/d,P=0.004 4),−0.3(3.0~6.0 mg/d,P=0.0115),−0.5(6.0 mg/d,P<0.000 1)和−0.5(6.0~9.0 mg/d,P=0.000 2)。NCT01104766试验中的阳性对照阿立哌唑在上述两个指标上也均优于安慰剂(LSMD∶PANSS=−7.0,P=0.000 8;CGI-S=−0.4,P=0.000 1)。在两项试验中均出现的与卡利拉嗪相关的不良反应是静坐不能(发生率≥5%,为安慰剂组的2倍)。两项试验中卡利拉嗪组的代谢参数变化均较小,与安慰剂组类似。试验整体结果显示卡利拉嗪对精神分裂症的效果和耐受性均较好。
两项随机、双盲、安慰剂对照的Ⅲ期临床试验分别用于评价灵活剂量(3.0~12 mg/d,代号NCT01058096;3.0~6.0 mg/d或6.0~12.0 mg/d,代号NCT01058668)的卡利拉嗪治疗成人双相情感障碍混合发作与躁狂发作的疗效、安全性与耐受性[15]。上述试验的主要和次要的疗效参数分别为杨氏躁狂量表(YMRS)和CGI-S总评分从基线到第3周的变化,这些数据使用重复测量的混合效应模型进行分析。NCT01058096试验共312人,包括安慰剂组154人,卡利拉嗪3.0~12.0 mg/d组158人;NCT01058668试验共497人,包括安慰剂组161人,卡利拉嗪3.0~6.0 mg/d组167人,卡利拉嗪6.0~12.0 mg/d组169人。与安慰剂相比,卡利拉嗪从基线至第6周的YMRS总分有了非常明显的改善(P<0.001):LSMD为−4.3(3.0~12.0 mg/d,P=0.004 4),−6.1(3.0~6.0 mg/d),−5.9(6.0~12.0 mg/d)。每个卡利拉嗪组均比安慰剂组有更多患者达到YMRS响应值及缓解标准。在CGI-S中,卡利拉嗪的表现也明显优于安慰剂:LSMD为−0.4(3.0~12.0 mg/d,P=0.027),−0.6(3.0~6.0 mg/d,P<0.001),−0.6(6.0~12.0 mg/d,P<0.001)。在两项试验中均出现的与卡利拉嗪相关的不良反应是静坐不能和震颤(综合发生率≥5%,为安慰剂组的2倍)。两项试验中卡利拉嗪组的代谢参数变化均较小,与安慰剂组类似。试验整体结果显示卡利拉嗪对双相躁狂的效果和耐受性均较好。
一项多中心、双盲、安慰剂对照的平行组Ⅲ期临床试验用于评价卡利拉嗪单一疗法治疗急性躁狂和I型双相情感障碍的疗效、安全性和耐受性。在为期5周的研究中,312名年龄为18~65岁、符合精神疾病诊断与统计手册[第四版,文本修订版(DSM-IV-TR)]中I型双相情感障碍标准的男性和女性患者,随机接受卡利拉嗪3.0~12.0 mg/d(158名)或安慰剂(154名)治疗。4~7 d的清除期后,患者每日接受1~4粒胶囊剂(卡利拉嗪或安慰剂)给药。治疗期持续3周,之后进入为期1周的安全评估期。患者在整个清除期期间以及治疗期开始后最初的至少14 d内均留院观察。
协议指定的主要终点是从基线至第3周在YMRS总分上的变化,该变化使用重复测量的混合效应模型进行分析。YMRS是一个全面的评估,在双相情感障碍患者躁狂严重程度用临床医生额定仪表,包括情绪高涨等参数,运动活动增加能量,睡眠,烦躁。
卡利拉嗪(3.0~12.0 mg/d)组的YMRS整体评分从基线到第3周的平均变化相对于安慰剂组更为明显(P=0.000 4),以上两个组之间的YMRS整体评分平均变化的明显差异在第4天(第一基线后的评价)被观察到,且始终维持于双盲治疗期间(综合评估P<0.01)。在YMRS响应方面卡利拉嗪相对于安慰剂也表现出显著的优势(改善率不低于50%的比例:卡利拉嗪组58.9%,安慰剂组44.1%,P=0.009 7),缓解率方面也是如此(YMRS总分不高于12的比例:卡利拉嗪组51.9%,安慰剂组34.9%,P=0.002 5)。此外,在CGI-S评分(P=0.002 7)及PANSS总分(P=0.003 5)上的平均变化方面也是卡利拉嗪组占据优势。治疗期间最常见的与卡利拉嗪相关的不良反应(不小于10%且出现比例为安慰剂的2倍)是静坐不能、EPS、震颤、消化不良和呕吐。卡利拉嗪组与安慰剂组的代谢参数变化均较小且类似。试验整体结果显示卡利拉嗪3.0~12.0 mg/d对急性躁狂和I型双相情感障碍有效且耐受性普遍较好。
6 安全性和耐受性[16]基于4项为期6周的用于评价每日1次给药卡利拉嗪(1.5~12.0 mg/d)治疗精神分裂的安慰剂对照试验,对卡利拉嗪产生的不良反应进行了评价。唯一导致治疗中止的不良反应是静坐不能,在卡利拉嗪组,这一反应的发生率超过2%,是安慰剂组的至少2倍。综合数据表明,大约12%的卡利拉嗪组因不良反应中止治疗,而安慰剂组这一数据是7%。其中,卡利拉嗪组最常见的不良反应(发生率超过5%且至少为安慰剂组的2倍)是EPS、静坐不能、消化不良、呕吐、嗜睡和不安。
在精神分裂症和躁郁症的试验中,以辛普森安古斯量表(SAS)评价治疗中出现的帕金森症状(SAS基线总分不大于3,基线后总分大于3),以巴恩斯静坐不能评定量表(BARS)评价治疗中出现的静坐不能(BARS基线总分不大于2,基线后总分大于2)。
在为期6周的精神分裂症治疗试验中,已报道的与EPS相关事件包括静坐不能和不安的发生率,在卡利拉嗪组为17%,安慰剂组为8%。在卡利拉嗪组与安慰剂组,因上述事件导致的治疗中止发生率分别为0.3%和0.2%。卡利拉嗪组的静坐不能发生率为11%,安慰剂组为4%,由此导致的治疗中止发生率分别为0.5%和0.2%。
此外,肌张力障碍以及肌肉群长期异常收缩的症状,在治疗的最初几天会发生在敏感个体身上。在上述试验中,急性肌张力障碍在成年组和青年组患者中均被观察到。
7 结语近年来,在抗精神分裂症新药研发中,部分研究以D2R靶点确切的抗精神分裂作用为基础,突出D3R靶点在改善患者认知功能、有效避免EPS副反应等方面的潜在优势,开展了D2R、D3R联合靶点药物的研究。多巴胺D3受体迅速成为抗精神分裂症新药研究的潜在靶点,国内外学术界普遍认为药物选择性作用于D3R,不仅有利于患者认知功能改善,且其疗效尤其是避免不良反应方面将较之D2R靶点药物更具优势。卡利拉嗪对D3与D2受体的部分拮抗与激动的性能,以及所表现出来的对D3R更高的亲和力,使其在已知抗精神分裂药物中具有独一无二的药理特性,并成为候选品种。
卡利拉嗪用于治疗精神分裂症最常见的副作用是震颤、发晕以及肌张力障碍,而用于双极性情感障碍治疗最常见的副作用包括EPS、多动症、消化不良、呕吐、嗜睡以及不安。不过临床试验表明,以上不良反应的出现概率与安慰剂相比差异较小。
此外,卡利拉嗪在临床试验中还作为重度抑郁症的一种辅助治疗药物进行测试,以及测试用于双相抑郁症。目前在精神分裂症等精神疾病领域仍缺乏足够优秀的疗法,这一药物的上市能够缓解患者对此类药物的迫切需求,具有较好的市场前景。
| [1] | 赵爱玲, 赵靖平. 多巴胺和5-羟色胺受体基因多态性与抗精神病药反应[J]. 国外医学:精神病学分册, 2002, 29(2):101-104. |
| [2] | Dubertret C, Gouya L, Hanoun N, et al. The 3' region of the DRD2 gene is involved in genetic susceptibility to schizophrenia[J]. Schizophr Res, 2004, 67(1):75-85. |
| [3] | Bressan R A, Erlandsson K, Jones H M, et al. Isregionally selective D2/D3 dopamine occupancy sufficient for atypical antipsychotic effect? An in vivo quantitative[123I] epidepride SPET study of amisulpride-treated patients[J]. Am J Psychiatry, 2003, 160(8):1413-1420. |
| [4] | Strange P G. Anti-psychotic drugs. Importance of dopamine receptors for mechanisms of therapeutic actions and side effects[J]. Pharmacol Rev, 2001, 53(1):119-133. |
| [5] | Jonsson E G. Dopamine D3 receptor gene Ser9Gly variant and schizophrenia:association study and meta-analysis[J]. Psychiatr Genet, 2003, 13(1):1-12. |
| [6] | Jeremy S, Carmen K H, Laura L, et al. A structure-activity analysis of biased agonism at the dopamine D2 receptor[J]. J Med Chem, 2013, 56(22):9199-9221. |
| [7] | Gyertyán I, Kiss B, Sághy K, et al. Cariprazine (RGH-188), a potent D3/D2 dopamine receptor partial agonist, binds to dopamine D3 receptors in vivo and shows antipsychotic-like and procognitive effects in rodents[J]. Neurochem Int, 2011, 59(6):925-935. |
| [8] | Seneca N, Finnema S J, Laszlovszky I, et al. Occupancy of dopamine D2 and D3 and serotonin 5-HT1A receptors by the novel antipsychotic drug candidate, cariprazine (RGH-188), in monkey brain measured using positron emission tomography[J]. Psychopharmacology (Berlin), 2011, 218(3):579-587. |
| [9] | Citrome L. Cariprazine in schizophrenia:clinical efficacy, tolerability, and place in therapy[J]. Adv Ther, 2013, 30(2):114-126. |
| [10] | Gründer G. Cariprazine, an orally active D2/D3 receptor antagonist, for the potential treatment of schizophrenia, bipolar mania and depression[J]. Curr Opin Invest Drugs, 2010, 11(7):823-832. |
| [11] | Newman-Tancredi, A, Kleven M S. Comparative pharmacology of antipsychotics possessing combined dopamine D2 and serotonin 5-HT1A receptor properties[J]. Psychopharmacology (Berlin), 2011, 216(4):451-473. |
| [12] | Forest Laboratories, Inc. Forest Laboratories, Inc. and Gedeon Richter Plc. Announce results from two positive phase III trials with the investigational antipsychotic cariprazine for the treatment of schizophrenia[EB/OL]. (2012-02-28)[2015-10-12]. http://www.businesswire.com/news/home/20120227007192/en. |
| [13] | Gedeon Richter Plc., Forest Laboratories. Forest Laboratories, Inc. and Gedeon Richter Plc announce results from a phase II study of cariprazine for the treatment of bipolar depression[EB/OL]. (2010-08-31)[2015-10-12].http://www.medicalnewstoday.com/releases/199452.php. |
| [14] | Laszlovszky I, Lu K, Debelle1 M, et al. EPA-0870-efficacy and safety of cariprazine in patients with acute exacerbation of schizophrenia:results of two phase III trials[J]. Europ Psychiatry, 2014, 29(1):1. |
| [15] | Sachs G S, Lu K, Debelle M, et al. EPA-0869-efficacy and safety of cariprazine in patients with acute manic or mixed episodes associated with bipolar I disorder[J]. Europ Psychiatry, 2014, 29(1):1. |
| [16] | Actavis Pharma, Inc. VraylarTM (cariprazine) Capsulesdraft labeling text-redline[EB/OL]. (2015-09-17)[2015-10-12]. http://www.accessdata.fda.gov/drugsatfda_docs/label/2015/204370lbl.pdf." |
 2016, Vol. 39
2016, Vol. 39



