2. 江西中医药大学 现代中药制剂教育部重点实验室, 江西 南昌 330004;
3. 江西中医药大学 中药固体制剂制造技术国家工程研究中心, 江西 南昌 330006
2. Jiangxi University of Traditional Chinese Medicine, Key Laboratory of Modern Preparation of TCM, Ministry of Education, Nanchang 330004, China;
3. Jiangxi University of Chinese Traditional Medicine, The National Pharmaceutical Engineering Center (NPEC) for Solid Preparation in Chinese Herbal Medicine, Nanchang 330006, China
白头翁Pulsatilla chinensis (Bunge)Regel系毛茛科白头翁属植物,是常用的传统中药,始载于《神农本草经》,列为下品,性寒、味苦,具有清热解毒、凉血止痢。用于血热痢疾,阴痒带下[1]。现代药理研究表明,白头翁具有抗肿瘤、抗阴道滴虫、抗氧化、抗炎、杀虫、抑菌等药理作用[2, 3, 4, 5, 6, 7, 8]。
皂苷类成分是白头翁的主要成分,课题组的前期研究[8]发现白头翁皂苷总皂苷具有抗肿瘤活性,并在此基础上对其进行分离、鉴定和构效关系的研究,结果表明齐墩果烷母核的常春藤皂苷元 3-O-β-D-吡喃葡萄糖基-(1→4)-[α-L-吡喃鼠李糖基- (1→2)]-α-L-吡喃阿拉伯糖(本课题组命名为白头翁皂苷B3,图 1)为白头翁总皂苷提取物的主要活性成分,溶血性较强,临床应用中以口服给药为主,给药后的吸收程度是其能否发挥疗效的基础。
 | 图 1 白头翁皂苷B3的化学结构Fig. 1 Structure of pulsatilla saponin B3 |
影响药物吸收的因素较多,其中药物的溶解度和油水分配系数直接影响药物在体内的吸收,是预测药物口服吸收的重要物理参数。本研究以白头翁皂苷B3为指标成分通过对其溶解度、油水分配系数及其在体肠吸收的研究,探究药物的物理参数对吸收的影响,阐明其吸收规律和特征,从而为白头翁口服制剂设计以及临床安全合理用药提供有益指导。
1 仪器、试药、动物Agilent1100高效液相色谱仪(美国安捷伦公司);AB204-N型精密分析天平(Mettler Toledo上海衡器有限公司);超声波清洗仪(昆山市超声仪器有限公司);SHA-C型水浴振荡器(巩义市予华仪器有限责任公司);HH-4数显恒温水浴锅(国华电器有限公司);PHS 2C精密pH计(上海虹益仪器仪表有限公司);HL-2型恒流泵(上海青浦沪西仪器厂)。
白头翁皂苷B3(中药固体制剂技术国家工程研究中心植化室提供,批号20111108);乌拉坦(广州威佳科技有限公司,质量分数98%,批号1700063- 50G);地高辛、维拉帕米(美国Sigma公司);Kreb- Ringer’s 营养液(K-R液,每1 000 mL含NaCl 7.80 g、KCl 0.35 g、NaH2PO4 0.32 g、NaHCO3 1.37 g、MgCl2 0.02 g、葡萄糖1.40 g、CaCl2 0.37 g);甲醇(山东禹王实业有限公司,批号20121005091);纯化水(实验室自制)。
雄性SD大鼠,体质量(230±20 g),由湖南斯莱克景达实验动物有限公司提供,使用许可证号SCXK(湘)2011-0003。
2 方法和结果 2.1 白头翁皂苷B3表观溶解度的测定取过量白头翁皂苷B3置于具塞锥形瓶中,用不同溶剂溶解(pH 5.6、pH 8.0、pH 8.5、pH 9.0的缓冲溶液,75%乙醇、100%乙醇、四氢呋喃、丙二醇),分别放入(37±1)℃恒温振荡器中,于144 h后取样。经微孔滤膜过滤进样检测,记录峰面积,求得白头翁皂苷B3在不同溶媒中的表观溶解度,结果见表 1。由表 1可知白头翁皂苷B3在有机溶剂中溶解度较小,在弱碱性缓冲溶液中溶解度较大。
| 表 1 白头翁皂苷B3在不同溶剂中的表观溶解度($\bar x \pm s$,n = 5) Table 1 Apparent solubility of Pulsatilla saponin B3 in different solvents($\bar x \pm s$,n = 5) |
在37 ℃条件下,将溶有一定量白头翁B3的pH 5.5、pH 6.6和pH 7.6的缓冲液分别和正辛醇的水饱和溶液以1∶1的比例装入分液漏斗中,振摇后放置72 h。分离出水相,将水相3 000 r/min离心10 min,取稀释后上清液,测定白头翁皂苷B3的浓度,计算白头翁皂苷B3的表观油水分配系数(Papp)。
Papp=(C0V0-CwVw)/CwVw
式中,C0为水相中初始药物的浓度,V0为初始水相的体积;Cw为分配平衡后水相中的药物浓度,Vw为分配平衡后水相的体积。
由表 2可知,白头翁皂苷B3在不同磷酸盐缓冲液中的油水分配系数相差不大。
| 表 2 白头翁皂苷B3在不同缓冲溶液中的油水分配系数 Table 2 Oil-water distribution coefficient of Pulsatilla saponin B3 in different buffer solvents |
以甲醇为溶剂,精密配制含白头翁皂苷B3为3.180 mg/mL的标准贮备液,置4 ℃保存。
分别精密量取白头翁皂苷储备液适量置10 mL量瓶中,用甲醇稀释至刻度,配置成白头翁皂苷B3系列标准溶液。
2.3.2 肠吸收液的制备取肠吸收液200 μL,甲醇200 μL,SPE柱分离,3 mL超纯水淋洗,5 mL甲醇洗脱,收集甲醇洗脱液,N2吹干,0.1 mL甲醇复溶,漩涡振荡2 min,0.45 μmol/L微孔滤膜滤过。SPE柱使用之前经2 mL甲醇和2 mL去离子水活化处理。同时做空白实验。
2.3.3 白头翁皂苷B3方法学考察(1)色谱条件和方法专属性 Welchrom-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇(A)- 水(B),线性梯度洗脱:0~15 min,B 25%→10%,体积流量1.0 mL/min;进样量20 μL;柱温30 ℃。
在建立的HPLC-ELSD条件下,白头翁皂苷B3色谱图具有较高选择性,色谱峰良好,内源性物质无干扰。典型色谱图见图 2。
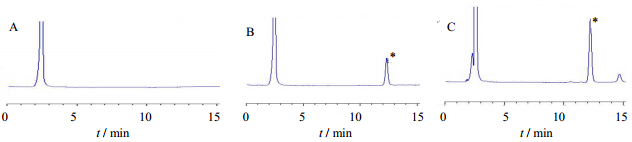 | *-白头翁皂苷B3 *- Pulsatilla saponin B3图 2 空白样品(A)、白头翁皂苷B3对照品(B)和肠吸收溶液(C)的HPLC-ELSD图谱Fig. 2 HPLC-ELSD photogram of Blank sample (A),pulsatilla saponin B3 reference (B),and intestinal absorption solution (C) |
(2)标准曲线的建立 取空白肠吸收液200 μL,200 μL系列工作溶液,其余按照“样品处理”项下方法处理。取所得滤液20 μL,按照色谱条件,注入HPLC-ELSD进行分析。
记录白头翁皂苷B3峰面积,以质量浓度为横坐标,以白头翁皂苷峰面积为纵坐标,作线性回归。回归方程:Y=2.44X-11.24(r2=0.990 1),线性范围0.980~3.180 mg/mL。标准曲线范围满足肠吸收液样品的浓度要求,分析样品在拟定浓度范围内线性较好。
(3)精密度试验 取空白肠吸收液200 μL,加入高、中、低3个不同浓度的对照品溶液200 μL,其余按照“样品处理”项下方法处理。取所得滤液20 μL,按照色谱条件,注入HPLC-ELSD进行分析。每个浓度制备6份,每个浓度连续进样6次,测定日内精密度。重复操作,连续测定3 d并随行标准曲线,计算日间精密度。日内和日间精密度分别为2.38%~6.23%和1.93%~7.19%。表明该方法的精密度良好。
(4)提取回收率试验 取6个不同来源的大鼠空白肠吸收液200 μL,200 μL高、中、低3个不同浓度的对照品溶液,其余按照“样品处理”项下方法处理,取20 μL进HPLC-ELSD分析,记录各待测化合物经提取后得到峰面积(A1)。另取6个不同来源的大鼠空白肠吸收液200 μL,SPE分离,3 mL超纯水淋洗,3 mL甲醇洗脱,收集甲醇洗脱液,加入200 μL高、中、低3个不同浓度的对照品溶液,N2吹干,0.1 mL甲醇复溶,漩涡振荡2 min,0.45 μm微孔滤膜滤过,取20 μL进HPLC-ELSD分析,记录未经提取直接进样获得的色谱峰面积(A2)。计算提取回收率(A1/A2×100%)。白头翁皂苷B3的平均提取回收率为76.38%~92.17%,RSD≤7.2%。表明该方法的回收率良好。
(5)样品稳定性试验 样品稳定性评价为待测物样品室温24 h放置的稳定性。肠灌流液中的分析物质室温静置24 h(RE在−12.0%~13.2%,RSD≤9.8%)的条件下稳定。
2.3.4 白头翁皂苷B3在体肠吸收的研究(1)白头翁皂苷B3在不同肠段吸收研究 取白头翁皂苷B3适量,加入K-R液超声溶解,摇匀,得含白头翁皂苷B3 0.5 mg/mL的供试液。选取实验前禁食18 h(自由饮水)的大鼠,ip 20%乌拉坦溶液麻醉并固定,用红外灯保持37 ℃体温,沿腹中线打开腹腔3 cm结扎胆总管,按以下方法取肠道各段,在两端剪切后插管,并用线扎紧。十二指肠段自幽门1 cm处开始,空肠段自幽门15 cm处开始,回肠段自盲肠上行20 cm处开始,结肠自盲肠后端开始,各段均取10 cm。以5 mL/min体积流量用37 ℃ K氏液冲洗肠管内容物至净,将伤口用浸有生理盐水的脱脂棉覆盖保湿。将大鼠肠道连接到灌流装置[9, 10]。
采用重量法按下式计算药物吸收速率常数(Ka)和药物表观吸收系数(Papp)。
Ka=(1-CoutQout/CinQin)Q/V
Papp=−Qin(CoutQout/CinQin)/2rπL
${{t}_{\text{1}/\text{2}}}=\frac{0.693}{{{K}_{a}}}$
式中Qin和Qout分别为肠道进出口灌流液的体积(mL);Cin和Cout分别为肠道进出口灌流液的浓度(mg∙mL−1);L和r分别为被灌流肠段的长度(cm)和横截面半径(cm),Q为灌流速度(0.25 mg∙min−1),V为灌流肠段的体积。
统计结果见表 3。采用多重均数比较的t检验,结果表明白头翁皂苷B3在不同肠段的Ka和Papp值没有统计学差异,因此选用十二指肠作为白头翁皂苷提取物吸收的研究肠段。
| 表 3 白头翁皂苷B3在不同肠段的吸收参数($\bar x \pm s$,n = 5) Table 3 Absorption parameters in different intestinal segments of Pulsatilla saponin B3($\bar x \pm s$,n = 5) |
(2)不同剂量白头翁皂苷B3小肠吸收研究 选取健康SD大鼠20只,随机分成4组,按照“白头翁皂苷B3在不同肠段吸收研究”项下实验方法,选取十二指肠段,分别用0.1、0.5、1、2.5 mg/mL的白头翁皂苷提取物进行单向肠灌流实验,测定各时间点白头翁皂苷B3浓度,计算剩余药量。统计分析得Ka和Papp。结果见表 4。结果显示白头翁皂苷B3的Ka、Papp在中、低浓度随剂量的增加而增大,t1/2缩短,但在高浓度时Ka降低,t1/2延长,Papp降低,表明白头翁皂苷不完全依赖浓度梯度转运,细胞膜上的载体蛋白参与了药物的转运过程,其小肠吸收机制并不完全为被动转运。
| 表 4 不同剂量白头翁皂苷B3的吸收参数($\bar x \pm s$,n = 5) Table 4 Absorption parameters of different doses of Pulsatilla saponin B3 B3($\bar x \pm s$,n = 5) |
(3)P-糖蛋白抑制剂对白头翁皂苷B3小肠吸收的影响 取白头翁皂苷提取物适量,置于棕色量瓶中,分别加入适量盐酸维拉帕米或地高辛于K-R液试液中超声溶解,摇匀,得浓度为0.5 mg/mL白头翁皂苷提取物、盐酸维拉帕米的供试液和白头翁皂苷提取物、地高辛的供试液。选取健康SD大鼠10只,随机分成2组,按照项下实验方法,选取十二指肠段,进行单向肠灌流实验,按项下方法取样,测定各时间点B3成分浓度,计算剩余药量。统计分析得Ka和Papp。结果见表 5。采用多重均数比较的t检验,分别考察白头翁皂苷B3加入P-糖蛋白抑制剂和P-糖蛋白底物后的吸收速率,比较Ka的差异是否有统计学意义,结果显示加入维拉帕米和地高辛后白头翁皂苷B3的Ka分别为0.029 8、0.039 3 min−1,与对照组0.021 7 min−1相比,具有统计学差异(P<0.05)。说明加入P-糖蛋白抑制剂维拉帕米及P-糖蛋白底物地高辛后,白头翁皂苷B3的吸收速率有显著提高,预测白头翁皂苷B3可能是P-糖蛋白底物。
| 表 5 白头翁皂苷B3加入P-糖蛋白抑制剂后的吸收参数($\bar x \pm s$,n = 5) Table 5 Absorption parameters of Pulsatilla saponin B3 with P- glycoprotein inhibitor($\bar x \pm s$,n = 5) |
药物吸收的前提是在吸收部位呈溶解状态,故水溶性是吸收的先决条件。若溶解速度大于吸收速度,则吸收过程与剂型关系较小。若溶解速度小于吸收速度,溶解则成为吸收过程的限速步骤。油水分配系数是模拟生物体内药物亲脂性或亲水性的重要参数。药物的溶解度及油水分配系数直接影响药物在体内的吸收,是预测药物口服吸收的重要参数。本实验通过HPLC-ELSD法测定白头翁皂苷B3的表观溶解度和油水分配系数,结果表明白头翁皂苷B3在37 ℃有机溶剂中的表观溶解度较低,在碱性磷酸盐缓冲液中的表观溶解度较高;白头翁皂苷B3在不同磷酸盐缓冲液中的油水分配系数相差不大。探究了药物的物理参数对吸收的影响,为阐明其吸收规律和特征提供数据支持。
评价药物在肠道吸收的方法有离体法、在体法和体内法等多种方法。本实验采用大鼠单向在体肠灌流法,以较低的体积流量(0.25 mL/min)对4段肠段分别进行单向灌流,考察药物在不同肠段的吸收,该方法在保证了肠道神经与内分泌输入的完好无损,以及血液和淋巴液的供应的同时,实验条件与口服给药后药物接触的肠道环境较接近,吸收速率稳定,与人体有良好的相关性,在节省实验动物的同时,实验数据准确可靠。同时采用更为准确的重量分析法,用预先称重的具塞离心管收集一段时间的灌流液,实验结束后称质量,通过计算质量差对灌流液的浓度进行校正,方法简便可靠。
本部分研究考察了维拉帕米(P-糖蛋白抑制剂)、地高辛(P-糖蛋白底物)对白头翁皂苷B3的吸收影响,结果显示维拉帕米与地高辛对白头翁皂苷B3的吸收有显著影响,可显著提高活性成分的吸收。因此可预测白头翁皂苷B3可能是P-糖蛋白底物,P-糖蛋白在白头翁皂苷大鼠肠道吸收过程中起着重要的作用。
此外维拉帕米与地高辛对皂苷成分的促吸收能力不同,地高辛的抑制能力高于维拉帕米。这可能是维拉帕米与地高辛对P-糖蛋白作用机制不同造成。维拉帕米可能仅在与P-糖蛋白结合位点相结合的过程中存在与皂苷成分的相互作用而抑制外排,提高吸收能力;地高辛除底物结合位点抑制机制之外,还可能作用于P-糖蛋白的其他功能位点。
| [1] | 中国药典[S]. 2010. |
| [2] | Mimaki Y, Kuroda M, Asano T, et al. Triterpene saponinsand lignans from the roots of Pulsatilla chinensis and their cytoxic activity against HL-60 cells[J]. J Nat Prod, 1999, 62(9):1279-1283. |
| [3] | 钟邱, 倪琼珠. 白头翁中皂苷成分对肿瘤细胞的抑制作用[J]. 中药材, 2004, 27(8):604-605. |
| [4] | 闫艳, 高兴政. 白头翁体外抗阴道毛滴虫的效果及扫描电镜观察[J]. 中国寄生虫病防治杂志, 2003, 16(6):353-355. |
| [5] | Yao D, Vlessidis A G, Gou Y, et al. Chemiluminescence detection of xupiroxide anion release and superoxide dismutase activity:modulation effect of Pulsatilla chinensis[J]. Anal Bioanal Chim, 2004, 397:171-177. |
| [6] | 张文远, 韩盛玺, 杨红. 白头翁醇提物对葡聚糖硫酸钠诱导大鼠结肠炎的抗炎作用机制研究[J]. 中华消化杂志, 2004, 24(9):568-570. |
| [7] | 兰继毓, 袁继红, 邵忠俊. 五种中药杀灭溶组织内阿米巴滋养体外实验研究[J]. 中国寄生虫病防治杂志, 1996, 9(1):43-45. |
| [8] | 曹景花, 李玉兰, 邱世翠, 等. 白头翁的体外抑菌作用研究[J]. 时珍国医国药, 2003, 14(9):528. |
| [9] | 罗颖颖, 陈兰英, 简晖, 等. 白头翁皂苷调节Bel-7402人肝癌异体移植瘤裸鼠能量代谢的研究[J]. 中草药, 2014, 45(7):973-977. |
| [10] | 何明珍, 梁起栋, 欧阳辉, 等. α-常春藤皂苷大鼠在体肠吸收特性研究[J]. 中草药, 2014, 45(6):807-812. |
 2016, Vol. 39
2016, Vol. 39


