动物组织的病理学检查是毒理学试验结果评价的一个重要组成部分,随着石蜡切片、免疫组化等在病理检查中的普遍应用及GLP的实施,对动物脏器组织切片的制作要求越来越严格,不同的固定液和固定时间都会影响制片的质量[1],从而影响病理学工作者对试验结果的判断分析,造成不必要的人为偏差。所以选择合适的固定液和固定时间可以保证动物组织结构的完整性,便于充分地进行病理诊断。睾丸是药物毒性研究中的雄性性器官之一,具有产生精子和分泌雄性激素等重要功能。睾丸由实质和间质构成[3],其中实质占大部分,主要为卷曲的曲细精管,曲细精管上皮又包含生精细胞和支持细胞。由于常规的固定方法易造成曲细精管结构缺失,不利于病理学诊断,故有必要选择合适的固定液和固定时间对睾丸组织进行固定,确保组织结构的完整性。为此,作者采用3种不同类型的固定液及不同的固定时间对SD大鼠睾丸组织进行固定后制片,并通过光学显微镜镜下观察,以此综合确定合适的固定液和固定时间。
1 材料与方法 1.1 仪器与试剂德国TP1020全自动组织脱水机,德国EG1160石蜡包埋机,德国RM2155电动轮转切片机,LEICA DM5000B普通光学显微镜,甲醛(批号20120501,天津永大化学试剂有限公司),95%乙醇(批号20130810,天津大茂化学试剂厂),冰乙酸(批号20101008,天津百世化工有限公司),磷酸二氢钠(批号20130418,天津市大茂化学试剂厂),磷酸氢二钠(批号20130418,国药集团化学试剂有限公司)。
1.2 标本预处理雄性SD大鼠12只,每只动物取睾丸组织,共24例标本。每例标本经不同固定液和固定时间处理后取材。
1.3 固定方法10%的福尔马林固定液、FAA固定液、30% Davidson固定液分别固定24 h和48 h后更换到10%中性福尔马林溶液中。
1.4 病理制片常规脱水、浸蜡、包埋、切片(厚度3 μm)和HE染色后,光学显微镜下观察。
2 结果 2.1 不同固定液对睾丸组织病理学变化的影响镜下结果显示:①固定24 h后10%福尔马林组睾丸间质可见较大空隙,精子生发层排列整齐,细胞分级较明显,部分生精小管可见裂隙(图 1-A,图 2-a);30% Davidson固定液组睾丸间质可见少量空隙,精子生发层分级清晰(图 1-B,图 2-b);FAA固定液组生精小管内精子生发层局部断裂,精子生发层细胞分级尚清晰,被膜下生精小管萎缩,嗜酸性增强(图 1-C,图 2-c)。
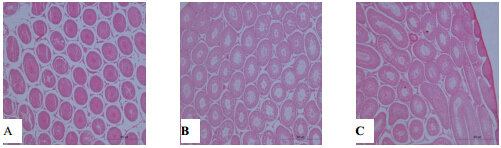 | A-10%福尔马林固定液;B-30% Davidsons固定液;C-FAA固定液图 1 3种不同的固定液固定24 h后SD大鼠睾丸组织病理学变化(HE 5.0 × 10)Fig. 1 Histopathological changes of testis after fixed for 24 h by three kinds of fixatives in SD rats (HE 5.0 × 10) |
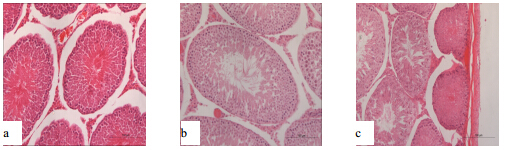 | a-10%福尔马林固定液;b-30% Davidsons固定液;c-FAA固定液图 2 3种不同的固定液固定24 h后SD大鼠睾丸组织病理学变化(HE 20.0 × 10)Fig. 1 Histopathological changes of testis after fixed for 24 h by three kinds of fixatives in SD rats (HE 20.0 × 10) |
镜下结果显示:①在10%福尔马林中固定24 h组睾丸间质可见较大空隙,精子生发层排列整齐,分级较明显,部分生精小管可见裂隙(图 3-A,图 4-a);固定48 h组睾丸间质可见明显间隙,生精小管收缩明显,精子生发层各级细胞较明显(图 3-B,图 4-b);②在30% Davidson固定液中固定24 h组睾丸间质可见少量空隙,精子生发层分级清晰(图 3-C,图 4-c);固定48 h组睾丸间质可见少量间隙,生精小管收缩不明显,精子生发层各级细胞清晰可见(图 3-D,图 4-d);③在FAA固定液中固定24 h组睾丸生精小管内精子生发层局部断裂,各级细胞分级不明显,被膜下生精小管萎缩,嗜酸性增强(图 3-E,图 4-e);固定48 h组睾丸间质可见少量间隙,部分生精小管内精子生发层断裂,被膜下生精小管萎缩,嗜酸性增强(图 3-F,图 4-f)。
 | A- 10%福尔马林固定液固定24 h;B- 30% Davidson固定液固定24 h;C- FAA固定液固定24 h;D- 10%福尔马林固定液固定48 h;E- 30% Davidson固定液固定48 h;F- FAA固定液固定48 h图 3 3同种固定液分别固定24 h、48 h后SD大鼠睾丸组织病理学变化(HE 5.0 × 10)Fig. 3 Histopathological changes of testis after fixed 24 and 48 h by same fixatives in SD rats (HE 5.0 × 10) |
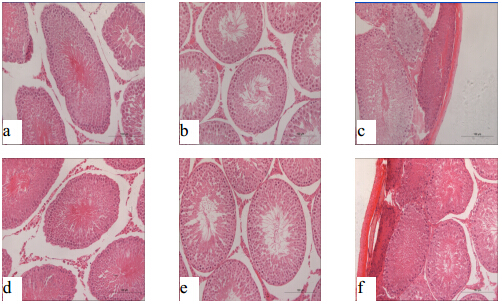 | a- 10%福尔马林固定液固定24 h;b- 30% Davidson固定液固定24 h;c- FAA固定液固定24 h;d- 10%福尔马林固定液固定48 h;e- 30% Davidson固定液固定48 h;f- FAA固定液固定48 h图 4 同种固定液分别固定24 h、48 h后SD大鼠睾丸组织病理学变化(HE 20.0 × 10)Fig. 4 Histopathological changes of testis after fixed for 24 h and 48 h by fixatives in SD rats (HE 20.0 × 10) |
组织固定的目的[4]在于保持组织细胞的形态结构、杀灭组织内的细菌、增强组织的硬度,同时可提高折光率以便光学显微镜下的观察。目前常用的固定方法包括:①物理学方法,如低温冷冻,干冰冰冻真空脱水,石蜡渗入法;②化学方法,采用各种化学溶液作固定液,使组织细胞进入固定状态。这是国内最常用的方法,也是组织病理学检查中石蜡切片制作最常用的固定方法。
固定过程中组织结构的保存效果受多种因素的影响,如固定液种类、温度、固定时间以及固定后处理方法等。因此选择最合适的固定条件有助于最大程度的保证组织的完整性。
固定液的种类直接影响组织保存和固定的效果[5],10%中性福尔马林固定液由甲醛、磷酸二氢钠、磷酸氢二钠及蒸馏水按一定比例组成,其主要利用甲醛使蛋白质分子发生交联聚合而产生固定作用,也是目前化学试剂固定组织中应用最多的方法之一;30% Davidson固定液则由10%中性福尔马林溶液、冰醋酸、95%乙醇及蒸馏水依据比例配制而成,2002年Latendresse等[6]进行了改良Davidsons固定液与Bouins液对大鼠睾丸固定的对比研究,结果显示改良Davidsons固定液引起的曲细精管萎缩不明显,形态也更清晰,FAA固定液又称标准固定液,由甲醛、冰醋酸、70%乙醇按比例配成,有文献报道[7],FAA固定液固定睾丸后对形态学观察效果比较好。本研究通过上述3种固定液对SD大鼠睾丸组织病理学变化的影响发现:30% Davidsons固定24 h后睾丸间质出现少量空隙、精子生发层分级清晰,10%中性福尔马林和FAA组睾丸间质空隙较大,精子生发层较为完整,生精小管出现不同程度的裂隙或萎缩,此结果与Latendresse的研究结果类似,说明Davidsons固定液对于睾丸固定具有更好地优势(图 1、2)。
固定时间的长短对病理组织的完整性也有很大的影响[8]。固定时间不足固定液无法完全渗入组织内部、标本固定不均匀,固定时间过长则会使组织扭曲变脆,影响后续取材制片。本研究通过在同一种固定液中对SD大鼠睾丸分别固定24、48 h后观察发现:固定时间对SD大鼠睾丸组织具有一定程度的影响,同一种固定液固定24 h或48 h后均可见睾丸间质出现间隙,48 h组还可见生精小管出现裂隙或收缩,精子生发层部分断裂(图 3、4)。
综上所述,本试验条件下,SD大鼠睾丸组织分别在3种固定液中固定24 h和48 h后:① 30% Davidsons固定液固定24 h可更好地保持睾丸组织的形态结构,变化程度较小;②固定时间对睾丸组织的病理学变化具有一定程度的影响,固定24 h比48 h更能保持睾丸组织结构的完整性。
| [1] | 乔秀林. 不同固定液和固定时间对大肠癌淋巴结免疫组化染色的影响[J]. 细胞与分子免疫学杂志, 2010, 26(5):504-505. |
| [2] | 王庆利. 药物生殖研究的考虑要点, 中国科学技术协会第十届年会[C]. 2008. |
| [3] | 刘桂明, 刘向云, 徐滢雯, 等. 睾丸组织固定法优选研究[J]. 生殖与避孕杂志, 2009, 29(3):198-199. |
| [4] | 李宝林. 组织固定的作用和体会[J]. 青岛医学院学报, 1985, 3(39):100-102. |
| [5] | 张丽荣, 朱筱娟, 杨绍娟, 等. FineFix固定液与福尔马林固定液对组织保存及固定的比较[J]. 临床与实验病理学杂志, 2013, 29(5):573-575. |
| [6] | Latendresse J R. Fixation of testes and eyes using a modified davidson's fluid:comparison with bouins fluid and conventional davidsons fluid[J]. Toxicol Pathol, 2002, 30(4):524-533. |
| [7] | 李铮, 黄华梅, 卢用湄. 三种固定液对Feulgen反应显示DNA的比较[D]. 广东解剖学通报, 1995, 17(2):131-132. |
| [8] | Moran M M, Siegel R J, Said J W, et al. Demonstration of myoglobin and CK-M in myocardium. Comparison of five fixation methods and three immunohistochemical techniques[J]. Histochem Cytochem, 1985, 33(11):1110-1115. |
 2016, Vol. 39
2016, Vol. 39


