2. 中国科学院上海巴斯德研究所, 上海 200031
2. Institut Pasteur of Shanghai, Chinese Academy of Sciences, Shanghai 200031, China
乙型肝炎病毒(HBV)是一种严重威胁人类健康的DNA病毒,在其引起的慢性感染中,病毒很难被清除。据WHO报道,全世界约有1/3的人被HBV感染[1],慢性感染患者极可能发展成肝硬化或肝癌[2]。目前,慢性乙肝患者的治疗主要利用IFN-α或者聚乙二醇IFN-α及拉米夫定、替比夫定、恩替卡韦、阿德福韦酯等核苷(酸)类似物抑制病毒的复制。干扰素治疗仅在少数人中有效[3],而核苷(酸)类口服抗HBV药物HBeAg的转阴率低,不能清除HBsAg且容易产生抗性突变[4]。HBV的感染及其所引起的各类肝病依旧是世界性问题。因而,新型的副作用少、效果好的药物亟待开发。
野菊花Dendranthema indicum (L.) Des Moul.为菊科多年生草本植物,在我国大部分地区广泛分布,作为传统中药,具有疏风、清热、明目、解毒的功效,主要治疗头痛、眩晕、目赤、心胸烦热、疗疮、肿毒等症。野菊花的化学成分主要有萜类和挥发油,黄酮类化合物及其他成分包括多糖、蛋白质、氨基酸、叶绿素、维生素等及各种微量元素,各种种类的野菊花在保肝护肝方面都或多或少具有一定的药效[5, 6]。研究表明野菊花注射液体外作用于人L02肝细胞株40 h,能促进肝细胞增殖;提取液能够抑制离体大鼠肝组织的过氧化物,提高小鼠血清谷胱甘肽过氧化物酶活性,清除氧自由基,具有保肝功能[7]。
太行菊Opisthopappus taihangensis (Ling) Shih简称太行菊,是我国特有的菊花种类,主要分布于我国南太行山区域,当地居民常以太行菊泡茶、入食等。调查结果显示,在太行菊产地,乙肝发病率明显低于全国其他地区[8]。因此本文首次对比研究了太行菊与普通野菊花的抗HBV效果,以期能找到新型的抗HBV的道地药材,为新型的治疗乙型肝炎药物的开发奠定基础。
1 材料太行菊采自太行山地区河南辉县,野菊花采自郑州市邙山,经笔者鉴定均为优质野生型;拉米夫定(3TC,规格0.1 g,批号20140301)购于葛兰素史克;绿茶提取物(GTE,批号20120712)购自杭州绿禾公司,用DMSO配置100mg/mL,保存于−20 ℃,临用前用细胞培养基稀释至实验浓度。
HepG2细胞、Ayw 1.3F HBV质粒、Luciferase HBV SP1/SP2/CP/XP质粒均来自于中国科学院上海巴斯德研究所病毒组装与宿主研究课题组馈赠;乙型肝炎病毒表面抗原检测试剂盒、乙型肝炎病毒e抗原检测试剂盒购于上海科华生物工程股份有限公司;TRNzol总RNA提取试剂、FastQuant cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂SYBR Green购于天根生化科技(北京)有限公司;噻唑蓝(MTT,批号20130301)购于生工生物工程(上海)股份有限公司。
2 方法 2.1 太行菊和野菊花不同部位的水溶液将太行菊和野菊花不同部位分离,花和茎分别制成粉末,每种药物粉末称取100 mg,分别溶于1 mL纯水,92 ℃震荡水浴40 min后,2 000 r/min离心5 min,0.45 μm过滤器滤过,滤液稀释成系列质量浓度药物100、10、1、0.1 mg/mL,备用。
2.2 太行菊和野菊花不同部位对细胞的影响为了确定实验安全浓度,采用MTT法研究各水提物细胞毒性,培养HepG2细胞,将对数期细胞铺于96孔板,每孔1.0×104个细胞,18 h后加太行菊和野菊花不同部位、不同浓度提取物,48 h或96 h后去上清,加入MTT,同时设空白对照,4 h后加入二甲基亚砜(DMSO),10 min后,490 nm波长下酶标仪测定吸光度(A)值,计算细胞生长率。
细胞生长率=给药组A值/对照组A值
2.3 太行菊和野菊花不同部位提取物对HBsAg、HBeAg的影响培养HepG2细胞,将对数期细胞铺于96孔板,每孔1.0×104个细胞,贴壁18~24h后,转染Ayw 1.3F HBV质粒,6 h后分别往96孔板中加入2.1中配制药物浓度各1 μL,使药物质量浓度为100、10、1、0.1 μg/mL,分别在48、96h收集上清,1 000 r/min离心5 min,取离心后的上清,ELISA法测定HBsAg和HBeAg。GTE为阳性对照药物,剂量与太行菊和野菊花提取物一致。
2.4 太行菊和野菊花不同部位提取物对HBV复制过程中HBV RNA的影响HepG2细胞培养、转染同“2.3”,6 h后分别往96孔板中加入2.1中配制药物浓度各1 μL,使药物质量浓度为100、10、1、0.1 μg/mL,48 h后去上清,PBS冲洗,裂解细胞,用TIANGEN RNARNzol总RNA提取试剂提取RNA、FastQuant cDNA第一链合成试剂盒合成cDNA模板、SuperReal荧光定量预混试剂SYBR Green进行qPCR检测RNA值。3TC为对照药物,剂量与太行菊和野菊花提取物一致。
2.5 荧光素酶报告基因系统检测不同提取物对HBV转录的影响HBV的复制过程包含4个不同的启动子,分别为SP1、SP2、CP、XP[9],不同的提取物可能对不同的启动子产生影响。构建将靶启动子的特定片段插入到荧光素酶表达序列前方的报告基因质粒。实验用4个HBV启动子质粒,分别为Luciferase HBV SP1、SP2、CP、XP[10],带有SV40启动子质粒作为对照质粒。培养HepG2细胞,铺96孔板,细胞贴壁后,分别转染Luciferase HBV SP1、SP2、CP、XP及SV40质粒,6 h后分别往96孔板中加入2.1中配制药物浓度各1 μL,使药物质量浓度为100、10、1 μg/mL,48 h后裂解细胞,加入荧光底物,多功能酶标仪检测结果。3TC为阳性对照药物,剂量与太行菊和野菊花提取物一致。
3 结果与分析 3.1 药物安全浓度测定结果MTT结果可知,在所采用的0~100 μg/mL各浓度下,太行菊花和茎提取物、野菊花花和茎提取物都没有明显降低或者促进细胞生长,数据无明显差异,属于细胞安全浓度范围,可以选取此浓度进行抗病毒效果实验。结果见图 1。
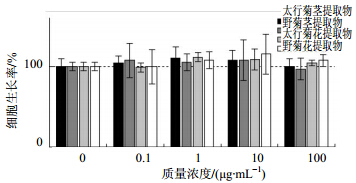 | 图 1 法分析药物对细胞生长影响结果Fig. 1 Analysis of drug effects on cell growth by MTT method |
ELISA测定结果显示,在0.1 μg/mL时,无论是太行菊提取物还是野菊花提取物的花部位对HBsAg都没有明显抑制作用,两种菊花的花提取物在10 μg/mL时,对HBsAg具有微弱的抑制作用,差异不显著;太行菊茎提取物在1 μg/mL时,作用48 h和96 h后,对HBsAg的抑制率约为30%,野菊花茎提取物在1 μg/mL作用48 h时对HBsAg的抑制率约为25%,96h后作用不明显。综上可得结论太行菊茎部位提取物和野菊花茎提取物在1 μg/mL时都能够抑制HBsAg,并且太行菊茎提取物可以更好且持续地抑制HBsAg。见图 2。
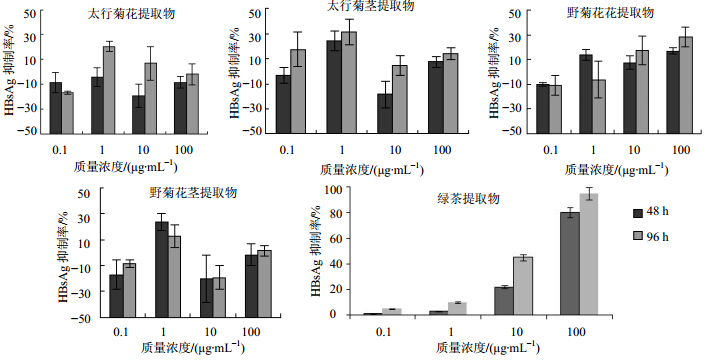 | 图 2 太行菊和野菊花不同部位提取物对HBsAg的影响Fig. 2 Influence of extracts from different parts with different concentration on HBsAg |
ELISA测定各提取物对HBeAg的抑制效果显示,太行菊花提取物在48 h时,能够在10、1、0.1 μg/mL质量浓度下抑制HBeAg的表达,10 μg/mL作用96 h时,抑制效果依然明显;野菊花花提取物作用48 h时,能够在100、10、1 μg/mL质量浓度下抑制HBeAg,在100 μg/mL作用96 h后,仍能显著抑制HBeAg表达;太行菊茎提取物在1 μg/mL作用48、96h对HBeAg的抑制率约为20%;野菊花茎提取物在1 μg/mL作用48 h对HBeAg的抑制率约为20%,96h后抑制作用不显著。综上结果,太行菊花提取物在0.1 μg/mL时的作用效果强于野菊花花提取物,太行菊茎提取物能够在1 μg/mL时持续性抑制HBeAg的表达。见图 3。
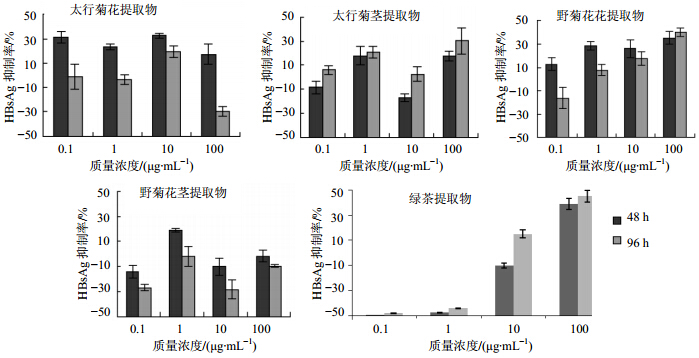 | 图 3 太行菊和野菊花不同部位提取物对HBeAg的影响Fig. 3 Influence of extracts from different parts with different concentration on HBeAg |
采用2步法Real-timePCR考察两种菊花的水提物对HBVRNA合成的影响。结果见图 4,与对照组相比,太行菊花和茎提取物具有微弱的抑制作用,但差异并不显著。说明二者对HBV总RNA的合成无明显抑制。
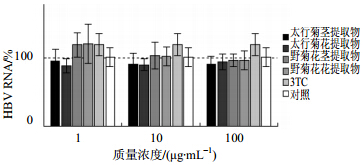 | 图 4 不同类型不同浓度提取物对HBV RNA的影响Fig. 4 Influence of extracts from different parts with different concentration on HBV RNA |
ELISA测定结果显示,两种提取物对HBV的抗原表达具有明显抑制,为了考察具体的抑制机制,采用荧光报告基因测定药物对HBV不同启动子的转录影响,以SV40启动子作为对照。结果显示,在检测CP报告基因时,太行菊花提取物在1 μg/mL时具有一定的抑制作用,而野菊花提取物作用效果不明显,该结果与HBV抗原测定结果相符。说明太行菊提取物对HBV的抑制作用机制可能与其抑制HBV CP有关。不同类型不同浓度的太行菊提取物和野菊花提取物都对其余3个启动子没有显著影响。见图 5。
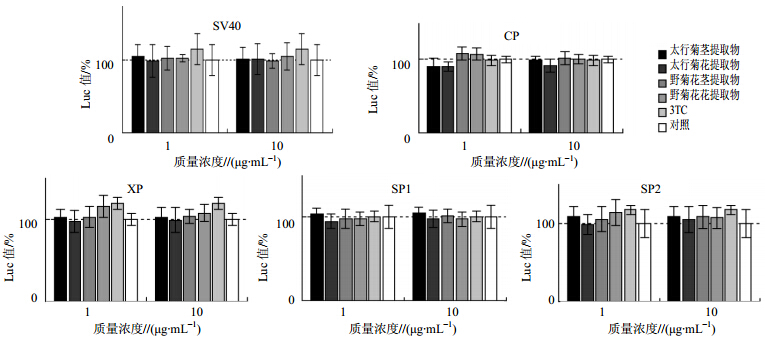 | 图 5 不同类型不同部位提取物对不同的HBV启动子的影响结果Fig. 5 Influence of extracts from different parts with different concentration on different HBV promters |
太行菊多生长在悬崖峭壁、陡坡、裸露岩石的缝隙中,其独特的地理位置与生长环境使其区别于普通野菊花。本研究首次报道了其具有抗乙型肝炎病毒作用。酶联免疫反应结果表明太行菊茎提取物能够在1 μg/mL作用48、96 h时抑制HBsAg和HBeAg,而野菊花茎提取物在1 μg/mL时只能在作用48 h时抑制HBsAg和HBeAg;太行菊花提取物能够在0.1 μg/mL时达到野菊花花提取物1 μg/mL时的表现。在荧光素酶报告基因系统中的检测结果说明太行菊花和茎提取物相对野菊花和茎提取物对CP有抑制;太行菊花和茎提取物在低浓度时对HBV RNA合成具有一定的抑制作用。本课题组前期研究显示绿茶提取物具有较强的抗HBV作用[11]。与绿茶提取物相比,太行菊和野菊花的抗病毒作用并不是太强,推测可能原因是商品化的绿茶提取物具有较高浓度及较高纯度有效成分。
上述结果证明太行菊提取物的抗HBV效果优于野菊花提取物,考虑到不同的提取方法会有不同的结果[12],在对有效抗药成分还不确定时,水提法能够更加完整的保护天然产物的原有性质。从实验结果可知随着提取物浓度逐渐增大并没有抑制效果逐渐变强的现象,可能原因是由于水提物本身成分复杂,在长时间地细胞培养中,可能降解或氧化导致有效成分浓度的降低。因此,开展太行菊有效成分的提取与分析也是今后的研究方向。药理学研究表明野菊花提取物主要是黄酮类化合物具有抗菌抗病毒、抗炎和免疫、保肝等药理作用,因此未来将专注于药物提取的有效成分分析以及分析不同提取物的作用靶点,以期望找到太行菊中有效抗药成分及其作用靶点,为抗HBV新药的发现与研究奠定基础。
| [1] | WHO. World Health Report 1996:fighting disease. fostering development[EB/OL]. (1996) http://www.who.int/whr/1996/en/whr96_en.pdf?ua=1 |
| [2] | Shepard C W, Simard E P, Finelli L, et al. Hepatitis B virus infection:epidemiology and vaccination[J]. Epidemiol Rev, 2006, 28:112-125. |
| [3] | Bona D D, Craxì A. Interferon-alpha for HBeAg-positive chronic hepatitis B[J]. J Hepatol, 2003, 39:99-105. |
| [4] | 张玥, 周植星, 江振洲, 等. 治疗慢性乙型肝炎的核苷类药物研究进展[J]. 药物评价研究, 2011, 34(2):120-124. |
| [5] | 李国栋, 陈园园, 王盼, 等. 野菊花中萜类和黄酮类化合物保肝作用研究[J]. 中草药, 2013, 44(24):3510-3514. |
| [6] | 陈园园. 野菊花中萜类、黄酮类化合物对免疫调节和肝保护的协同作用研究[D]. 郑州:郑州大学, 2012. |
| [7] | 王志东, 梁容瑞, 李宗芳. 中药野菊花的药理作用研究进展[J]. 医学综述, 2009, (6):906-909. |
| [8] | 国家统计局. 中国卫生统计年鉴[M]. 北京:中国统计出版社, 2006, 2007, 2008, 2009, 2010. |
| [9] | Locarnini S, Zoulim F. Molecular genetics of HBV infection[J]. Ant Ther, 2010, (15):3-14. |
| [10] | Xun Y, Zhang Y, Pan Q. Metformin inhibits hepatitis B virus protein production and replication in human hepatoma cells[J]. J Viral Hepat, 2014, (21):597-603. |
| [11] | 许君, 高振兴, 马倩, 等. 绿茶儿茶素抗乙型肝炎病毒的分子机制研究[J]. 营养学报, 2012, 34(4):368-372. |
| [12] | 方静, 王德, 周学琴. 野菊花两种提取方式对5种常见细菌的抑菌效果的比较[J]. 数理医药学杂志, 2007, (3):368-369. |
 2016, Vol. 39
2016, Vol. 39


