2. 江苏省中医药研究院, 江苏 南京 210028
2. Jiangsu Province Institute of Traditional Chinese Medicine, Nanjing 210028, China
炎症性肠病(IBD)是一种慢性肠道炎症性疾病,主要包括克罗恩病(CD)和溃疡性结肠炎(UC)[1]。其中,UC是一种原因不明的肠道非特异性炎症,临床表现为急性疼痛、呕吐、体重减轻、腹泻、便血等症状[2]。由于其具有病程长、难治愈,易反复发作的特点,已被WHO列入世界难治疾病的行列。近年来,UC在我国的发病率有持续上升趋势,有研究表明UC病程越长,UC相关性结肠癌的发生率就越高。目前,治疗UC的常用药物包括氨基水杨酸、类固醇类激素、免疫抑制剂等药物。但这些药物治疗成本高、副作用大,因此找到有效的、成本相对较低的药物成为研究的重点[3]。中草药在治疗UC方面表现了一定的治疗优势,其副作用小,而且成本低,被越来越多的应用于临床。复方肠泰是江苏省中医药研究院近年来参考现代研究筛选出的对大肠癌细胞敏感的中药复方,对于治疗结肠癌具有一定的治疗效果[4],基于UC与结肠癌的密切相关性,本研究主要探讨复方肠泰对于慢性UC的治疗作用。
1 材料 1.1 实验动物C57BL/6小鼠,8周龄,体质量18~22 g,购自常州卡文斯实验动物有限公司,许可证号SCXK(苏)2011-0003,饲养条件为SPF级,室温为22~25 ℃,湿度为40%~70%,自由饮食和饮水,12 h黑夜,12 h白天。
1.2 试剂葡聚糖硫酸钠(DSS,相对分子质量36 000~50 000),购自美国Sigma-Aldrich;COX-2抗体购自美国Santa Cruz生物科技公司;羊抗兔抗体IgG和羊抗鼠抗体IgG购自美国Lincoln公司;GAPDH单克隆鼠抗购自康辰公司;COX-2免疫组化试剂盒购自武汉博士德生物工程有限公司;ELISA试剂盒(TNF-α、IL-10)购自上海联硕生物科技有限公司。
1.3 复方肠泰的制备复方肠泰由人参10 g、薏苡仁20 g、白花蛇舌草15 g、莪术10 g、独角蜣螂3 g、八月扎10 g、藤梨根30 g组成,由江苏省中医药研究院提供,由江苏省中医药研究院王大为博士鉴定。将药材置于10倍体积的蒸馏水中浸泡30 min,加热到100 ℃,加热1 h后除去药渣,获得滤液。再补充8倍体积的蒸馏水同样的条件第二次加热。将两次获得的滤液混合(HPLC法测定人参皂苷Rb1为5.02 mg/g),并分装保存于−80 ℃冰箱。
2 方法 2.1 动物分组随机将小鼠分为3组,每组7只。对照组,自由饮水进食。DSS模型组,连续5 d自由饮用2% DSS溶液,接着连续5 d自由饮水,重复3个循环[5]。复方肠泰组,小鼠造模同时,每天给每只小鼠ig复方肠泰18 g/kg,对照组和DSS模型组ig给予同样体积的蒸馏水。
2.2 结肠炎评分指标每天记录小鼠体质量、大便性状、大便隐性或显性出血情况。按照Murano[6]提供的疾病活动指数[DAI=(体质量下降分数+大便性状分数+便血分数)/3]进行评分,具体评分细则见表 1;在麻醉条件下,处死小鼠,取结直肠,测量其长度。将末端结直肠固定在4%的多聚甲醛中,用石蜡包埋,进行HE染色。组织病理学评分按照Dou [7] 提供的 方法。
| 表 1 疾病活动指数 Table 1 Disease activity indexes |
取结直肠组织加入裂解缓冲液制备组织匀浆,提取总蛋白,4 ℃、12 000×g离心15 min。总蛋白量用BCA蛋白定量试剂盒检测[8]。ELISA试剂盒检测小鼠结直肠组织中TNF-α、IL-10浓度变化[9, 10]。
2.4 免疫组化分析取石蜡包埋的5 μm的结直肠切片,分析COX-2蛋白表达情况[11]。免疫组化实验操作过程主要包括脱蜡、水化,3%过氧化氢封闭内源性过氧化物酶,以及高温加热修复抗原。10%山羊血清孵育10 min之后,标本在4 ℃下与一抗孵育,过夜,之后标本在37 ℃下与二抗以及生物素-HRP孵育30 min。苏木精复染后,DAB检测免疫反应。COX-2定量计算方法:400倍光镜下随机选取10个视野,COX-2蛋白阳性染色位于细胞质内,出现淡黄色至棕褐色颗粒,以定位明确、染色明显、无明显背景着色、平均20%以上细胞染色的组织切片视为阳性,而染色弱或不染色者为阴性。
2.5 数据分析使用SPSS 15.0对数据进行分析处理,计量资料以表示,组间两两比较采用t检验。
3 结果 3.1 各组小鼠体质量和DAI比较2% DSS成功诱导小鼠产生了慢性UC。如图 1,DSS模型组小鼠在造模第二个循环期间,出现体质量下降,第三个循环之后体质量明显下降。复方肠泰显著改善了小鼠体质量下降程度。造模7 d后,DSS模型组小鼠有稀便,甚至出现便血,DAI评分结果急剧上升。复方肠泰组小鼠也有稀便、便血出现,但DAI评分明显低于DSS模型组。结直肠长度变短是结直肠出现炎症的一个重要指标。而DSS模型组小鼠解剖后得到的结直肠长度明显变短。复方肠泰组结直肠长度明显长于DSS模型组。
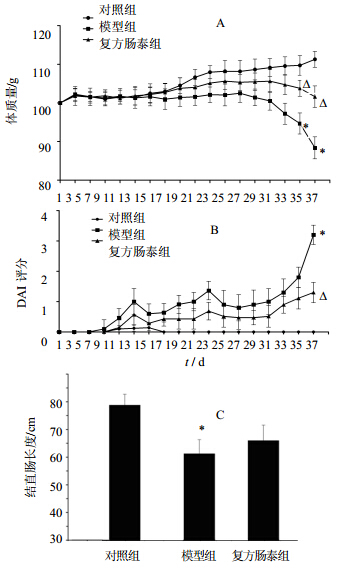 | 与对照组相比:P<0.05 **P<0.01;与模型组比较:△P<0.05;下同 P<0.05 **P<0.01 vs control group; △P<0.05 vs model group same as below图 1 各组小鼠体质量变化(A)、DAI评分(B)、结直肠长度(C)结果Fig. 1 Body weight changes (A),DAI scores (B),and colorectal length (C) of mice in each group |
将小鼠结直肠组织进行HE染色,结果见图 2,与对照组相比,DSS模型组小鼠结直肠黏膜上皮细胞损坏,腺窝结构破坏,可见密集的炎症细胞浸润。复方肠泰组小鼠结直肠结构基本恢复正常,黏膜较为完整,出现的炎症细胞较少。如图 2D组织病理学评分,复方肠泰组明显低于DSS模型组(P<0.05)。
 | A-对照组;B- DSS模型组;C-复方肠泰组;D-组织病理学评分图 2 各组小鼠结直肠组织HE染色图及组织病理学评分Fig. 2 HE Staining results and histology scores in colorectal tissue of mice in each group |
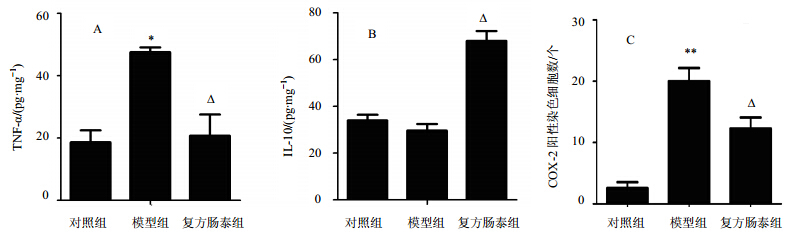
为了进一步确定小鼠结直肠组织炎症状况,主要检测了炎症因子TNF-α、IL-10、COX-2的表达情况。结果见图 3,与对照组相比,DSS模型组TNF-α和COX-2水平显著升高。复方肠泰组的TNF-α和COX-2水平与DSS模型组相比显著降低(P<0.05)。与对照组相比,DSS模型组IL-10水平降低,复方肠泰组则显著升高(P<0.05)。上述结果表明,复方肠泰能有效地抑制促炎症因子TNF-α、COX-2蛋白的表达,同时有效地促进抗炎症因子IL-10的表达,说明复方肠泰对慢性UC有很好的逆转作用。
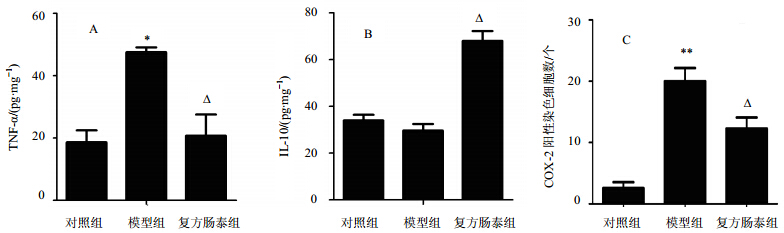 | 图 3 小鼠结直肠组织炎症因子TNF-α(A)、IL-10(B)、COX-2(C)表达情况Fig. 3 Expression of TNF-α (A),IL-10 (B),and COX-2 (C) in colorectal tissue of mice |
尽管近几年关于UC发病机制的研究已取得不错的进展,但仍有很多问题尚待进一步研究。最新的理论指出,UC发病主要与肠道的免疫功能紊乱、肠道菌群和屏障功能的改变、肠道感染、饮食、遗传易感、精神因素等密切相关。另外,这些因素可能相互交叉调节[12]。
遗传和环境被认为是肠道屏障受损的首要因素。二者的结合将导致肠道共生微生物以及它们的代谢产物转移到肠壁。这些具有侵害性的抗原将激活免疫细胞产生细胞因子,引起急性炎症反应。机体无法通过抗炎症机制或抑制促炎症反应来解决急性黏膜炎症,进而发展成了慢性炎症。更严重的是,肠道黏膜细胞因子渗透可能引起组织损害如纤维化、脓肿、溃烂、甚至肿瘤[13]。UC作为炎症性肠病的一种典型,首先发病于直肠,并继续延伸到整个结直肠,同时伴有腹泻、腹痛、便血、发烧、体质量减轻等症状[14]。
中医认为UC主要发病机制为湿热蕴肠,气血不调,使肠道传导失司,脂络受伤,气滞血凝,腐败成疡,化为脓血。目前有很多经典的传统中药复方用于治疗UC,包括黄芩汤、白头翁汤、四君子汤、理中汤、葛根芩连汤等[15, 16]。复方肠泰由人参、薏苡仁、白花蛇舌草、莪术、独角蜣螂、八月扎、藤梨根组成,具有健脾益气、清热解毒、活血化瘀、消肿散结等作用。临床研究显示其与FOLFOX 4化疗方案联用能显著改善结肠癌患者生活质量,提高其体力状况[17]。体外研究表明,复方肠泰能诱导结肠癌细胞SW480凋亡。本实验旨在探究其对UC小鼠的治疗效果。
本实验使用DSS成功诱导了小鼠结肠炎模型,DSS诱导的UC动物模型的病理改变与人类UC临床症状相似,比如典型的腹泻、便血、体质量减轻,组织病理学变化如结直肠黏膜充血水肿,结构破坏,大量炎细胞浸润等。以上实验结果表明,复方肠泰对于UC小鼠模型具有显著的治疗效果。复方肠泰组小鼠体质量减轻程度、DAI评分相对于DSS模型组小鼠得到显著改善。小鼠结直肠组织HE染色结果表明,小鼠服用复方肠泰后,被破坏的结直肠结构明显得到恢复。而且,复方肠泰通过上调抗炎症因子IL-10的同时抑制TNF-α、COX-2蛋白的表达明显改善了小鼠结直肠组织炎症状况。
由于结肠炎发病原因复杂,且炎症出现反复[18],经久不愈,病史越长引发结肠炎相关性结直肠癌的可能越高,25年病史以上的患者有40%癌变。结肠炎相关性结肠癌成为结肠炎患者的重要死亡原 因[19, 20]。目前,癌症的化学预防已经成为新的研究热点。因此复方肠泰治疗UC的显著效果对于预防结肠炎相关性结直肠癌具有一定的指导意义。
| [1] | Tanaka T. Development of an inflammation-associated colorectal cancer model and its application for research on carcinogenesis and chemoprevention[J]. Int J Inflammat, 2012, 2012:658786. |
| [2] | Lombardi V R, Etcheverria I, Carrera I, et al. Prevention of chronic experimental colitis induced by dextran sulphate sodium (DSS) in mice treated with FR91[J]. J Biomed Biotech, 2012, 2012:826178. |
| [3] | Fang J, Seki T, Tsukamoto T, et al. Protection from inflammatory bowel disease and colitis-associated carcinogenesis with 4-vinyl-2, 6-dimethoxyphenol (canolol) involves suppression of oxidative stress and inflammatory cytokines[J]. Carcinogenesis, 2013, 34(12):2833-2841. |
| [4] | 李灵常, 方明治, 王小宁, 等. 复方肠泰联合FOLFOX4方案治疗大肠癌的临床观察[J]. 临床肿瘤学杂志, 2010, 10(15):919-921. |
| [5] | Valdez-Morales E, Guerrero-Alba R, Ochoa-Cortes F, et al. Release of endogenous opioids during a chronic IBD model suppresses the excitability of colonic DRG neurons[J]. Neurogastroenterol Motil, 2013, 25(1):39-46. |
| [6] | Murano M, Maemura K, Hirata I, et al. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis[J]. Clin Exp Immunol, 2000, 120(1):51-58. |
| [7] | Dou W, Zhang J, Zhang E, et al. Chrysin ameliorates chemically induced colitis in the mouse through modulation of a PXR/NF-kappa B signaling pathway[J]. J Pharm Exp Ther, 2013, 345(3):473-482. |
| [8] | Liu W, Guo W, Wu J, et al. A novel benzo[d] imidazole derivate prevents the development of dextran sulfate sodium-induced murine experimental colitis via inhibition of NLRP3 inflammasome[J]. Biochem Pharm, 2013, 85(10):1504-1512. |
| [9] | Sanchez-Munoz F, Dominguez-Lopez A, Yamamoto-Furusho J K. Role of cytokines in inflammatory bowel disease[J]. World J Gastr, 2008, 14(27):4280-4288. |
| [10] | Louis E, Libioulle C, Reenaers C, et al. Genetics of ulcerative colitis:the come-back of interleukin 10[J]. Gut, 2009, 58(9):1173-1176. |
| [11] | Paiotti A P, Artigiani Neto R, Forones N M, et al. Immunoexpression of cyclooxygenase-1 and-2 in ulcerative colitis[J]. Braz J Med Biol Res, 2007, 40(7):911-918. |
| [12] | Seril D N, Liao J, Yang G Y, et al. Oxidative stress and ulcerative colitis-associated carcinogenesis:studies in humans and animal models[J]. Carcinogenesis, 2003, 24(3):353-362. |
| [13] | Neurath M F. Cytokines in inflammatory bowel disease[J]. Nat Rev Imm, 2014, 14(5):329-342. |
| [14] | Jin J. JAMA patient page. Inflammatory bowel disease[J]. JAMA, 2014, 311(19):2034. |
| [15] | Zhang C, Jiang M, Lu A. Considerations of traditional Chinese medicine as adjunct therapy in the management of ulcerative colitis[J]. Clin Rev Allergy Immunol, 2013, 44(3):274-283. |
| [16] | Salaga M, Zatorski H, Sobczak M, et al. Chinese herbal medicines in the treatment of IBD and colorectal cancer:a review[J]. Curr Treat Options Oncol, 2014, 15(3):405-420. |
| [17] | 陈永乐, 姚远. 复方肠泰联合FOLFIRI方案化疗治疗晚期结直肠癌临床疗效观察[J]. 当代医学, 2012, 18(15):36-38. |
| [18] | Aust D E, Terdiman J P, Willenbucher R F, et al. The APC/beta-catenin pathway in ulcerative colitis-related colorectal carcinomas:a mutational analysis[J]. Cancer, 2002, 94(5):1421-1427. |
| [19] | Carrier J, Medline A, Sohn K J, et al. Effects of dietary folate on ulcerative colitis-associated colorectal carcinogenesis in the interleukin 2-and beta (2)-microglobulin-deficient mice[J]. Cancer Epidemiol Biomarkers Prev, 2003, 12(11 Pt 1):1262-1267. |
| [20] | Eaden J A, Abrams K R, Mayberry J F. The risk of colorectal cancer in ulcerative colitis:a meta-analysis[J]. Gut, 2001, 48(4):526-535. |
 2016, Vol. 39
2016, Vol. 39


