自1960年以来,美国FDA推出的基础研究-发现-设计-临床前开发-临床研究等过程的新药研发的转化研究,这种“转化研究”的“万里挑一”的模式,可以说是最早的“转化研究”,对近50年的新药发展起了积极作用。自20世纪60年代提出“转化研究”概念以来,由于生命科学研究的许多成果都还没有被及时应用到临床,快速发展的大背景下转换医学(Translational Medicine)模式的发展,成为国际医学健康领域的“新”概念和研究模式。
美国2010年首次提出“精准医学”概念。奥巴马又在2015年1月20日的国情咨文中提出“精准医学计划”,希望“引领一个医学新时代”。他提出了“精确医学”计划是希望更接近治愈癌症和糖尿病等疾病,使所有人获得个体基因信息从而达到精准个体化药物治疗的目的。“精准医学”项目的短期目标是为癌症找到更多更好的治疗手段,长期目标则是为实现多种疾病的治愈提供有价值的信息。“精准医学”作为医学的未来是人类医学的变革。
本文在回顾和总结以上发展过程的基础上,提出“精准药学”的概念,希望它在实现“精准医疗”中发挥重要的作用,具有不同于医学研究的研究目标和研究内容。在精准医疗四要素中“精确、准时、共享、个体化”,“精准药物”治疗只有实现“精准诊断”的基础上,医疗应用相关的“精准药物”提出“精准治疗方案”,才能实现精准的个体化治疗的目的。在大数据时代,基因组学无疑是精准医学和精准药学的共同基础。
目前研究最多的是基于基因组学的癌症靶向治疗,其他疾病研究成功的并不多。但对于心脑血管疾病、糖尿病等代谢性疾病、神经退行性疾病、功能性疾病以及外源性因素(如病毒、细菌、寄生虫、外源性毒素等)引起的疾病仍然是人类健康领域的大问题。对这些疾病,因为问题主要在功能层面上,采用精准的可能性小,或者根本不可能,如何实现精准治疗并不像想象那么简单。也就是说,药物研发可以认为与健康人和病人的基因有关,与这些疾病的患者基因以外的因素有关,如病毒、细菌、寄生虫等感染性疾病的治疗还与它们的转染过程、复制的酶等生化过程有关,也与药物的制剂技术和组合有关。因此需要更广阔的知识和视野去认识研发的难度和治疗的精准性,才能开发出疗效更好、更安全、更便利、更经济的新药。本文希望能与创新研究者交流一些看法和观点,供读者参考。 1 生物医药产业的民生地位 1.1 医疗医药不但是中国的民生问题,也是世界的民生问题
医疗医药不但是中国的民生问题,也是世界的民生问题,因为世界各国都期盼有安全有效价廉的药品供给患者。大多数经市场认可的安全有效的药物均为仿制药,一些学者认为中国使用的药物95%是仿制药,新药申请95%也是仿制药。发达国家也基本如此,如美国按处方数量统计86%是仿制药[1],市售的非处方药100%是仿制药,新药申请不到10%是创新药物,申请的药物90%以上也是仿制药。在美国由于大量推行仿制药制度,使政府和患者每年可以节省2 000亿美元以上的医药费开支。据2014年6月13日国家卫生计生委发布的信息,2014年全国财政医疗卫生支出首次突破1万亿,预算安排10 071亿元,比2013年执行数增长10.5%。也就是说美国一年节省的药费开支超过我国全国财政医疗卫生费用的开支。数据比较更反映出仿制药的利国利民的地位。
从近日所获得的信息可见处方药的临床认可十分必要。2015年11月3日美国JAMA数据指出:在1999—2012年临床处方数量统计使用率排前10名的药物是辛伐他汀、赖诺普利、左旋甲状腺素、美托洛尔、二甲双胍、双氢克尿、奥美拉唑、氨氯地平、阿托伐他汀、沙丁胺醇。这10个药物包括高血压、糖尿病和血脂异常。另外一种药物是用于治疗胃食道反流的质子泵抑制剂[2]。而此期间美国批准上市的新药或能赚钱的“重磅炸弹”一个也没有。 1.2 医药产业高度垄断和竞争
医药产业是我国国民经济的支柱产业,但更是关乎国计民生的重要民生产业,从中国医药产业的发展现状来看,发展速度很快,但是仍是制药大国而远非制药强国,发展中存在很多的制约因素,产业集中度低、自主创新能力弱、技术水平低、经济效益差等。然而随着我国经济的不断发展,城镇化水平的提高,老龄化社会的到来以及国家政策的倾斜,也推动着我国医药产业的发展。但分析我国药品的进出口情况,无论是在进口还是出口方面,我国医药在世界市场上占有的竞争力和垄断性相当薄弱,与发达国家相比仍有较大差距。
药企高度垄断和竞争是世界的基本特点。美国有数以千计的医药企业,由于发达的技术原因,美国不但为本国民众提供药品,也为全世界提供药品,前20大药企市场份额超过60%,前3大流通企业市场份额在96%。中国4 000多家药企前100家市场份额不到50%,前3大流通企业份额约30%。国外大药企研发投入一般是销售额的20%,而中国连1%都不到。这种差异说明中国药企处在产业低端。2015年美国FDA官员评价道:“从在美国FDA注册的药物机构数量来说,中国排在美国之后位居第二;中国也是美国第六大药物和生物制剂提供者。中国制药业对美国的影响日趋增加,中国是美国人每天依赖的成品药物中许多活性成分的主要提供者。中国的规模及持续增长的经济对美国人的消费产品特别是药品的影响日趋增加”。因此中国要增长对中国医药产业发展的自信心。 1.3 适应临床需求的突破性治疗药物在上升
20世纪70年代开始,各类针对常见病、多发病的药物成功研发,并能产生巨大经济效益,国际医药巨头投入希望产生出一批又一批重量级又能赚大钱的药物,被称之为“重磅炸弹”药物。但如何被市场接受和畅销,其首要条件是此类药物针对某一疾病具有良好的治疗作用且副作用小,是治疗某一疾病的标准治疗药物。“重磅炸弹”药物的成功还在于其上市后不断进行的后续研究,进行临床对比试验、新适应症的开发、联合用药的研究等,要被广大处方医生用药认可和患者疗效及经济承受认可,否则风险不可避免,“新药”的淘汰也不可避免。
FDA加快审评速度以满足患者的需求,2012年“FDA安全与创新法案”(Food and Drug Administration Safety and Innovation Act)获得通过,2012年7月—2015年6月,FDA药物评价和研究中心(CDER)和FDA生物制品评价和研究中心(CBER)共收到309份突破性治疗药品申请。其中29%(90个)的突破性治疗药品申请获得批准,55%的申请被拒绝,16%的申请目前还没有明确结果。在目前已经披露资料的72个获得突破性治疗药品认定的药物中,63%(45个)的药物为抗肿瘤药、血液系统疾病药物和孤儿药。由于这些疾病缺乏有效的治疗手段,从而导致突破性治疗药品的比例较高。而在心血管疾病、免疫系统疾病和内分泌系统疾病领域明显缺乏突破性治疗药品[3]。
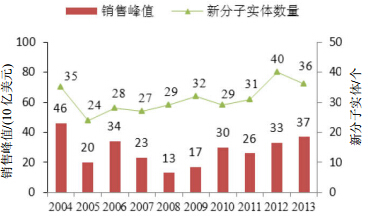
Mullard在“2013年美国FDA批准的药物”一文中对2004年以来的创新药物的年销售峰值累积额进行统计,结果(图 1)显示2013年创新药物的平均销售峰值刚好超过10亿美元[4]。如按通常的销售额标准,这些药物并未成为“重磅炸弹”。
在2015年7月美国召开的“21世纪治愈法案”得到众议院通过,却被认为此法案是在降低药物上市的标准,对批准的抗癌药物的无效率高提出异议。由于FDA采用替代性疗效指标批准一些抗癌药物上市,并成为“重磅炸弹”,而后期的临床研究未能证明这些药物能延长癌症患者的生存期和有效率。此后FDA也未对这类药物进行后续监管来确保新药的疗效和维护患者的利益。因此,有美国学者呼吁减慢快速审评的步伐。 1.4 中国以需求为导向和美国以突破性为导向的新药发展格局
从2014年获准新药的情况,透视出中国以需求为导向,而美国以突破性为导向,看出两国在新药发展格局的最明显的区别。2014年,美国和中国分别批准了41个和4个全新药物。按照FDA的标准,2014年美国批准了30种新分子实体(NME)和11种新生物制品(BLA)。而按照中国CFDA的标准,2014年中国批准了3个一类化药新药和1个一类生物制品。从数量上看,虽然中国获批新药数目远低于美国,但差距已经在缩小。中国新药获批数量稳步增加,且具有较高水平的新药越来越多,以往多见的伪一类新药逐渐减少。目前中国正在申报生产的一类新药达数十个,正在开展临床研究的品种达上百种。在国家政策加大新药创新引导扶持力度,以及企业对新药创新投入日益增加之下,中美新药获批数量的差距必将逐渐缩小。但中美的新药创新水平有较大的差距,创新的方向也有较大差异。因此,尽管都以临床需求为导向,但中国的新药创新多属于me-better,在已上市品种的基础上优化而成,缺乏突破性的原始创新。 2 新药研发的特点和难点 2.1 新药研发艰难,安全、有效、产业化是新药研发三个要素
安全需要进行材料来源(化学的、生物的、天然的)选择、结构活性研究、体外和动物实验、动物到人的生物活性的预测、成药性开发(安全性、有效性、可用性)研究等一系列复杂过程。有效体外活性发现和计算机模拟筛选与评价、体外和动物模型试验、人临床评价试验中包含许多基础和应用研究问题。产业化是通过设计-小规模生产-制备规模生产-产品上市而形成的。研发过程极其复杂,需要整合多学科,特别是技巧和团队,并要求具有广泛指导和管理经验的领导,新药研发还涉及很多内因及外因。 2.2 以靶点为核心的新药发现与开发
新药发现、研究、开发、上市是一复杂漫长的过程。药物研发是一艰难而风险巨大的事业,失败总是与成功同在,甚至有时失败是致命的。不用说我国生物医药在创新基础、核心技术、关键制造、高端设计方面的不足,就连跨国医药巨头在热门靶点新药研发也逃不出失败结局。这意味着新药研发整体研发思路所指导的、以成药性为目标的研发的艰巨性。 2.2.1 靶点是热门
在过去20年里,新药物靶点的发现率并无显著增多,平均每年发现5.3个新的药物靶点。随着伊马替尼的上市,以激酶为靶点的药物研发受到追捧,而最先被批准的新适应证通常是针对罕见疾病。因此在治疗发病率高的主要病症中的药物创新率很低。研究者发现,所有的药物靶点大概有130个“特定药物结合域”。
靶点用于抗癌药物的开发已是热门。基因工程修饰的CAR、TCR T细胞的应用将是个性化免疫治疗时代到来的标志。2000年后肿瘤信号网络被逐渐阐释、完善,大量的分子靶向药物进入临床研究或走上市场,近年针对受体酪氨酸激酶靶点如Bcr-Abl、VEGF/VEGFRs、PDGF/PDGFRs、EGFR/ HER2、ALk已有多个药物上市,但扩展适应症、克服耐药性、优化治疗方案的研究还有待发展。在肿瘤信号网络中,FGFR、c-Met、HER3、Hedgehog等靶点和PI3K/Akt/mTOR、Raf/MEK/ERK两条细胞内信号通路的研究。针对DNA损伤修复的PARP的药物研发,针对蛋白-蛋白相互作用的新靶点如Bcl-2、MDM2、IAP也有进展。目前研究得最多的是HDAC抑制剂,表观遗传的其他靶点如组蛋白赖氨酸甲基转移酶EZH2、组蛋白H3甲基转移酶等处于基础研究中。除此之外,近来抗癌领域的免疫疗法无疑是新热点,调节CTLA4、PD1/PDL1、4-1BB、OX40、CD27等免疫检查点可以激活T细胞免疫 应答。
就癌症而言,癌受体表达、诱癌基因变异、转移进展、微环境的变化等等原因对药物应答也不同。因为这些因素可能影响一个药物的实际治疗效果,所以一个新药即使有效也极少对所有患者都有效。“去风险”的第一步是寻找高度确证的靶点。什么是高度确证的靶点?最理想的靶点应该有不同类型人类基因变异数据的支持。多数项目是依靠动物基因剔除甚至对某些化合物的反应。而这些确证数据与人体疾病关联微弱,最终是继续还是终止(go/no go),均会因研发方向和项目人而决策。比如治疗精神分裂症的靶点,多巴胺受体的一个亚型D4。这个项目立项的主要根据是当时最有效的药物氯氮平和这个靶点有亲和力。但是,氯氮平和几十个靶点都有较强的亲和力,所以通过D4起效的可能性很小。如果继续坚持D4这个靶点也可能成功,但必须平衡成功可能。 2.2.2 疾病发生机制的复杂性
疾病是复杂的,因为每个人都有一些遗传和非遗传因素影响疾病易感性。在遗传性精神分裂症方面可能存在数百个不同的基因,能成为疾病的风险。因此作用于单基因的一种药物不能起到治疗效果。在神经精神疾病、传染病和癌症疾病中,过去的20年药物设计已选择性地靶向于一个单一的分子不能确定就能发现新药。由于这些疾病的复杂性,这些药物往往是无效的。此外,一种药物所作用的单一目标蛋白可以与许多其他蛋白相互作用,这些不能预期的相互作用还可能会导致毒性和不良反应[6]。
辉瑞、罗氏、礼来、默沙东等多个跨国药企曾经都对其在研的CETP抑制剂抱有极高的期望去开发血脂调节新药,2006年末,辉瑞在投资8亿美元,具有希望的血脂调节剂Torcetrapib的关键性试验中发现可能增加患者死亡和心血管事件的风险而中止了这个CETP抑制剂药物的开发。罗氏在坚持了几年后(2012年),经过对Dalcetrapib的III期试验进行中期评估,发现该在研新药对提高HDL-C方面缺乏疗效,最终放弃此药的开发。3年后礼来根据一个独立数据监察委员会的建议,停止了Evacetrapib的研究。现在,默沙东的Anacetrapib成为目前还在开发的一个CETP抑制剂,该候选药物正在进行一项后期试验,试验结果有望于2017年获得。早在4年前,该公司还称“降胆固醇新药Anacetrapib有望成默克主打产品”,但目前这类药物最大的问题是能否安全地降低死亡、心脏病发作及卒中等问题,而使默沙东背负更大的压力。为此该企业以谨慎小心的态度采取分步走的策略,步步为营地开展Anacetrapib的安全性及疗效验证研究[7, 8, 9, 10, 11]。 2.2.3 一个靶点药物对一类疾病还是多种疾病
在一段时间中,p38MAP激酶抑制剂是开发的热点。p38MAP激酶是细胞内重要的激酶,p38有α、β、γ和δ 4种亚型,可以由细胞外的多种应激热休克、炎症因子、特定抗原等及其他应激反应活化。世界许多药企试图开发p38MAP激酶抑制剂,用于多种疾病治疗的新药,但发现更多的是用于关节炎,少数用于COPD以及心脏病。而且目前绝大多数企业都以失败告终(表 1)[12]。
| 表 1 开发失败的p38MAP激酶抑制剂 Table 1 P38MAP kinase inhibitors with development failure |
GSK的第一个用于治疗关节炎和COPD的p38MAPK抑制剂dilmapimod因为疗效不明显,而停在了II期临床。之后Losmapimod用于心脏病的p38MAP激酶抑制剂早在II期临床时发现没有达到主要终点(CRP和troponin浓度变化)的疗效,而放弃了III期研究。这个靶点失败的案例很多,近120个在研新药均被列为“终止”、“退出”、“无进展”的候选药物名单之中。因而有人将p38MAPK 称为“毁人不倦的靶点”,虽然这一靶点有着非常诱人的临床前生物医学特点,但往往在投入巨资和时间后才发现一无所获[12, 13]。按每个候选药物到完成II期临床试验需要投入10亿美元计算,估计损失达1 200亿美元。
最引人注目的是针对免疫细胞的CTLA-4和PD-1信号通路这两种免疫疗法靶点。在免疫系统中,T细胞在识别癌细胞、直接杀死癌细胞以及组织免疫系统发挥歼灭肿瘤细胞等方面具有重要作用。T细胞能调控CTLA-4和PD-1信号通路、防止T细胞失控并伤害自身组织,而肿瘤细胞也正是利用这一机制,通过激活这两种被称为“免疫检查点(checkpoint)”的受体[14, 15],来逃避T细胞的追杀。针对CTLA-4和PD-1的免疫疗法,正是要抑制这两种“免疫检查点”的作用,使T细胞恢复癌细胞杀手的能力。单抗药物ipilimumab就是针对CTLA-4通路,而nivolumab和pembrolizumab则是针对PD-1通路的免疫药物。所以尽管这种免疫疗法在一些癌症患者身上取得了可喜的效果,检查点抑制剂(checkpoint inhibitors)可以通过缩小肿瘤来延长患者的生命,有的患者的生存期甚至延长了好几年。但是同样的疗法对于其他很大一部分患者却效果不佳,使用了ipilimumab只有20%的黑色素瘤患者的生存期延长了,另外80%的患者却没有有效反应。
最近Science杂志发表的文章[16, 17, 18]中看到,研究者通过小鼠实验揭示了一个令人惊讶的发现,这些对免疫治疗无效的患者,可能在其肠道里没有合适的微生物群落。这两项研究都表明,肠道共生菌的组成,可以决定这些针对癌症的免疫疗法是否有效。研究揭示了肠道共生菌与检查站抑制剂疗效的关联,极有可能改变医生使用抗癌药物的策略。不过研究也看到一些潜在的应用障碍,而且目前微生物是如何促进免疫应答的机制还有待进一步研究。 2.3 过低的学术药物研究对开发的影响
从现有的信息来分析,进入Ⅰ期临床的“药物”有90%以上是不会上市的。然而在失败前,任何一个做项目的人无论是发表论文还是科学报告都认为其数据是可信的,这个项目是会成功的。实际上他们的发现和由此产生的数据仅仅是“万里长征走出了第一步”。
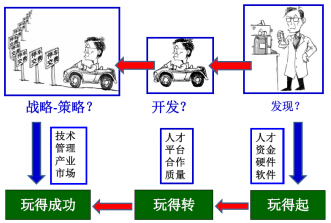
新药研究各家都有自己的套路。对于小分子新药研发,如熟知的相关的生物标志物作为临床观测指标的临床开发策略;又如以“靶点组织自由药物浓度-与靶点以预期方式结合-相关药理变化”的三维转化、Lipinski五规则等也可弥补合理设计、高效执行的一些缺陷。总之,新药研发精彩,但是它是当今最为复杂的科研活动之一,还有好多问题未被认识。不管按何种套路组织基于靶点的活性候选物的发现、还是发现后确定进入开发必须考虑“玩得起”,确定开发以后必须考虑“玩得转”、更需要考虑开发的战略和策略,分析“玩得成功”的方略(图 2)。
 | 图 2 从发现到开发的路径决策Fig. 2 Path decision from discovery to development |
每年药物化学杂志(J. Med. Chem.)发表上千篇文章报道数以万计的新化合物,但最后能成为上市药物的凤毛麟角。这是为什么?必须知道,新药研发要遵循无效推定规则,即任何化合物要假设其无效,所有试验都是试图推翻这个假设。只有有足够勇气地“去风险”的项目才能维持创新的生存和发展。
2012年成立的学术药物发现联盟(Academic Drug Discovery Consortium)目前已在9个国家成立了超过115家研发中心。然而,学术药物发现联盟中的药物研究人员如果缺乏区分“活性化合物”中良莠的能力和认识“捣蛋”分子的能力,反而干扰创新研发。因为对多种蛋白质“有反应”、“有前景”的干扰化合物被研究者反复报道,相关数据充斥着化学文献库。再三将假阳性分子错认为有效的新药,带来一轮轮的“筛选-发表-折腾”的恶性循环。药业公司将这些假阳性化合物放进产品目录,号称是有发表论文“支持的蛋白质抑制剂”,引导其他生物学家也在自己的研究这些假阳性化合物,造成极大浪费,结果是“全是付出,没有回报”[19]。最近一组研究人员对超过18 000种化合物进行了筛选[20],最终发现了一种叫做6-OH-dopa的小分子能够阻止RAD52与单链DNA结合。首次证明该6-OH-dopa小分子选择性抑制RAD52,可以在体外细胞模型中阻断BRCA缺失癌细胞的生长。并发现该化合物不仅对乳腺癌和卵巢癌的治疗具有重要意义,肺癌、前列腺癌、胰腺癌甚至是白血病都可能出现BRCA缺失,也都可能成为6-OH-dopa的靶向治疗癌症类型。因此6-OH-dopa或可在将来作为癌症治疗的精准靶向药物得到进一步开发。但是从新药研发角度来看,该化合物活性尚处于“学术药物”研究期,要成为能治疗多种癌症的新药还有漫长的路程。
新药进入临床试验阶段,提升其有效性是关键,终止试验的主要原因,不但与有效性有关,也与安全性有关,是研发链转化成功的关键[21]。2014年Nature Review Drug Discovery刊登了一篇阿斯利康(AZ)总结研发教训,分析了该公司2005—2010年在研产品和整个制药工业的对比[22]。从AZ与行业中其他企业创新的比较发现,临床前研发成功率相似,进入II期临床明显低于全行业,最终上市成功率仅为2%,远低于全行业(6%)的水平。从安全到有效的剂量预测出现偏差,导致有效性失败是五维框架缺位导致的。
福布斯的分析家分析1997—2011年各大药厂投入和产出时发现AZ效率最低,这段时间投入平均每120亿美元才上市1个新药,新药研发越来越难。总结提高研发成功率必须做到5个正确(5R):正确的靶点(Right target)、正确的人群(Right patients)、正确的组织暴露(Right tissues)、正确的安全窗口(Right safety)、正确的市场潜力(Right commercial potential),即必须在五维框架下考虑其研发路径。并认为对候选化合物(候选药物)特性要求过低也是重要原因,而对临床前毒性信息视而不见,希望不会在患者身上重现。研究发现大多数临床前项目失败是安全性问题,75%的副作用是化合物作用机制本身。AZ的候选化合物在II期临床还有30%因安全性问题失败,高于业界平均值。其原因有:(1)临床上安全性问题一半是因为机制的副作用,一半来自化合物,说明他们设计的化合物的决策系统缺陷;(2)选的靶点本身存在问题,与机制相关副作用,即疗效和副作用在机制上无法分开的问题未进行深入研究[22]。 2.4 研究重现性对新药研发的影响
突出影响新药成药性的问题很多:(1)有靶点不一定能用于药物发现,有“活性”化合物不一定能成药(发现研究与比较研究有区别,“学术药物”与“新药”有区别);(2)动物疾病模型与人疾病的生物标志物的不一致性,不能预见临床的有效性和安全性;(3)动物安全性评价结果不能有效地预测药物的安全性;(4)临床试验受试者的结果不具备显著的代表性;(5)新医药产品(基因、纳米、生物技术药物)的出现还无可靠的临床前和临床评价的工具和标准。将临床前研究资料过渡到临床的问题反映出提高成药性的难度[21]。
在过去的10年间,关于生物医药可重复性研究的担忧持续增加。2013年Nature杂志曾曝出,发表的论文80%的实验结果不能重现。在该文中提到的几个例子,如2011年,德国拜尔公司的一项内部调查发现,在67项内部临床前研究中,大约2/3无法验证。2012年,美国加州的安进公司报道,它们对53项关于癌症的论文的重复性研究发现,89%的研究结果无法重复。2013年5月对美国德克萨斯州MD安德森肿瘤研究中心的一项调查研究发现,至少有50%的已发表数据无法进行重复[23]。这一系列证据说明,医学研究存在很大的虚假成分,这对医学研究的健康发展会产生巨大的干扰。面对大量生物医学实验不具重现性,该怎么办?生物医学研究的关键结果必须有重现性,否则可能没有任何应用价值[24]。2005年的一项研究表明科学期刊更倾向于刊登阳性的结果。制药公司的研究人员报告称他们试图重复一些论文的结论,但失败率达到75%。
一些研究机构已经开始采取措施降低不可重复的比例,比如美国国立卫生研究院(NIH)要求期刊采取措施来提高实验结果的可重复率。从实验设计、实验操作手册、生物试剂、参考资料及数据等方面来分析,导致研究结果不可重复的原因是生物试剂对照参比物质(36.1%)、实验设计(27.6%)、数据分析(25.5%)、实验方案(10.8%)。任何问题或遗漏而导致实验结果不可重复对于生物医药研发都是一种资源的浪费。美国科学家估算每年在不能重复的基础生物医学研究上花费280亿美元[24]。 3 从转化研究到精准医学 3.1 转化研究/转化医学
从追溯文献来看,“转化研究”(Translational Research)的医学概念是1968年在英国的《新英格兰医学杂志》(NEJM)中出现的[25, 26],当年NEJM首次提出从实验室到病床的概念(bench-to-bedside)。FDA在评价新药和申请审批中应用“转化研究”的模式也可以追朔到1968年[27],至今也有40多年历史了。即使是经过“万里挑一”过程获得的新药,还是解决不了临床安全有效的问题[3]。转换研究发展可以追溯到1978年,Abernathy提出基于从产品创新的主导设计到工艺创新而提出的转换研究概念和新产品研发的三个阶段:(1)探索研究阶段是从广泛试验到设计研究;(2)转换研究阶段是从工艺创新到产品创新;(3)特定评价阶段是从产品创新到产业化[28]。
在1992年,Choi在Science杂志再次肯定了“从实验室到病床”的概念[29]。Geraghty基于试验研究的知识向临床实践的认识,在1996年的Lancet杂志第一次提出了“转化医学”这一名词,他认为基因突变的发现将对临床实践有很大的影响。然而科学知识转化为患者的利益并不明确,在许多情况下,新发现的基础科学到临床实践的“转化医学”是一个巨大的挑战[30]。2003年NIH的Zerhouni在Science杂志上较全面地阐述了转化医学的概念[31],NIH发展路线图是旨在加快医学研究的重大举措,将解决NIH不能单独应对的挑战。但NIH作为一个整体在该路线图确定了未来研究团队发展的机遇,通过研究发现的新途径,再造向临床研究的转化。其意义是将基础研究的成果转化为有效的临床治疗手段,强调从实验室到病床旁的连接。
基因组、蛋白质组、代谢组学等分子生物学技术和生物信息学在生命科学中的广泛应用,为生命科学研究带来了前所未有的深度和广度,但也使基础和临床研究的距离加大。生命科学研究的许多成果都还没有被及时应用到临床。在这种生命科学的快速发展的大背景下转换医学就推进其研发模式的发展,成为国际医学健康领域的“新”概念和研究模式。
2009年Science Translational Medicine杂志创刊时,Science主编Bruce 说“转化是一种艺术”[32]。随着科学的进步,人类的知识正在不断积累,今天的科学和技术正在以日益增加的速度产生新知识。与10条知识相比,100条知识能比前者多100倍的方式组合。最震撼人心的创新常常来自完全不同领域的知识的结合。新方法会在转化的碰撞中产生。
正如FDA的白皮书中所透露的信息,批准上市的新药有相当大比例对某些疾病的治疗是无效的,FDA统计的9类药物临床疗效不佳(图 3),其中以抗癌药物疗效最差,对患者75%是无效 的[33]。本世纪初,奥巴马政府提出“21世纪治疗计划”法案致力于加快研究成果转化为临床应用的速度。这种结果使美国NIH和FDA反思“转化研究(转化医学)”并没能通过转化提高和加快新药成果转化能力和速度[34]。
 | 图 3 FDA统计的9类临床疗效不佳药物的无效率[30]Fig. 3 Inefficiency of nine kinds of poor clinical efficacy drugs counted by FDA [30] |
美国医学界2010年首次提出“精准医学”概念[35]。奥巴马又在2015年1月20日的国情咨文中提出“精准医学计划”,希望“引领一个医学新时代”[36],希望更接近治愈癌症和糖尿病等疾病,使所有人获得个体基因信息从而保护自己和家人的健康。
“精准医学”项目的短期目标是为癌症找到更多更好的治疗手段,长期目标则是为实现多种疾病的个体化治疗提供有价值的信息。 3.3 以基因组学为背景的大数据是发展精准医学的基础
以个体为中心的、整合不同数据层的生物学数据库,以及高度关联的知识网络是迈向精确医学的必要条件。它取决于是否拥有一个大型的、多层级的、充分整合的人类疾病知识数据库。Garay为推动个体化基因组学研究用于癌症治疗,他基于各种端点分析,使用分层肿瘤亚型或组合进而缩小分类,以确定在一个非常特定的方式给予适当的靶向治疗,即依据个人基因信息为癌症及其他疾病患者制定个体化医疗方案[37]。精准治疗的概念出现之前,在1986年就有研究者提出精准用药(Precision of dosage)的问题[38]。
基于基因的大数据是精准医学发展的重要组成部分,以6V(Volume,Velocity,Variety,Veracity,Variability,Value,即容量性、速度性、多样性、准确性、变异性、价值性)为特点的大数据对于生物医学和健康信息学是一重大挑战[39],因此也是一个复杂的系统工程。遗传药理学发展已经增加对化疗反应的不同认识,也感到在线健康交流和数据对公众健康和控制流行病研究的重要性。在药物应用方面,可以预计,健康大数据能起到药理学和分层医疗的重要作用。患者有类似的癌症亚型却有不同的反应时,用相同的化疗方案。如BRAF突变(Y472C)对治疗肺非小细胞癌达沙替尼的响应的多态型的基因有关[40],多个基因与直肠癌的响应于化疗相 关[41]。早在2005年Xie 和 Frueh就讨论过应用药物基因组学开展个体化治疗的问题[42],由于每个人的遗传背景的差异,每个人在治疗时所需的剂量是不同的,而一成不变的剂量和给药方法用于治疗,其效应是不同的,有的有效、有的无效、有的还会有安全性问题。个性化药物方案必须基于每个人的代谢酶表型不同,而选择不同剂量的药物(图 4)。如CYP2D6突变与他莫昔芬的治疗效应有关[43]。基因组及其基因突变的不稳定性是药物的反应多样性的原因。已有研究揭露基因组学和化疗的敏感性、有效性和毒性的复杂相互作用[44, 45, 46]。特别是与疾病相关基因的突变、代谢酶多态性、转运蛋白的多态性对药物效应产生如何的影响,不仅与精准治疗有关,也更与新药研发和老药的合理应用有关。
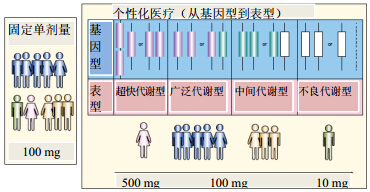 | 图 4 固定单剂量治疗与个性化医疗的比较[42]Fig. 4 Comparison on fixed single dose therapy and personalized medicine [42] |
精准医学其实是还原论的典型,就是希望能从分子水平上认识生命和疾病,但是从分子水平上认识疾病只是一种手段,并不是全部,因为所有的分子并不等于整体的生命。研究者经常使用的基因动物模型,例如某个基因缺乏导致动脉硬化,采用一些治疗措施,这些治疗并不是针对这些基因的特定方法,而效果依然有效。所以基因缺陷不等于一定发生某些疾病,疾病的发生远不是分子能完全解释的。既如此,面对复杂的生命和疾病,所有还原论研究需要慎重对待。
正常组织可以存在大量突变,那么所谓恶性突变作为治疗靶点的所谓精准,如何能让人放心。癌症是一种复杂的基因组疾病,其实对于恶性肿瘤的发生,基因突变尽管重要,但并不是认识疾病的全部,或许需要将每个人的所有组织的基因进行序列检测。最近Xie[47]的研究认为在单细胞中进行精确基因拷贝数的计数以及基因点突变的检测是一项重要的技术,使得能够在单个分子检测、理解并改善生命过程,也提供了“精准医学”的有用手段。即使如此,恶性肿瘤的问题是否就可以完全解决,现在还不能过于乐观。除癌症外,心脑血管疾病、糖尿病等代谢性疾病、神经退行性疾病以及感染性疾病(如病毒、细菌、原虫、寄生虫感染)仍然是人类健康领域的重大问题,对这些疾病,如从基因及其突变出发,采用精准治疗的可能性小,或根本不可能。对人类,对于生命现象,对于疾病发生,都完全没有进入自由王国,距离完全解决问题仍然有巨大差距,甚至将在一个相当长时间内也不可能达到完全解决问题的目标。 3.4 精准治疗四要素:精确、准时、共享、个体化
“精准医学”概念实际上是21世纪的医疗模式的升级版。如4P医疗模式—预测(Prediction)、预防(Prevention)、个性化(Personalization)、参与(Participation),TIDEST模式—找靶点(Targeted)、整合(Integrated)、以数据为基础(Data-based)、循证为基础(Evidence-based)、系统医学(Systems Medicine)、转化医学(Translational Medicine),“精准医学”概念是兼收并蓄以上模式而发展和存在的。不管采用何种模式用于疾病治疗,对精准医疗来说必须满足四大要素:精确、准时、共享和个体化。
(1)精确(the right treatment):“合适的患者,合适的时间,合适的治疗”。对于“合适的治疗”——“对他们的基因测试,使医生知道此种新的抗病药物对哪些人会有效,而对哪些人会有不好的副作用。这样受惠的病人现在还不够多,但是会变得越来越多,未来就在眼前”。
(2)准时(at the right time):“准时就是一切”。所有的医疗只有在合适的时间才是真正合适的 治疗。
(3)共享(give all of us access):人人健康理念的共享还意味着“共为”。医疗集团、医药公司、医院、政府相关机构,都已表示对精准医学的支持和参与。
(4)个体化(personalized information): “有的场合,精准医学称之为个体化医学”。每个患者都是独一无二的,医生因人用药,这是一个非常重要的发现。
在理论上,精准医学概念会带来利好。但是如何实现精确、准时、共享和个体化等四大要素,还面临许多问题,如面临的基础如何?精准医疗做到精准,到底如何做?没有精准诊断,治疗方案能精准吗?没有精准治疗药物治疗能精准吗?临床治疗到底如何用药?如何规范诊断、用药、治疗?4 精准药学(Precision Pharmacy) 4.1 什么是精准药学?
“精准医学”作为医学的未来发展方向,是整个人类在基于现有基因科技、生物信息学高度发达的情况下开拓出来的一个医疗新领域,是人类医学的变革。广义的“精准药学”属于“精准医学”的研究范畴。但“精准药学”在实现“精准医疗”中起着重要的作用,具有不同于医学研究的研究目标和研究内容。“精准药学”的定义包含药物研发和临床用药两个方面的科学问题,一是在从靶点验证与治疗适应证关联、新药来源优化确认、临床前与临床试验关联、产品设计与产业化等全过程精准监管,达到药物精准研发的目的,提供精准的安全有效的信息,达到安全有效的目的;二是实现临床精准用药,对特定患者对特定疾病进行正确的诊断、在正确的时间、给予正确的药物、使用正确剂量(Right diagnosis,right time,right drugs,right dose,4R),达到个体化精准治疗的目的。
2015年8月5日,FDA在其官方网站公布,为更好的实现美国总统2015年1月20日提出的“精准医疗”计划,全世界的科学研究者需要协同工作,以确保基因检测和突变解读的准确性,FDA发起了一个名为“精准FDA”(Precision FDA)的基因组信息学社区和共享数据平台[48, 49]。这是一个为研究人员准备的开源、基于云的工具,它将为下一代测序诊断提供依据,并且为所有开发者提供了统一的、可共享的在线基因组信息数据库。为实现总统的设想,需要协同工作,以确保遗传变异的检测和解释遗传变异的准确性。并可以通过“精准FDA”平台分享、使用、重复和验证他人的研究成果,共同促进“金标准”形成并减少不必要的重复建设。 4.2 药学在精准医学中的地位
“精准药物”的个体化药物开发时代面临问题很多,新药需要超越老药,有更高的疗效、更低的不良反应、更方便等特点和优势,更精确的选择病人和用于病人才能显现“精准药物”的作用。药物如何应对千差万别的患者?怎样才能达到精准治疗?以个体为中心、整合不同数据层的生物学数据库,以及高度关联的知识网络是迈向精准治疗的必要条件。取决于是否拥有一个大型的、多层级的、充分整合的人类疾病知识数据库,以患者为中心迈向“精准医学”的疾病知识数据库和知识网络的关键。
在美国,药物监管如此严格的国家,其药物不良反应还是很常见。据2008年的统计(National Vital Statistics Reports,Vol. 56,No. 10,March 7,2008),每年220万患者出现药物不良反应,每年处理不良反应所需费用额外增加1 770亿美元。5%的住院患者是因为不良反应,10%住院患者出现药物不良反应,不良反应每年致70万人伤残或死亡,1998年以来,药物不良反应是美国住院患者死因的第6位(表 2)。59%药物不良反应是由于药物代谢酶的基因多态性引起的。
| 表 2 药物不良反应导致的死亡人数与疾病死亡人数的比较 Table 2 Comparison on number of deaths caused by adverse drug reactions and diseases |
我国每年药物所致严重不良反应约250万例,药物所致死亡约20万例。2013年,中国卫生总费用31 868.95亿元,医保基金支出占卫生总费用的比重超过30%(10 000亿元),其中医保支付费用超过5 000亿元(50%)。由于常规药品治疗的有效率不高,约1 000亿元无效支出。在临床前药物研究,使用动物实验模型或疾病模型不能发现中国人群中特异的基因型分布以及中国人群中某种基因型的特殊比例之间的关系。另外我国使用的药物99%来源于欧美国家,中国人群与外国人群中的特异的基因型分布以及中国人群中某种基因型的特殊比例的差异不明,也影响我国人群的用药安全和有效。在大数据时代,如何管理患者信息载体和信息源,又如何掌握患者的基因信息和如何将生物信息学与早期临床前结合均有问题需要解决。
精准医疗四要素:精确、准时、共享、个体化,“精准药物”治疗需要“精准诊断”-“精准药物”-“精准治疗方案”(4R方案)才能实现精准的个体化治疗的目的(图 5)。
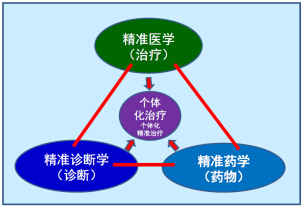 | 图 5 在个体化精准治疗中精准药学与精准医学和精准诊断学一样重要Fig. 5 Precise pharmacy is just as important as precise medicine and precise diagnosis in individualized treatment |
新药研发的本质是新药发现到开发的转化研究。自从20世纪60年代确定新药临床试验的Ⅰ、Ⅱ、Ⅲ、Ⅳ期划分以来,新药研发的研究模式和技术路径基本固化,已经走过近半个世纪历程。这一全球通行的新药研发模式是一条相互制约的转化研究链,具有周期长、费用高、成功率低等特点。在这一复杂的庞大系统工程中,所涉及的学科门类众多。而转化研究有助于构建创新药物的基础研究、临床前研究和临床疗效评价直至新药制造和临床应用的系统研发链,顺畅基础医学和生物学与创新药物研发、临床医学之间的信息和研究关联,缩短创新药物从实验室到临床应用的研发周期。如在新药研发和临床应用过程中,化合物的体内过程(吸收、分布、代谢、排泄,ADME)是其成药性的重要指标。化合物ADME/T性质在创新药物转化研究中发挥重要作用并贯穿研发过程。因此,在药物设计及新药开发早期就开展药物代谢研究,有利于提高新药研发的成功率,降低新药开发的成本,获得安全、有效的治疗药物。
按照已有研发模式,药物治疗三大难题(疗效不佳、安全性差、费用高)均难以解决。完成临床前评价研究只有约10.4%的候选新药获得进入I期临床试验,I期试验中由于安全性问题,只有64.5%转入II期临床试验。这期临床试验后由于有效性和安全性问题只有32.4%转入III期临床试验。这期临床试验后由于有效性的优势问题只有60.1%可以进入注册上市程序的审评,而在此审评中只有83.2%被批准上市(图 6)。
 | 图 6 新药进入临床试验后的失败率Fig. 6 Failure rate of new drug in clinical trials |
分析临床失败的原因可以认为转换研究链式问题有关,分析其原因有(1)有靶点不一定能用于药物发现,有“活性”化合物不一定能成药(发现研究与比较研究有区别,“学术药物”与“新药”有区别);(2)动物疾病模型与人疾病的生物标志物的不一致性,不能预见临床的有效性和安全性;(3)动物安全性评价结果不能有效地预测药物的安全性;(4)临床试验受试者的结果不具备显著的代表性;(5)新医药产品(基因、纳米、生物技术药物)的出现还无可靠的临床前和临床评价的工具和标 准[50, 51]。将临床前研究资料过渡到临床的问题反映出提高成药性的难度。
从整合层面综合分析这些原因,在整个转化研究链上,从发现到开发的转化信息学角度,未能全面分析获得各个阶段研究中能发现与安全和有效相关的重点指标或生物标志物(图 7),或未能体现它们在其研究转化过程中作用。
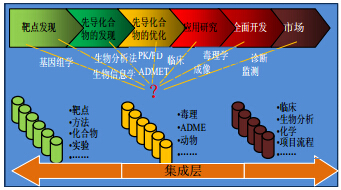 | 图 7 在整合层面的从发现到开发的转化信息学Fig. 7 Transformation from discovery to development at integration level |
还原论思维在历史上是一种巨大的进步,它克服了整体论思维的局限,开辟了打开整体向部分、微观深入的医学道路,使科学认识第一次达到了精确、严格的程度。客观事物存在着具有“组合-分解”的特性,这些方面和内容需要进行还原研究。人的整体包含着部分,人的高级运动包含着生物、化学、物理等低级运动,因而在一定范围内和一定程度上进行还原研究,以便深入认识整体、部分、微观、细胞、分子。还原论思维也存在明显的局限性:(1)“组合-分解”原理的适用范围是有限的。人虽然可以把人体分解为器官、组织、细胞,但这些部分离开人体的整体就不能单独存在和失去应用的功能。整体的功能不能分解为部分的功能,不能把“人”的整体属性、功能、行为分解为器官、组织、细胞的属性、功能、行为。(2)对于人体“原子-还原”原理的适用范围是有限的,更不能把人体高层次的功能和规律还原为低层次的功能和规律。(3)还原论思维在医学领域的适用范围是有限的。人是最典型最高级的分化系统,但人在本质上是不可分解、不可还原的。(4)还原论思维通过还原、降解,把复杂的事物简单化,而复杂现象的复杂性内容和机制是不可简化的。整体大于部分之“和”的整体特性、相互作用、功能性结构等,还原论思维无法涉及这些内容的研究。
有人认为精准医学是还原论的典型,它希望从分子水平上认识生命和疾病。但是分子水平上认识疾病仅仅是一种手段,而不是全部,发现再多的基因、蛋白、代谢物而忽视了机体整体对这些物质的调控作用,特别是机体对外源物的防御机制的影响,也是不可以的,因为所有的分子并不等于整体的生命。我们经常使用的基因动物模型,例如某个基因缺乏导致动脉硬化,采用一些治疗措施,这些治疗并不是针对这些基因的特定方法,而结果依然有效。所以基因缺陷不等于一定发生某些疾病,疾病的发生远不是分子能完全解释的。既如此,面对复杂的生命和疾病,所有还原论的论调需要慎重对待。 4.3.3 基因突变不是疾病病因和药物治疗的全部
正常组织可以存在大量突变,但以恶性突变作为精准治疗靶点是否可能值得探讨。对于恶性肿瘤的发生,基因突变尽管重要,但其突变并不是全部问题的根据,否则只需要将每个人的所有组织的基因进行序列检测,就能有足够的治疗手段了,这显然过于乐观。对于生命现象和对于疾病发生,距离完全解决问题仍然有巨大差距。
对于癌症治疗已经有许多基于基因的精准治疗的研究报道。癌症是一种基因组疾病,2007年以来基于大量分子的“新一代”DNA测序仪的出现,已开启了激动人心的个体化医疗的新纪元。Xie的研究发现基因突变在一个患者体内以及在患同一种癌症的不同患者中是相似的,但在不同的癌症类型中是截然不同的。循环肿瘤细胞(CNV)模式与癌症类型有关的发现为提供基于CNV模式进行无创癌症诊断成为可能。这些手段能够在单个分子的层面上检测、理解并改善生命过程,也为“精准医学”提供了的技术手段[52]。
目前研究最多的是基于基因组学的癌症靶向治疗,其他疾病研究成功的并不多。但对于心脑血管疾病、糖尿病等代谢性疾病、神经退行性疾病、功能性疾病仍然是人类健康领域的更大问题,对这些疾病,因为问题主要在功能层面上,采用精准的可能性小,或者根本不可能,如何实现精准治疗并不像想象那么简单。
在奥巴马的精准医学计划发布以后,有着不同的议论。认为大数据的确很重要,但是如果没有研究为基石,仅凭数据本身是难以解读的。利用基因组合其他分子信息找到药物靶标,必须从基因大数据中梳理出疾病与基因的相关性,吸纳健康基因信息并结合研究,才能提高医学和药学的服务。因此,还有很庞大的工作要去完成。如果你想要做什么都做,很可能你就会失败[53]。 4.4 在药物创新研究中如何开展精准药学 4.4.1 大数据融入精准药学研究
新药的研发在大数据时代的大背景下是否需要勇敢地面对变革,就像尝试把所有的已知事物都用数据的形式记录下来一样需要科学理智的加以应用,经过分析、滤过,才能得出结论。在新药研发过程中将图形或图像记忆转化为有关的数字记忆,直到获得最高认知度。如从药物的结构信息来判断药物的功能,甚至它的药理活性、毒理安全性、临床精准用药等一切都将被数字化的形式所代替。但是药物是千差万别的,为了改变药物的活性、代谢稳定性或者降低毒性,都有可能从不同渠道去发现。但厘清每个药物的特定的“分子指纹”与疾病基因、治疗靶点的关系,进而利用这些数据和关系为新药的诞生提供帮助的可能性有多大却难以认识。
从大量学术刊物上发现,每年都会有数以千计甚至数以万计的研究报告讨论和研究靶点-药物之间的相关性。从药物研发的观点来说,关于靶点的多维数组和药物多维数组之间的联系,现在常用对接(docking)技术来完成,而对接究竟有多少成功率,确实没有哪个新药是对接出来的。当然不能说对接是徒劳无功的。如何从大数据中获得足够多信息,至少目前还缺乏研究药物-靶点-基因组的多维数据来指导现代的新药创新研发。
有专家认为,大数据和数据分析将可能是突破创新研发瓶颈的关键。那么,大数据的优势能否集中在以下几个方面:(1)能否认识药物的生物体内过程和药物模型-疾病适应症的关联:药物的生物过程和药物模型越来越复杂,大数据可以通过利用分子和临床数据,预测建模来帮助识别那些具有很高可能性被成功开发为药物的安全有效的潜在新药。(2)能否获得某一或某几个终点指标或生物标志物预测药物的有效性,利用大数据提升临床试验的效率。在筛选临床试验受试者时可以用精准诊断来确定特定人群,从而临床试验规模更小、时间更短、成本更低,更加有效。(3)能否通过大数据分析预测新药的安全性,用大数据分析来实时地及早地发现问题,避免试验过程的延误和失败。(4)能否出现通畅数据流动,从现有的部门所有的原来僵化的数据中解放出来,形成大数据在不同功能单元间的流动,打破内部各功能之间的信息壁垒,形成合作伙伴的真正协作,而扩展知识和数据网络。(6)能否共享关键数据,企业、医生、CRO共享关键数据。对能创造商业价值的实时预测性数据进行分析非常关键。这6方面对精准药物的研发至关重要,也是不同于临床用药时的精准治疗中应用大数据的问题。但是,在商业利益驱动下的今天,大数据应用的上述6大问题难以实现。 4.4.2 学术药物向产业发展的科学问题
2012年创立的学术药物联盟,希望将学术药物推入产业药物发展[54, 55]。医药产业界希望这一新的合作模式能够帮助他们更好地利用学术界的专业知识,把“美好”的临床前设想转化为可用于患者的药物。这种企业与学术界的合作的一个关键是为患者发现创新药物和提高目前药物疗效。在严重未满足临床需要的领域,寻找创新的药品非常明确,而且价值巨大,不仅需要科学创新,还需要快速进行商业化。但是从新药研发角度来认识,学术药物的活性尚处于“学术”研究期,要成为能治疗多种癌症的新药还有漫长的路程。
最近学术药物联盟在思考学术药物向产业发展的问题。Jordan等在他们合作的文章关于“学术药物发现的再思考”中设想对如何最好地递送化合物进行评估,并转到更详细的药理学评估。认为至关重要的是提供强大的数据项目决策的能力。因此,要实现完全集成的化学信息学平台对数据进行评估。特别在早期评估时,往往充满挑战,其中包括评估是否具有足够的数据量和重现性,以及用以支持药物发现方式的生物活性和新生物目标的评估,解决其技术挑战。知道解决这些问题“能做到吗?”和“将能做到吗?”,简言之,“如果提供的药物,其研究的工作可以在临床测试吗?”。针对这些挑战,需要通过创新合作和交替使用技术来提高质量和产出效率[56]。 4.4.3 强化新药研发的关键共性技术和临床发现研究
(1)动物到人的预测 临床前治疗功效测试 临床前治疗功效测试的主要目的是预测特定化合物是否会在临床获得成功[57]。尽管某些化合物临床前试验中取得了令人鼓舞的结果,但是不幸的是大多数药物被发现在其开发后期是无效的,仅不到5%的候选化合物能进入I期临床试验[58]。如抗癌药物研究,除用了不准确的肿瘤模型,还有许多其他原因使临床前研究临床试验中不能预测出治疗活性。药效(PD)和药代(PK)的种属特异性、药物递送的差异、肿瘤的差异都可能影响其疗效。这种昂贵的不可预测的临床试验的结果,是科学家和制药企业难以接受的。
如何通过临床前研究模型提供相关治疗机制、发现潜在的药效标志物(包括生物标志物的预后和诊断端点)、脱靶活性信息、可能的耐药机制和毒性信息。能否在早期临床试验设计中采用这些临床前研究信息是非常重要的。为了做到学术研究与产业开发间紧密的合作,必需使他们之间的信息资源有利于传递,制药企业才可能有更多的资源投入到将预测的临床前试验动物模型的结果更好地用于以后临床设计中,并最终能更快和更有希望获得成功[59]。从长远来看,与在其发展的中期和后期的治疗失败相比,实际上这种成功预测临床有效性是经济的。
(2)重新定位药物及其战略 最近的研究表明,以生物信息学为基础的方法有可能厘清药物、靶点和疾病之间的复杂关系,为重新定位药物提供支持。Liu等提出了重要的生物信息学步骤,以发现有价值的重新定位方法。该步骤(有目的定位和战略定位)的目的是提供一个更新的渠道,尤其侧重于该药物的新适应症(DNI)数据库,可以促进硅片药物重新定位的提高[60](图 8)。
一般有两种方法来重新定位药物:对现有的药物发现新适应症(药物为中心的);确定对疾病发现有效的药物(疾病为中心的)[60]。以药物为中心的制药企业主要集中于候选药物在Ⅰ期临床试验中的安全性,但是由于在随后的临床试验(II期和III期)中由于疗效问题而失败了。因此这种方法很难预测如何成功,一个成功的再利用并不总是转化为市售药物。找到一个充满希望的改变用途的药品依赖于很多因素,从收益权衡考虑,如新的标志物在市场竞争和成本方面的价值有优势也是值得发展的。
以药物为中心和疾病为中心的重新定位方法的基本假设是不同的。前者推测“类似药物”具有相同的治疗效果,而后者假定“类似疾病”需要相同的治疗,因此可以用相同的药物治疗。虽然以药物为中心,以疾病为中心,影响了生物信息学方法和策略的选择,无论是遇到评估药物之间或疾病之间的“相似性”的挑战,不同的生物信息学和化学信息学方法均可以用于开发,其中包括分子与靶点对接技术以及新兴技术,如系统生物学和网络药理学。
重新定位通常是已上市药物或新药物已经临床研究基础上继续开发新适应证的临床试验中予以体现,而且开发不存在安全问题。由于这些药物的安全性特征是已知的,改变原有适应症的临床试验比较经济或快速。因此,比从头开发新药风险更少。目前的成功主要是被偶然发现或临床观察的结果,如西地那非对勃起功能障碍和肺动脉高压、沙利度胺用于麻风病和多发性骨髓瘤的治疗等新的适应症开发。
规范研发是创新成功的管理保证,这里有3个问题可以帮助确定一些基本研发和评价程序。(1)2005年FDA行业指南决策树提供了数据的提交指引到一个研究性新药申请(IND)[61]。(2)基于这种理想的药物-诊断共同开发过程的详细介绍[62](图 9)。这些在共同发展的过程中占有“真实世界”研发的实际挑战和务实的限制性。生物标志物不是研究的终点[63],在正确的时间里,以生物标志物为基础的诊断在临床中实践[64]。(3)这些问题需要在早期得到解决,并在整个的研究和转化过程。这可以抵消部分由优良实验室规范(GLP),并要遵循FDA所制定的临床和实验室标准、分析验证标准、临床实验室改进修正案和病理技术指导原则。
(3)创新合作模式,提高研发效率 医药行业面临产出效率显著下降和投入不断上升的现状,使研发预算的规模与成功率不相称。目前,行业所面临的挑战巨大,只有12%的公司还在维持运转,而其余88%已经消失或与其他组织合并。不断上升的药物开发成本迫使业界一直在探索有效的途径来获得研发预算的最佳值。中国和印度都有大量的人才储备,并能显著节省30%~80%的成本,而美国正在提供的临床前和临床服务的成本巨大。许多大型制药公司和全球性合同研究组织(CRO)已建立或正在试图在中国、印度和新加坡建立研究中心。
具有知识产权的所有权问题也是复杂的和具有挑战性的。学术研究与大型制药公司和生物技术研发机构之间的合作正呈上升趋势,以降低风险,扩大对创新候选药物的选择。根本问题与原始创新性、药物专利失效、填补某一治疗药物空白而不同。目前的药物发现过程中,全方位的创新模式需要强调共存、合作、有效地在整个药物发现的过程中和药物发现的不同阶段开发全球性的专业知识、尖端技术和多样的技能,让合作伙伴做出贡献[65](图 10)。
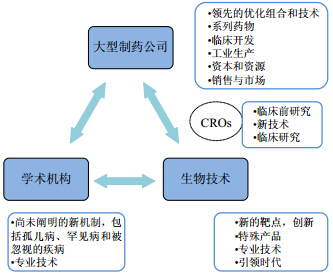 | 图 10 在药物发现中,构建制药企业、生物技术和学术研究机构的合作伙伴关系[65]Fig. 10 Partnerships with large pharma,biotech,and academic institutes in drug discovery [65] |
制药公司正在经历调整,以提高效率,增加产量。与人类疾病具有良好相关性的动物模型化合物的评价和比较分析至关重要,这对许多疾病仍然是一个障碍。为此,必须考虑以下问题:(1)在动物模型中相关的效应与具体机制可能已经研究,需要开展临床前研究以验证机制假设,但动物模型与人类疾病的转化仍然是独立不相关的,有时甚至是不可能相关的。但对于一些急性治疗药物,如抗菌疗法,动物模型与人类疾病显示出相当不错的转化关系。(2)临床前筛选(如HERG靶向筛选,基因毒性筛选,动物种属目标选择性,体内安全药理学)帮助确定了进入临床的药物质量的提高。在肿瘤晚期临床试验阶段,选择合适的生物标志物或替代终点指标,可以建立在目标的安全信心或排除在临床前筛选观察到的任何“脱靶”效应的选择可以及早消除较少有希望的候选药物。(3)许多研究证明选择的生物标志物或替代终点指标,有的仅限于药物发现早期或探索阶段。
(4)发挥药学优势,开辟药物创新途径,注重复方制剂研发 自2000年以来,虽然大分子药物的研发热度大增,但是小分子药物在开发上的精准度提高,还是能显示其优势。从以下10个小分子药物来看小分子药物是具有特点的。
吉利德的Atripla是用于治疗HIV感染的由三种核苷类逆转录酶抑制剂依发韦仑(efavirenza)、恩曲他滨(emtricitabine)和替诺福韦酯(tenofovir disoproxil fumarate)组成的复方制剂[66]。吉利德的另一种抗逆转录病毒药特鲁瓦达(Truvada)同样是一复方制剂,它由恩曲他滨和提诺福组成,是双向治疗HIV感染药物中的领先产品[67]。FDA同时批准了Truvada用来预防男同性恋在性行为中感染HIV的风险。但是其抗病毒产生的抗药性还不能 忽视。
在治疗病毒性肝炎的小分子药物中,有吉利德的治疗丙型肝炎(HCV)感染的超级药物Sovaldi/Harvoni[68]。FDA的临床数据显示其具有90%的治愈率,远远优于已经上市的药物。2014年10月FDA又批准了一个可口服的没有干扰素的、同时含有Sovaldi和ledipasvir的药物,这种药物被命名为Harvonis,服用方便,同时药效又快。ViekiraPak是艾伯维的最新的用于治疗HCV的口服药剂[69],其含有一种蛋白酶抑制剂和一个daclatasvir样的非结构蛋白5A(NS5A),外加每日服用两次的非核苷酸聚合酶。
Seretide/Advair是葛兰素史克的用于治疗哮喘和慢性阻塞性肺病的吸入剂[70]。此药物在2011年到期后有多家仿制药公司进行仿制研制。阿斯利康的Symbicort是含有福莫特罗(formoterol)和抗炎的糖皮质激素的联合药物[71],它用来治疗哮喘和慢性阻塞性肺疾病,欧洲有一些仿制药物开始出现,未来几年将会给患者较大的选择机会。
(5)临床优势发挥和多种适应症研发提供广阔用药渠道 阿斯利康的抗胆固醇药物Crestor具有比其他他汀类药物更优的特点,SATURN研究结果发现Crestor成为了当之无愧的畅销处方药[71, 72]。预计Crestor的专利到期后会受到仿制的冲击。辉瑞销售额最高的药物Lyrica,2004年7月在欧洲被批准后,2015年12月被FDA批准用来减缓由糖尿病或者挤压引起的中枢神经系统的疼痛和治疗成人部分癫痫发作以及用于治疗纤维肌肉痛。又如Tecfidera原本是一种抑菌、防潮防霉的常用工业原料,后被多发性硬化症领域的主导者Biogen Idec成功开发用于该适应症后,改变了原有的工业用途[73, 74, 75]。成为毒副作用最小,而且方便使用的新药。
Celgene的来拿度胺(Revlimid)主要用于具有5q缺失细胞遗传学异常的骨髓增生异常综合征所致的输血依赖性贫血患者的治疗。后来采用Revlimid+地塞米松联合疗法[76, 77, 78],用于既往接受过至少一种疗法的多发性骨髓瘤(MM)患者的治疗,现已获全球近70个国家批准。后来这种联合疗法已获澳大利亚和新西兰批准用于经一种疗法治疗后病情恶化的MM患者的治疗。Revlimid也已获美国、加拿大、瑞士、澳大利亚、新西兰和几个拉美国家批准用于骨髓异常综合症(MDS)导致的贫血。在美国Revlimid为批准其用于套细胞淋巴瘤(CML)治疗的首个口服药。
(6)精准数据监管的作用 以基因组学为背景的大数据是发展精准医学的基础:(1)整合不同数据层的生物学数据库,以及高度关联的知识网络是迈向精准医学的必要条件。(2)它取决于是否拥有一个大型的、多层级的、充分整合的人类疾病知识数据库。(3)以容量性、速度性、多样性、准确性、变异性、价值性(Volume,Velocity,Variety,Veracity,Variability,Value)为特点的大数据对于生物医学和健康信息学是一重大挑战。
美国FDA计划建立“精准FDA(precision FDA)”平台,为新一代测序技术开发者等提供存放、共享信息的云工具[48, 49],以推动制定必要的标准所需要的科学。精准FDA将向社会提供可以测试、试验和验证新方法的环境和平台。例如如何利用测序结果来判断一个癌症患者适不适合进行化疗?携带有某个乳腺癌突变基因的患者是否要接受预防性手术?手术后是否需要药物治疗?并最终说服FDA以证明其结果的有效性?这些都亟需通过大数据分析提供一个统一有效的管理标准。
其实早在数年前FDA就已经预见到以DNA测序为基础的分子诊断的蓬勃发展,需要FDA相应地改变管理模式,并应向美国国会申请进行相应调整。然而美国国会的一些议员担心FDA扩大职能可能会造成行政机构的权力过大并导致这些创新型诊断方法难以得到应用。而且也看到基于实验室条件下开发的分子诊断方法,经常各不相同。这也为精准临床应用造成了一系列问题。当代,分子诊断已经成为生物医药产业不可逆转的趋势。个性化诊断将使个体化精准医疗真正成为现实,因而FDA此举无疑是在这一领域的健康发展中走出有益的一步。
| [1] | Peters J R. From our perspective:The importance of the physical characteristics of generic drugs[EB/OL]. (2015-11-06)[2015-12-15].http://www.fda.gov/Drugs/NewsEvents/ucm471446.htm |
| [2] | Kantor E D, Rehm C D, Haas J S, et al. Trends in prescription drug use among adults in the United States from 1999-2012[J]. JAMA, 2015, 314(17):1818-1830. |
| [3] | Chizkov R R, Million R P. Trends in breakthrough therapy designation[J]. Nat Rev Drug Discov, 2015, 14(9):597-598. |
| [4] | Asher M A. 2013 FDA drug approvals[J]. Nat Rev Drug Discov, 2014, 13:85-89. |
| [5] | Liu C X, Constantinides P P, Li Y Z. Research and development in drug innovation:reflections from the 2013 bioeconomy conference in China, lessons learned and future perspectives[J]. Acta Pharmaceutica Sinica B, 2014, 4(2):112-119. |
| [6] | Besnard J, Ruda G F, Setola V, et al. Automated design of ligands to poly pharmacological profiles[J]. Nature, 2012, 492(7428):215-220. doi:10.1038/nature11691. |
| [7] | Biotech F. Story Roche abandons potential blockbuster cholesterol drug[EB/OL]. (2012-05-07)[2015-12-15]. http://www.fiercebiotech.com/story/roche-abandons-potential-blockbuster-cholesterol-drug/2012-05-07 |
| [8] | Eli Lilly to stop study of heart disease drug evacetrapib[EB/OL].(2015-10-12)[2015-12-15].http://www.4-traders.com/ELI-LILLY-AND-CO-13401/news/Eli-Lilly-to-stopstudy-of-heart-disease-drug-evacetrapib-21186983/ |
| [9] | Carroll J. Analysts, experts write off Merck's huge anacetrapib PhIII[EB/OL]. (2015-10-13)[2015-12-15]. http://www.fiercebiotech.com/tags/anacetrapib. |
| [10] | 石永进, 诸葛明. 辉瑞torcetrapib夭折事件的最佳借鉴[N]. 医药经济报, 2011-3-23(A11). |
| [11] | 杨涛. 默沙东治疗心脏病药物anacetrapib研究前路阻碍重重[EB/OL]. (2013-10-29)[2015-12-10]. http://www.bioon.com/industry/enterprisenews/585268.shtml |
| [12] | 毁人不倦的p38MAP激酶抑制[EB/OL]. (2015-10-29)[2015-12-10].http://www.cphi.cn/news/show-126905.html. |
| [13] | 葛兰素宣布其p38抑制剂Losmapimod在一个急性冠脉综合症的大型三期临床失败[EB/OL]. (2015-10-29)[2015-12-10].http://www.chemdrug.com/news/231/9/44079.html |
| [14] | Sharma P, Allison J P. The future of immune checkpointtherapy[J]. Science, 2015:56-61. DOI:10.1126/science.aaa8172. |
| [15] | Lesokhin A M, Callahan M K, Postow M A, et al. On being less tolerant:Enhanced cancer immunosurveillance enabled by targeting checkpoints and agonists of T cell activation[J]. Sci Transl Med, 2015:280sr1. DOI:10.1126/scitranslmed.3010274. |
| [16] | Sivan A, Corrales L, Hubert N J B, et al. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy[J]. Science, 2015. DOI:10.1126/science.aac4255. |
| [17] | Vétizou M, Pitt J M, Daillère R, et al. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota[J]. Science, 2015. DOI:10.1126/science.aad1329. |
| [18] | Leslie M. Gut microbes give anticancer treatments a boost[J]. Science, 2015. DOI:10.1126/science.aad7398. |
| [19] | Baell J, Walters M A. Chemistry:Chemical con artists foil drug discovery[J]. Nat Comment, 2014, 513,481-483. |
| [20] | Chandramouly G, McDevitt S, Sullivan K, et al. Small-molecule disruption of RAD52 rings as a mechanism for precision medicine in BRCA-deficient cancers[J]. Chem Biol, 2015, doi:10.1016/j.chembiol.2015.10.003. |
| [21] | Liu C X. Translational Research in discovery, research and development of new drugs[J]. Chongqing Med, 2010; 39(1):1-3. |
| [22] | Cook D, Brown D, Alexander R, et al. Lessons learned from the fate of AstraZeneca's drug pipeline:A five-dimensional framework[J]. Nat Rev Drug Disc, 2014, 13(6):419-431. |
| [23] | Wadman M. NIH mulls rules for validating key results[J]. Nature, 2013; doi:10.1038/500014a. |
| [24] | Freedman L P, Cockburn I M, Simcoe T S. The economics of reproducibility in preclinical research[J]. PLOS Biol, 2015, 13(6):e1002165. doi:10.1371/journal.pbio.1002165. |
| [25] | Editorial of N Eng J Med. Phagocytes and the ""bench-bedside interface""[J]. N Engl J Med, 1968, 278(18):1014-1016. |
| [26] | Sonntag K C. Implementationas of translational medicine[J]. J Transl Med, 2005, 3:33-36. |
| [27] | Hafkenschiel J H. Government regulations and the use of drugs[J]. Calif Med, 1967, 107(2):159-163. |
| [28] | Abernathy W J, Utterback J M. Patterns of industrial innovation[J]. Technol Rev, 1978, 80:40-47. |
| [29] | Choi D W. Bench to bedside:the glutamate connection[J]. Science, 1992, 258(5080):241-243. |
| [30] | Geraghty J. Adenomatous polyposis coli and translational medicine[J]. Lancet, 1996, 348(9025):422. |
| [31] | Zerhouni A Z. The NIH Roadmap[J]. Science, 2003, 302(5642):63-65. |
| [32] | Alberts B. The Art of Translation[J]. Science, 2009, 326(5950):205. |
| [33] | Food & Drug Admin. Paving the way for personalized medicine:FDA's role in a new era of medical product development[EB/OL]. (2013-10-01)[2014-10-15]. http://www.fda.gov/downloads/ScienceResearch/SpecialTopics/PersonalizedMedicine/UCM372421.pdf. |
| [34] | 倪伟波. 美生物医学""创新""首战告败[J]. 科学新闻, 2015, (6):67-69. |
| [35] | Shen B, Hwang J. The clinical utility of precision medicine:properly assessing the value of emerging diagnostic tests[J]. Clin Pharmacol Ther, 2010, 88(6):754-756. DOI:10.1038/clpt.2010.236. |
| [36] | Jackson D. Obama pushes ‘Precision Medicine Initiative’[N]. USA TODAY, 2015-1-30. |
| [37] | Garay J P, Gray J W. Omics and therapy-a basis for precision medicine[J]. Mol Oncol, 2012, 6(2):128-139. DOI:10.1016/j.molonc.2012.02.009. |
| [38] | Coops W J. Precision of dosage[J]. Tijdschr Diergeneeskd, 1986, 111(2):91. |
| [39] | Leff R D, Yang G Z. Big data for precision medicine[J]. Engineering, 2015, 1(3):277-278. |
| [40] | Sen B, Peng S, Tang X, et al. Kinase-impaired BRAF mutations in lung cancer confer sensitivity to dasatinib[J]. Sci Transl Med, 2012, 4(136):136ra70. |
| [41] | Watanabe T, Kobunai T, Akiyoshi T, et al. Prediction of response to preoperative chemoradiotherapy in rectal cancer by using reverse transcriptase polymerase chain reaction analysis of four genes[J]. Dis Colon Rectum, 2014, 57(1):23-31. |
| [42] | Xie H G, Frueh F W. Pharmacogenomics steps toward personalized medicine[J]. Pers Med, 2005, 2(4):325-337. DOI:10.2217/17410541.2.4.325. |
| [43] | Goetz M P, Knox S K, Suman V J, et al. The impact of cytochrome P4502D6 metabolism in women receiving adjuvant tamoxifen[J]. Breast Cancer Res Tr, 2007, 101(1):113-121. |
| [44] | Weinstein J N, Collisson E A, Mills G B, et al. The Cancer Genome Atlas Pan-Cancer analysis project[J]. Nat Genet, 2013, 45(10):1113-1120. |
| [45] | Barretina J, Caponigro G, Stransky N, et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity[J]. Nature, 2012, 483(7391):603-607. |
| [46] | Garnett M J, Edelman E J, Heidorn S J, et al. Systematic identification of genomic markers of drug sensitivity in cancer cells[J]. Nature, 2012, 483(7391):570-575. |
| [47] | Xie X S. Single molecules meet genomics:pinpointing precision medicine[J]. JAMA, 2015, 313(20):2021-2022. DOI:10.1001/jama.2015.5533. |
| [48] | Drugs Trump Tech As Investors Shift Earnings Bets To Healthcare. DNAnexus to deliver precision FDA[EB/OL].(2015-08-06)[2015-10-12].http://www.biospace.com/News/dnanexus-to-deliver-precisionfda/387176/ |
| [49] | Kass-Hout T A, Litwack D. Advancing precision medicine by enabling a collaborative informatics community[EB/OL]. (2015-08-05)[2015-12-10]. http://www.hitechanswers.net/advancing-precision-medicine-by-enabling-a-collaborative-informatics-community/ |
| [50] | Baell J, Walters M A. Chemistry:Chemical con artists foil drug discovery[J]. Nat Comment, 2014, 513:481-483. |
| [51] | 姜天锡. 百万人的超级研究?![J]. 科学新闻, 2015, (500):77-79. |
| [52] | Frye S, Crosby M D, Edwards T P, et al. US academic drug discovery[J]. Nat Rev Drug Discov, 2011, 10, 409-410. |
| [53] | Tralau-Stewart C, Low C M R, Marlin N. UK academic drug discovery[J]. Nat Rev Drug Discov, 2014, 13, 15-16. |
| [54] | Jordan A M, Waddell I D, Ogilvie D J. Rethinking ‘academic’ drug discovery:the Manchester Institute perspective[J]. Drug Discov Today, 2015, 20(5):525-535. |
| [55] | Hingorani S R, Petricoin E F, Maitra A, et al. Preinvasive and invasive ductal pancreatic cancer and its early detection in the mouse[J]. Cancer Cell, 2003, 4:437-450. |
| [56] | Roberts T G, Goulart B H, Squitieri L, et al. Trends in the risks and benefits to patients with cancer participating in phase 1 clinical trials[J]. JAMA, 2004, 292:2130-2140. |
| [57] | Cook N, Jodrell D I, Tuveson D A. Predictive in vivo animal models and translation to clinical trials[J]. Drug Discov Today, 2012,17(5/6):253-260. |
| [58] | Liu Z C, Fang H, Reagan K, et al. In silico drug repositioning-what we need to know[J/OL]. Drug Discov Today, 2012, http://dx.doi.org/10.1016/j.drudis.2012.08.005. |
| [59] | Mullard A. 2010 FDA drug approvals[J]. Nat Rev Drug Discov, 2011, 10:82-85. |
| [60] | Kunsten L J S. Drug discovery management, small is beautiful:why a number of companies get it wrong?[J]. Drug Discov Today, 2011, 16:476-484. |
| [61] | Nohaile M. The biomarker is not the end[J]. Drug Discov Today, 2012, 17(19/20):676-883. |
| [62] | Philip R. US FDA perspective on challenges in co-developing in vitro companion diagnostics and targeted cancer therapeutics[J]. Bioanalysis, 2011, 3, 383-389. |
| [63] | Khanna I. Drug discovery in pharmaceutical industry:productivity challenges and trends[J]. Drug Discov Today, 2012, 17(19/20):1088-1102. |
| [64] | Kabbara W K, Ramadan W H. Emtricitabine/rilpivirine/tenofovir disoproxil fumarate for the treatment of HIV-1 infection in adults[J]. J Infect Public Health, 2015, 8(5):409-417. |
| [65] | Laufer F N, O'Connell D A, Feldman I, et al. Vital signs:Increased medicaid prescriptions for preexposure prophylaxis against HIV infection-New York, 2012-2015[J]. MMWR Morb Mortal Wkly Rep, 2015, 64(46):1296-1301. |
| [66] | Mullins C, Gibson W, Klibanov O M. Harvoni (ledipasvir and?sofosbuvir) for hepatitis C[J]. Nurse Pract, 2015, 40(11):22-26. |
| [67] | Raedler L A. Viekira Pak (Ombitasvir, Paritaprevir, and Ritonavir Tablets; Dasabuvir Tablets):All-oral fixed combination approved for genotype 1 Chronic Hepatitis C infection[J]. Am Health Drug Benefits, 2015, 8(Spec Feature):142-147. |
| [68] | McKeage K, Keam S J. Salmeterol/fluticasone propionate:a review of its use in asthma[J]. Drugs, 2009, 69(13):1799-1828. |
| [69] | Pilcher J, Shirtcliffe P, Patel M, et al. Three-month validation of a turbuhaler electronic monitoring device:implications for asthma clinical trial use[J]. BMJ Open Respir Res, 2015, 2(1):e000097. |
| [70] | Pandit A K, Kumar P, Kumar A, et al. High-dose statin therapy and risk of intracerebral hemorrhage:a meta-analysis[J]. Acta Neurol Scand, 2015. DOI:10.1111/ane.12540. |
| [71] | BG 12:BG 00012, BG 12/Oral Fumarate, FAG-201, second-generation fumarate derivative-Fumapharm/BiogenIdec[J]. Drugs R D, 2005, 6(4):229-30. |
| [72] | Wakkee M, Thio H B. Drug evaluation:BG-12, an immunomodulatory dimethylfumarate[J]. Curr Opin Investig Drugs, 2007, 8(11):955-962. |
| [73] | Zhao W, Zhao S P. Different effects of statins on induction of diabetes mellitus:an experimental study[J]. Drug Des Devel Ther, 2015, 9:6211-6223. |
| [74] | Torkildsen Ø, Myhr K M, Bø L. Disease-modifying treatments for multiple sclerosis-a review of approved medications[J]. Eur J Neurol, 2016, 23(Suppl 1):18-27. DOI:10.1111/ene.12883. |
| [75] | Longbrake E E, Naismith R T, Parks B J, et al. Dimethyl fumarate-associated lymphopenia:Risk factors and clinical significance[J]. Mult Scler J Exp Transl Clin, 2015, 1. pii:2055217315596994. |
| [76] | Coles A. Newer therapies for multiple sclerosis[J]. Ann Indian Acad Neurol, 2015, 18(Suppl 1):S30-34. |
 2016, Vol. 39
2016, Vol. 39