2. 北京天广实生物技术股份有限公司, 北京 101111
2. Mabworks Biotech Co. Ltd. Beijing 101111, China
乳腺癌是最主要威胁妇女健康的恶性肿瘤之一,目前成为45~55岁年龄段妇女的主要死亡原因[1]。按照WHO统计报道,2011年死于乳腺癌患者高达50.8万,且多数病例来自发展中和不发达国家[2],因此对于女性乳腺癌的预防和治疗越来越引起人们重视。
研究表明一种人表皮生长因子受体家族成员—HER2的过度表达或增殖与乳腺癌患者预后密切相关,25%~30%的乳腺癌患者体内HER2过度表达,从而增加了癌细胞的转移能力,导致这些患者的预后明显差于HER2低表达的患者[1, 3, 4]。
近些年随着现代肿瘤治疗领域的突破性进展,研究人员研制了针对肿瘤细胞内某一蛋白质的分子,某一核酸的片段或者某一基因产物进行的治疗,即分子靶向治疗技术[3]。大量的临床研究已证实了抗HER2人源化抗体在治疗HER2阳性乳腺癌患者的安全性和疗效,尤其与化疗药物联合使用时可显著延长乳腺癌患者的生存期,改善生活质量,具有明显的临床疗效[5,6]。在国外已批准上市了二种抗HER2单抗——曲妥珠单抗和帕妥珠单抗。但这些进口药物价格非常高,持续几个月的疗程费用可高达十万美元之多,其过高的成本严重阻碍了在发展中和不发达国家的广泛应用。
目前也有一些国内生物技术药物厂家正在研发抗HER2人源化抗体,并取得良好的进展。为了充分考察治疗性单克隆抗体的临床前安全性,本研究对食蟹猴单次iv国产抗HER2人源化抗体进行急性毒性研究,观察毒性反应及严重程度、主要毒性靶器官,从而为后续重复给药毒性研究剂量设计和主要观察指标提供参考。
1 材料与方法 1.1 供试品抗HER2人源化抗体(批号M20120701)和溶媒对照品(含120 mmol/L蔗糖,0.02% Tween20,20 mmol/L组氨酸-乙酸缓冲溶液,pH 6.0)均由北京天广实生物技术股份有限公司制造提供,放置2~8 ℃保存。
1.2 主要试剂及仪器血清生化检测试剂均购自北京中生生物工程公司;MINI AM4290尿分析仪购自日本京都第一科学株式会社;ADVIA 120血液学分析仪和Rapidchem744电解质分析仪均购自德国拜耳公司;7060型全自动生化分析仪购自日本日立公司。
1.3 实验动物及饲养条件8只2~3岁普通级食蟹猴(雌雄各半,雌性2.00~2.20 kg,雄性1.95~2.50 kg)购自广东省肇庆创药生物科技有限公司(实验动物许可证号:SCXK粤2007-0016);动物金属笼单笼饲养。饲养房间温度16~26 ℃,湿度40%~70%,换气次数8~10次/h,12 h照明,每天定量给食,自由摄食(饲养环境许可证号:SYXK京2011-0037)。
1.4 实验设计食蟹猴经过15 d检疫驯化后按体质量随机分成4组,每组2只(雌雄各半),分别为溶媒对照和抗HER2人源化抗体75、150、250 mg/kg组。模拟临床给药途径,采用注射泵静脉缓慢推注,输液速度10 mL/min,即150 mg/min,输液速度高于临床给药速度以暴露给药过程中供试品可能引起的毒性反应。给予溶媒对照组动物与250 mg/kg组等体积的溶媒对照品。
1.5 各项毒理学指标观察与检测在整个研究期间,每天观察动物外观体征、行为活动及精神状况等,并对摄食量进行估测;在动物分组日、给药日与解剖日测定体质量;于检疫驯化期及给药前、给药结束后即刻、给药后2 h以及给药第2、7、14天,进行心电图及血压测定;在给药前(检疫期内)以及给药第2、7、14天,经前臂静脉采血进行血液学、血清生化检查。给药后第15天,解剖各组动物,进行大体病理学与组织病理学检查。
1.6 统计学分析采用SPSS 13.0软件,进行单因素方差分析。
2 结果在整个实验期间,溶媒对照组与不同剂量给药组的动物均未见出现任何异常临床症状。各组动物的每天摄食量也未发现异常。体质量测定结果显示每组动物的体质量在研究期间略有增加(图 1),与溶媒对照组比较,给药后不同剂量给药组体质量的变化均无显著性差异。与检疫期的测定结果比较,给药前后对动物体温、血压、心电图参数均无明显影响。
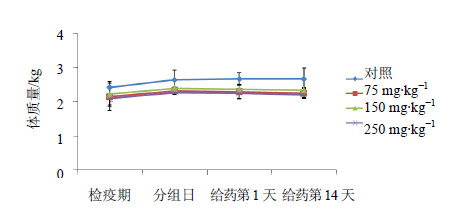 | 图 1 食蟹猴iv给药后对动物体质量的影响 Fig. 1 Effect of iv administration on body weight of cynomolgus monkeys |
各只动物血液学检查结果显示,与同组的检疫期以及溶媒对照组结果相比较,各项指标未见明显改变。血清生化分析结果发现150 mg/kg组与250 mg/kg组动物给药后第2天血清IgG与检疫期相比略有升高(图 2),但未达到统计学差异(P=0.15和P=0.26)。随后逐渐降低,至给药后第14天血清IgG水平恢复至检疫期水平。
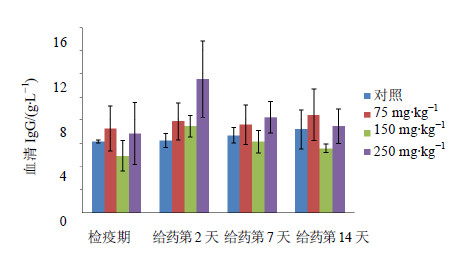 | 图 2 食蟹猴静脉注射给药后对动物血清IgG水平的影响Fig. 2 Effectof iv administration on serum IgG level of cynomolgus monkeys |
各组动物于给药第15天进行剖检,大体病理学检查均未见任何改变。
3 讨论本研究供试品为人源化单克隆抗体,由于与啮齿类动物存在一定的种属特异性,因此,最适合的动物模型局限于非人灵长类动物。在研究中选用的食蟹猴是与人同属于灵长类,基因同源性较高,免疫学反应有很多的相似性,且国内外背景资料丰富,为一般毒性研究最常用的非人灵长类动物。
根据该供试品的前期研究资料显示,该药物与帕妥珠单抗在结构、理化特性及作用靶点更为相似,帕妥珠单抗临床首次给药最大剂量为840 mg/人。在重复给药毒性研究中分别给予食蟹猴15、50、150 mg/kg帕妥珠单抗,每周给药1次,连续给药7周,未见与帕妥珠单抗相关的动物死亡,给药相关的毒性主要为动物腹泻[7]。在本研究中为考察动物单次给予较大剂量的抗HER2单抗的急性毒性反应及动物耐受程度,同时也为长期毒性实验及Ⅰ期临床试验剂量提供参考,设定了3个不同的给药剂量,分别为75、150、250 mg/kg。按体质量折算(成人体质量按60 kg、猴体质量按3 kg计),分别约为临床拟用最高剂量的5.4、10.7和17.9倍;按体表面积折算,分别约为临床拟用最高剂量的2.2、4.3、7.2倍。
食蟹猴在接受不同剂量供试品iv给药后,整个实验期间,各组动物的临床症状、体质量、摄食量、心电图、血压和血液学均未见明显异常。仅150 mg/kg组与250 mg/kg组动物血清IgG的轻微升高呈现一定剂量相关性,由于本实验供试品为抗HER2人源化抗体,本身属于IgG抗体蛋白分子,食蟹猴给予本供试品的药代、毒代测定结果表明,动物给药后血浆中HER2单抗的血药浓度基本在给药后2 h达到最高,随着采血时间的延长血药浓度逐渐下降。本实验中血清IgG在给药第2、7、14天的变化与血浆中HER2单抗血药浓度变化趋势一致,因此认为给药后血药浓度的升高导致了血清IgG水平的升高,随后逐渐消减。
综上所述,食蟹猴单次静脉注射抗HER2人源化单克隆抗体的总体耐受性良好,在最高剂量250 mg/kg时,未见明显毒性反应,这些研究结果为进一步临床前评价抗HER2人源化单克隆抗体的安全性奠定了基础。
| [1] | Cimino-Mathews A, Foote J B, Emens L A. Immune targeting in breast cancer [J]. Oncology (Williston Park), 2015, 29(5): 375-385. |
| [2] | WHO. Breast cancer: prevention and control. [EB/OL].[2015-08-23]http://www.who.int/cancer/detection/breastc ancer/en/index1.html.. |
| [3] | Huang Y, Fu P, Fan W. Novel targeted therapies to overcome trastuzumab resistance in HER2- overexpressing metastatic breast cancer [J]. Curr Drug Targets, 2013, 14(8): 889-898. |
| [4] | Candas D, Lu C L, Fan M, et al. Mitochondrial MKP1 is a target for therapy-resistant HER2-positive breast cancer cells [J]. Cancer Res, 2014, 74(24): 7498-7509. |
| [5] | Mavroudis D, Saloustros E, Malamos N, et al. Six versus 12 months of adjuvant trastuzumab in combination with dose-dense chemotherapy for women with HER2-positive breast cancer: a multicenter randomized study by the Hellenic Oncology Research Group (HORG) [J]. Ann Oncol, 2015, 26(7): 1333-1340. |
| [6] | Swain S M, Baselga J, Kim S B, et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer [J]. N Engl J Med, 2015, 372(8): 724-734. |
| [7] | FDA. Drug [EB/OL]. [2015-08-23]. http://www.accessdata.fda.gov/drugsatfda_docs/label/2013/125409s 051lbl.pdf. |
 2015, Vol. 38
2015, Vol. 38


