2. 四川省医学科学院·四川省人民医院, 四川 成都 610072
2. Sichuan Provincial People's Hospital, Chengdu 610072, China
半夏泻心汤出自医圣张仲景的《伤寒杂病论》,全方由辛开之半夏、干姜,苦降之黄芩、黄连,甘补之人参、甘草、大枣组成,具有平调寒热、消痞散结的功效,主治寒热错杂之痞证,临床上多用治疗胃肠运动功能障碍性消化系统疾病[1,2,3]。研究已证实Cajal间质细胞(ICC)与许多胃肠动力障碍性疾病有关,ICC分布和功能的异常可能是胃肠道动力不良疾病的重要病因。因此研究半夏泻心汤与ICC的关系对于阐明半夏泻心汤调节胃肠动力的作用机制具有重大的意义。
Sheiner等[4]于1979年提出的药动学(PK)-药效学(PD)结合模型能较客观地阐明“血药浓度-效应-时间”之间的三维关系。将PK-PD结合模型应用于中药研究,对阐明中药的物质基础、作用机制及二者之间的关系具有重要意义。本课题组前期研究结果表示,半夏泻心汤有效药物组分主要为苦降药组[5,6]。本实验在前期研究基础上,从ICC的角度出发,利用PK-PD结合模型,初步探讨半夏泻心汤全方药组及苦降药组促进胃肠动力的物质基础、部分作用机制及两者之间的关系。
1 材料 1.1 试剂与仪器ZQ2000-LC-MS分析仪(美国Waters公司);XH-B型旋涡混合器(姜堰市康健医疗器具有限公司);KQ-500DB型数控超声波清洗器(昆山市超声仪器有限公司);MODEL-3旋转蒸发器(上海医械专机厂);循环水真空泵(北京中兴伟业仪器有限公司);电子天平PA2003(上海天平仪器厂); Millipore纯水仪;SW-CJ-1F1662型超净工作台(苏州安泰空气技术有限公司);相差倒置显微镜(Germany,Leica);MCO-15A型CO2培养箱(JAPAN,SANYO);Varioskan TM型酶标仪(美国ThermoFisher);MLS-3020型高压蒸汽灭菌锅(日本三洋);SHHW21-600型恒温水浴箱(天津市泰斯特仪器有限公司)。
盐酸小檗碱、盐酸巴马汀、黄芩苷、黄芩素、卡马西平对照品均购于中国食品药品检定研究院;Ca试剂盒、ATP酶试剂盒均购自南京建成生物工程研究所;(Kit/SI/CD117)ELISA KIT购自Cusabio公司。
1.2 药物法半夏、干姜、黄芩、黄连、党参、炙甘草、大枣均为《中国药典》品种,均购于四川新荷花中药饮片有限公司,实验前由成都中医药大学药用植物学与中药鉴定教研室严铸云教授鉴定。
1.3 动物SD大鼠,雌雄各半,体质量220~240 g,用于含药血清的采集;SPF级KM小鼠,雌雄不拘,出生12~15 d,用于ICC的分离、培养。均由成都中医药大学实验动物中心提供,生产许可证号:SCXK(川)2008-11。
2 方法 2.1 样品制备 2.1.1 半夏泻心汤水提醇沉液的制备法半夏120 g、干姜90 g、黄芩90 g、黄连30 g、人参90 g、炙甘草90 g、大枣40枚,以20倍量水浸泡60 min,煮沸后煎煮40 min,过滤,再加20倍量水,煎煮40 min,过滤,合并两次滤液,加95%食用乙醇,使含醇量达到70%,静置24 h,过滤,滤液回收乙醇,然后浓缩至相当于每毫升含0.24 g黄芩的半夏泻心汤水提醇沉液。
2.1.2 苦降药组水提醇沉液的制备黄芩90 g、黄连30 g,制备方法同2.1.1。
2.2 分组与血样采集将实验分为全方组与苦降药组,两组各取90只SD大鼠随机分为15个小组,每组6只,禁食不禁水12 h,分别ig半夏泻心汤及苦降药组水提醇沉液,给药体积为10 mL/kg。各组均于给药前(0 h)及给药后0.083、0.167、0.25、0.333、0.5、0.75、1、1.5、2、3、4、6、9、24 h股静脉采取全血,静置24 h,3 500 r/min离心10 min,分离血清,备用。
2.3 色谱及质谱检测条件色谱柱为Phenomenex Gemini C18 110A(100 mm×2.00 mm,5 μm);流动相为乙腈(A)-0.3%甲酸水(B);梯度洗脱:0~20 min,20%~75%(A);20~30 min,75%(A);30~35 min,75%~20%(A);35~40 min,20%(A);进样量10 μL;柱温30 ℃;体积流量 0.2 mL/min;ESI正离子模式;毛细管电压3.75 kV;小檗碱、巴马汀、黄芩苷、黄芩素、卡马西平的锥孔电压分别为39、35、29、53、33 V;二级锥孔电压1 V;六级杆透镜电压0.5 V;ESI源温度120 ℃;脱溶剂气温300 ℃;脱溶剂气体积流量750 L/h;锥孔气体积流量30 L/h。定量的SIR检测的分子离子峰为:巴马汀(m/z 352.31)、黄芩苷(m/z 446.92)、小檗碱(m/z 336.23)、黄芩素(m/z 271.09)、卡马西平(m/z 259.05)。
2.4 药动学研究按照上述建立的LC-MS方法检测半夏泻心汤及苦降药组血清中黄芩苷、黄芩素、小檗碱、巴马汀的浓度。
2.5 ICC的体外分离培养、鉴定参照文献[7, 8, 9]采用酶解法结合密度梯度离心法进行小肠ICC的体外分离培养,鉴定。
2.5.1 ICC的体外分离培养 取出生后12~15 d的KM小鼠禁食12 h后,无菌的条件下,取距离回盲部5~8 cm的小肠,放入生理盐水(青霉素-链霉素溶液100×、两性霉素B 0.25 mg/mL)的培养皿中,仔细剥离小肠系膜及血管,用无菌注射器反复冲洗小肠内容物,眼科剪剖开小肠,载玻片刮除小肠黏膜层,冲洗肌条3~4次,沥干后将肌条剪碎至1~2 mm3,移入含10 mL的Ⅱ型胶原酶溶液(1.3 mg/mL)的玻璃瓶中,37℃培养箱中消化30 min,期间取出吹打1次,消化结束之后用DMEM培养基稀释消化酶,将含细胞的滤液移入15 mL离心管,1 500 r/min离心3 min去上清液,重悬细胞,用巴氏吸管反复吹打后用200目筛网滤除大块组织,将细胞悬液缓慢加入等体积小鼠淋巴细胞分离液中,1 500 r/min离心5 min,取液面交界细胞。
用DMEM高糖培养基(含15% FBS,青霉素-链霉素溶液100×、SCF 5 ng/mL),将细胞浓度调整至1×106/mL,接种到培养板内,在37℃,5%CO2的培养箱中培养。
细胞培养24 h之后首次换液,冲去未贴壁细胞,加入培养基继续培养,以后2~3 d换液1次,期间在相差倒置显微镜下观察细胞生长情况。
2.5.2 ICC免疫荧光学鉴定 将细胞悬液接种至培养瓶内,待细胞稳定培养后进行免疫荧光学检测。弃去培养瓶内的培养基,50%丙酮在室温下固定10 min,0.01 mol/L的磷酸缓冲液(PBS)清洗3次,每次3 min,10%山羊封闭血清室温下作用30 min,加入c-kit单克隆抗体(1:100),4℃过夜,再加入羊抗大鼠FITC标记的二抗(1:150),室温作用l h,PBS冲洗3次,每次3 min,用50%甘油封片;荧光显微镜下观察细胞。
2.6 药效学指标的检测将半夏泻心汤及苦降药组各个时间点的含药血清分别作用于ICC,严格按照试剂盒说明书操作,采用ELISA法检测KIT蛋白、Ca2+及ATP酶的水平。
2.7 PK-PD模型的建立采用不同时间点大鼠血清中黄芩苷、黄芩素、小檗碱、巴马汀的浓度,与相应时间点ICC中KIT蛋白水平、Ca2+浓度及ATP酶的水平,进行PK-PD模型拟合。PK-PD模型拟合采用Winnonlin软件进行分析。以AIC为主要拟合优度参数比较各模型优度,选取最终用于联结的PK模型和PD模型。
3 结果 3.1 药动学结果灌胃半夏泻心汤及苦降药组水提醇沉液后,以非房室模型计算相应的药动学参数。苦降药组中黄芩苷、黄芩素、小檗碱、巴马汀在大鼠体内的AUC(0-∞)较半夏泻心汤均不同程度的下降,其中,黄芩素在大鼠体内的AUC(0-∞)较半夏泻心汤下降差异显著(P<0.01)。苦降药组中黄芩苷、小檗碱、巴马汀在大鼠体内的Cmax较半夏泻心汤均不同程度的下降,其中小檗碱、巴马汀下降差异显著(P<0.01)。苦降药组中黄芩苷、小檗碱、巴马汀在大鼠体内的tmax与半夏泻心汤相同,黄芩素有缩短,差异不显著。苦降药组中黄芩苷、黄芩素、巴马汀的t1/2z在大鼠体内较半夏泻心汤均不同程度的缩短,其中黄芩素缩短差异显著(P<0.01)。见表 1。
| 表 1 半夏泻心汤及其苦降药组中黄芩苷、黄芩素、小檗碱、巴马汀的PK参数比较 Table 1 Comparison on pharmacokinetic parameters of baicalin,baicalein,berberine,and palmatine in BXD and its bitter medicine groups |
给予半夏泻心汤及苦降药组含药血清后,不同时间点ICC中KIT蛋白均有不同程度的升高趋势,但与0 h比较,差异不显著;不同时间点ICC中Ca2+均有不同程度的下降趋势,与0 h比较,差异显著(P<0.01);不同时间点ICC中ATP酶均有不同程度的升高趋势,与0 h比较,差异显著(P<0.05)。通过对半夏泻心汤及其苦降药组上调ATP酶的各个时间点之间的比较,发现0.083、0.167、0.25、0.333、0.75、1、1.5、2、3、4、6、9、24 h的ATP酶有显著性差异(P<0.05),半夏泻心汤及其苦降药组对KIT蛋白、Ca2+浓度的效应各个时间点之间均无显著性的差异。结果见图 1、2。
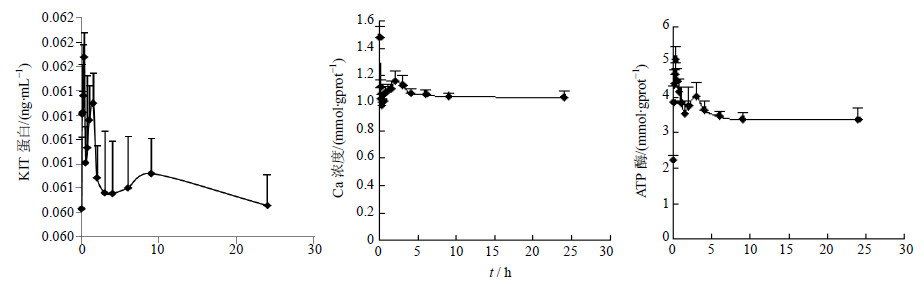 | 图 1 半夏泻心汤对ICC中KIT蛋白、Ca2+浓度、ATP酶的效应-时间曲线Fig. 1 Effect-time curves of BXD on KIT protein,Ca2+ concentration,and ATP enzyme in ICC |
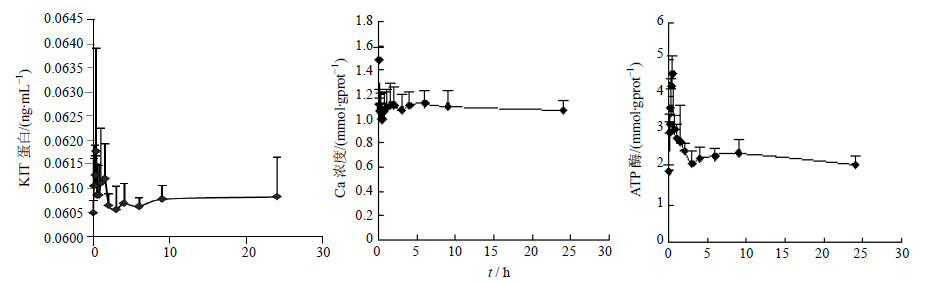 | 图 2 苦降药组对ICC中kit蛋白、Ca2+浓度、ATP酶的效应-时间曲线Fig. 2 Effect-time curves of bitter medicine on KIT protein,Ca2+ concentration,and ATP enzyme in ICC |
根据PK及PD数据的拟合结果,巴马汀选择Sigmoid Imax模型与三房室的PK模型进行连接,小檗碱、黄芩素选择Sigmoid Imax模型与二房室的PK模型进行连接。巴马汀、小檗碱、黄芩素PK-PD模型的AIC值分别为−41.869、−45.853、−41.387;模型拟合较优,拟合参数见表 2。以巴马汀、小檗碱、黄芩素血药浓度为X轴,以Ca2+浓度变化为Y轴,建立血药浓度-效应曲线,可见给药后Ca2+浓度变化与巴马汀、小檗碱、黄芩素的浓度之间呈现出明显的滞后曲线,结果见图 3。
| 表 2 巴马汀、小檗碱、黄芩素与Ca2+浓度PK-PD模型参数 Table 2 PK-PD model parameters of palmatine,berberine,and baicalein with Ca2+ concentration |
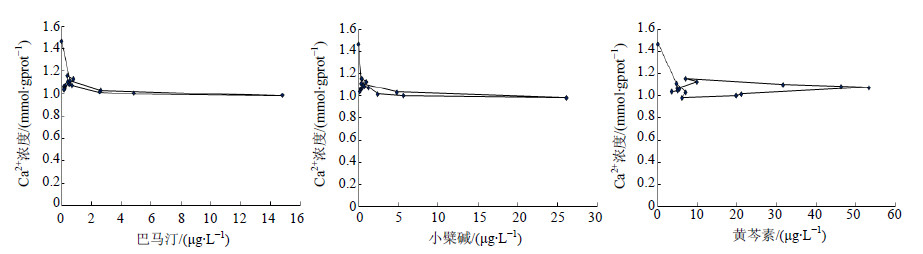 | 图 3 半夏泻心汤组巴马汀、小檗碱、黄芩素与Ca2+浓度的效应-浓度曲线Fig. 3 Effect-concentration curve of palmatine,berberine and baicalein with ATP enzyme |
根据PK及PD数据的拟合结果,巴马汀选择Sigmoid Emax模型与三房室的PK模型进行连接,小檗碱、黄芩素选择Sigmoid Emax模型与二房室的PK模型进行连接。巴马汀、小檗碱、黄芩素PK-PD模型的AIC值分别为5.707、13.027、21.283,拟合参数见表 3。以巴马汀、小檗碱、黄芩素血药浓度为X轴,以ATP酶变化为Y轴,建立血药浓度-效应曲线,可见给药后ATP酶水平变化与巴马汀、小檗碱、黄芩素的浓度之间呈现出明显的滞后曲线,结果见图 4。
| 表 3 巴马汀、小檗碱、黄芩素与ATP酶PK-PD模型参数 Table 3 PK-PDmodelparameters of palmatine,berberine,and baicalein with ATP enzyme |
 | 图 4 半夏泻心汤组巴马汀、小檗碱、黄芩素与ATP酶的效应-浓度曲线Fig. 4 Effect-concentration curve of palmatine,berberine and baicalein with ATP enzyme |
根据PK及PD数据的拟合结果,巴马汀选择Sigmoid Imax模型与三房室的PK模型进行连接,小檗碱、黄芩素选择Sigmoid Imax模型与二房室的PK模型进行连接。巴马汀、小檗碱、黄芩素PK-PD模型的AIC值分别为−25.156、−24.934、−47.660。模型拟合较优,拟合参数见表 4。以巴马汀、小檗碱、黄芩素血药浓度为X轴,以Ca2+浓度变化为Y轴,建立血药浓度-效应曲线,可见给药后Ca2+浓度变化与巴马汀、小檗碱、黄芩素的浓度之间呈现出明显的滞后曲线,结果见图 5。
| 表 4 巴马汀、小檗碱、黄芩素与Ca2+浓度PK-PD模型参数 Table 4 PK-PDmodelparameters of palmatine,berberine,and baicalein with Ca2+ concentration |
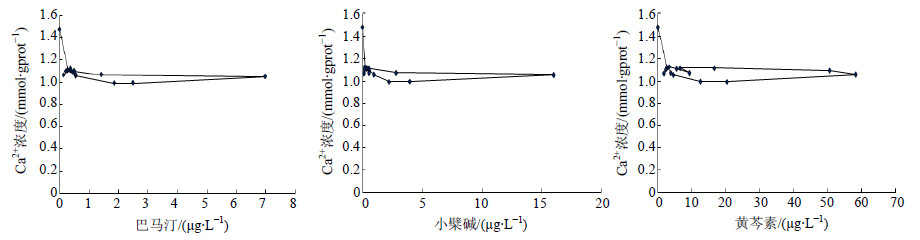 | 图 5 苦降药组巴马汀、小檗碱、黄芩素与Ca2+浓度的效应-浓度曲线Fig. 5 Effect-concentration curves of palmatine,berberine,and baicalein with Ca2+ concentration |
根据PK及PD数据的拟合结果,巴马汀选择Sigmoid Emax模型与三房室的PK 模型进行连接,小檗碱、黄芩素选择Sigmoid Emax模型与二房室的PK模型进行连接。巴马汀、小檗碱、黄芩素PK-PD模型的AIC值分别为15.776、21.008、37.985。拟合参数见表 5。以巴马汀、小檗碱、黄芩素血药浓度为X轴,以ATP酶变化为Y轴,建立血药浓度-效应曲线,可见给药后ATP酶水平变化与巴马汀、小檗碱、黄芩素的浓度之间呈现出明显的滞后曲线,结果见图 6。
| 表 5 巴马汀、小檗碱、黄芩素与ATP酶PK-PD模型参数 Table 5 PK-PD model parameters of palmatine,berberine,and baicalein with ATP enzyme |
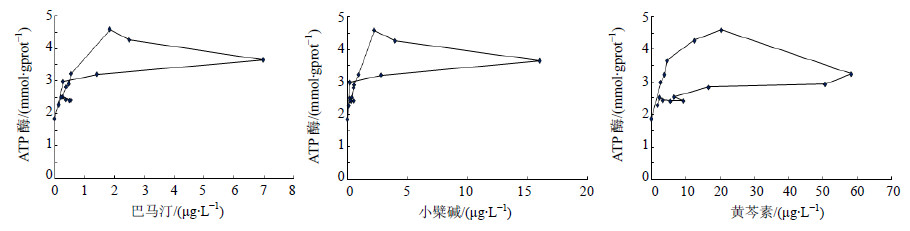 | 图 6 苦降药组巴马汀、小檗碱、黄芩素与ATP酶的效应-浓度曲线Fig. 6 Effect-concentration curves of palmatine,berberine,and baicalein with ATP enzyme |
半夏泻心汤出自《伤寒论》,系汉代张仲景的名方,现代医学主要用于治疗胃肠动力障碍性疾病,如反流性食管炎、胃炎,慢性胃炎合并胃、十二指肠溃疡,功能性消化不良等,且疗效确切。ICC是胃肠电节律活动产生的基础,是慢波的起搏点,有传递电兴奋和调节神经递质生物作用。国内外研究发现,ICC的减少或功能改变可能是导致糖尿病胃轻瘫的原因之一[10]。Streutkerc认为ICC缺失是假性肠梗阻发生的原因[11]。Jain等[12]发现慢性假性肠梗阻患者小肠壁c-kit阳性ICC消失。目前研究发现慢传输型便秘患者结肠ICC数量减少,其网络结构也被破坏;乙状结肠c-kit mRNA表达和KIT蛋白表达均明显降低[13]。因此,ICC作为胃肠动力研究的靶细胞具有重要意义,通过体外培养原代ICC,可以更好排除体内神经体液因素的干扰,且实验因素可控,影响因素单一,可最大程度保持ICC原有特性,是研究细胞功能以及相应细胞信号转导机制的基础。
药动学结果显示,苦降药组中黄芩苷、黄芩素、小檗碱、巴马汀在大鼠体内的AUC (0-∞)较半夏泻心汤均不同程度的下降,苦降药组中黄芩苷、小檗碱、巴马汀在大鼠体内的Cmax较半夏泻心汤均不同程度的下降,苦降药组中黄芩苷、黄芩素、巴马汀的t1/2z在大鼠体内较半夏泻心汤均不同程度的缩短。结果表明,半夏泻心汤中黄芩苷、黄芩素、小檗碱、巴马汀在正常大鼠体内的代谢与苦降药组比较,体现出全方的配伍优势。
在本实验中,在给予半夏泻心汤及苦降药组含药血清后,不同时间ICC中KIT蛋白差异无统计学意义。结果表明,在正常的胃肠动力情况下,半夏泻心汤及苦降药组对ICC中KIT蛋白的水平无显著影响。在给予半夏泻心汤及苦降药组含药血清后,监测到ICC细胞内Ca2+浓度降低,提示在给予半夏泻心汤及苦降药组血清后,细胞内Ca2+浓度降低从而通过抑制ICC钙超载,一方面抑制细胞损伤和凋亡,另一方面通过促进ICC起搏电流的产生和向平滑肌细胞传递信号,从而防治胃肠运动障碍。在给予半夏泻心汤及苦降药组含药血清后,均能上调ICC中ATP酶的水平,提示在给予半夏泻心汤及苦降药组含药血清后,ICC中ATP酶水平升高,通过促进ICC能量代谢,进而调节细胞内外各种离子的变化及细胞信号传递的过程,从而调节胃肠运动。
在本实验中,通过对半夏泻心汤及苦降药组数据进行PK、PD拟合,显示黄芩苷PK模型1、2、3房室各权重有无滞后时间均拟合极差,原因可能是药时曲线有较明显的三峰现象,无法应用常见的房室模型进行计算,可能需要根据此化合物的动力学特性,采用肝肠循环或双吸收部位模型进行拟合。PD实验结果表明,半夏泻心汤及苦降药组含药血清对ICC的KIT蛋白表达无明显影响,因此KIT蛋白可能不适合进行PK-PD模型拟合。根据PK-PD模型拟合得到的浓度-效应曲线,可以解释半夏泻心汤调节ATP酶及Ca2+浓度的作用滞后于血药浓度的现象,这种滞后现象可能与药物分布、合成新活性物质、表达新的基因需要一定的时间有关[34]。在本实验中,半夏泻心汤中巴马汀、小檗碱、黄芩素对Ca2+浓度效应的Imax和苦降药组的Imax相差不大,但半夏泻心汤中巴马汀、小檗碱、黄芩素对ATP酶效应的Emax远大于苦降药组的Emax,提示半夏泻心汤上调ATP酶的效应优于苦降药组,体现全方配伍优势。
| [1] | 清·柯琴.伤寒来苏集 [M].北京:中国中医药出版社, 2006: 256. |
| [2] | 桂林罗哲初手抄.桂林古本伤寒杂病论 (第2版) [M].南宁:广西人民出版社, 1980: 82. |
| [3] | 金·成无己.伤寒明理论 [M].上海:上海科学技术出版社, 1980: 62. |
| [4] | Sheiner L B, Stanski D R, Vozeh S, et al. Simultaneous modeling of pharmacokinetics and pharmacodynamics application to dtubocurarine [J]. Clin Pharmacol Ther, 1979, 25(3): 358-371. |
| [5] | 徐菲飞,李晋奇,肖开春,等.半夏泻心汤调节胃肠动力的物质基础研究 [J].中国实验方剂学杂志, 2015, 21(3): 160-163. |
| [6] | 李晋奇,童荣生,肖开春,等.半夏泻心汤促进胃肠运动的有效部位筛选研究 [J].实用医院临床杂志, 2013, 10(6): 29-31. |
| [7] | Koh S D, Sanders K M, Ward S M. Spontaneous electrical rhythmicity incultured interstial cells of cajal from the murine small intestine [J]. J Phsiol, 1998, 513(1): 203-213. |
| [8] | 李春穴,童卫东,刘宝华,等. Cajal间质细胞的分离、培养方法探讨 [J].消化外科, 2004, 3(4): 267-269. |
| [9] | 刘勇,齐清会.大鼠胃Cajal间质细胞的分离和培养[J].世界华人消化杂志, 2005, 13(4): 495-498. |
| [10] | 朱金照,许其增. Cajal间质细胞在胃肠动力疾病中的作用 [J].医学研究生学报, 2004, 17(6): 562-564. |
| [11] | Streutker C J, Huizinga J D, Campbell F. Loss of CD117 (c-kit) and CD34-positive ICC and associated CD34-positive fibroblasts defines a subpopulation of chronic intestinal pseudo-obstruction [J]. Am J Surg Pathol, 2003, 27(2): 228-235. |
| [12] | Jain D, Moussa K, Tandon M, et al. Role of interstitial cells of Cajal in motility disorders of the bowel [J]. Am J Gastroenterol, 2003, 98(3): 618-624. |
| [13] | 莫平,童卫东,崔明,慢传输性便秘患者全结肠 Cajal间质细胞的分布 [J].中华普通外科杂志, 2009, 24(3): 251-252. |
 2015, Vol. 38
2015, Vol. 38


