2. 天津天士力之骄药业有限公司, 天津市中药注射剂新技术企业重点实验室, 天津 300402
2. Tianjin Tasly Pride Pharmaceutical Co., Ltd., Tianjin Key Laboratory of Advanced Technology Enterprise of TCM Injections, Tianjin 300402, China
红参是由五加科植物人参Panax ginseng C. A. Mey. 经蒸制加工而来,人参的化学成分主要为皂苷类、氨基酸类、挥发油类、无机元素和脂肪酸类等[1, 2, 3]。关于红参的研究目前仍主要集中在人参皂苷方面,而对于油脂类化学成分的研究较少。
人参油脂类物质主要包括脂肪酸、挥发油及烷烃类等成分[4, 5]。脂肪酸为人参油脂类物质中的一类重要成分,而脂肪酸中的主要成分为亚油酸、棕榈酸、α-亚麻酸等[6, 7]。文献中多采用GC法或GC-MS法对人参或红参中的油脂类物质进行测定,但在分析过程中柱温很高,易使α-亚麻酸、亚油酸的双键断裂或双键异构化。其他中药材油脂或脂肪酸的化学成分的HPLC测定亦有报道,但前处理繁琐,需柱前衍生化[7]。本文采用HPLC法对红参提取物中的α-亚麻酸、亚油酸进行测定,为红参的质量控制、化学成分研究、开发利用等提供新的方法。
1 试验材料与仪器 1.1 材料红参药材购自吉林省长白县,为6年生鲜参加工而成,经天津中医药大学叶正良研究员鉴定为五加科植物人参Panax ginseng C. A. Mey.的加工品;红参提取物、红参提取过程中油脂由天津天士力之骄药业有限公司提供;甲醇、乙腈(色谱纯,美国Merck公司);磷酸(色谱纯)、超纯水(实验室自制),亚油酸(质量分数99.1%,批号111622-201203,中国食品药品检定研究院)、α-亚麻酸对照品(质量分数99.9%,批号111236-201304,中国食品药品检定研究院)。
1.2 仪器Milli-Q超纯水系统(美国Millipore公司),KQ-100E型超声清洗器(昆山市超声仪器有限公司),电热真空干燥箱(天津市天宇实验仪器有限公司),Waters2695型高效液相色谱仪、2998型紫外检测器(美国Waters公司),电热恒温水浴锅(上海森信实验仪器有限公司),AL204型万分之一电子分析天平(梅特勒-托利多仪器有限公司)。
2 方法与结果 2.1 色谱条件采用DIKMA Diamonsil C18(250 mm×4.6 mm,5 μm)色谱柱,柱温30℃,以乙腈-0.1%磷酸水(90∶10)为流动相梯度洗脱,体积流量1.0 mL/min,检测波长203 nm。
2.2 对照品的制备精密称取亚油酸、α-亚麻酸对照品,用甲醇溶解定容至10 mL,各制成质量浓度为13.918、6.603 mg/mL的对照品储备液,备用。
取对照品储备液稀释制成亚油酸、α-亚麻酸质量浓度分别为348.0、16.5 μg/mL的混合对照品 溶液。
2.3 供试品的制备 2.3.1 红参药材的提取红参饮片加8倍量95%乙醇浸泡16 h后回流提取3次,第1次回流提取3 h,第2次加6倍量95%乙醇回流提取3 h,第3次加6倍量95%乙醇回流提取2 h。合并乙醇提取液,减压回收乙醇至无醇味,加水至约相当于原药材相等质量的体积,2~5℃冷置60 h,分离除去上层油,水层滤过至澄清。滤液减压浓缩至相对密度为1.15~1.25(50℃),转入已清场合格的干燥箱,减压干燥(减压浓缩温度≤65℃,减压干燥温度≤60℃,减压干燥时间≤40 h),得红参提取物。
2.3.2 红参提取物供试品溶液的制备取红参提取物0.2 g,加0.5 mol/L氢氧化钠溶液10 mL溶解,在70℃水浴条件下加热30 min,上处理好的Cleanert PS-SPE大孔吸附树脂商品柱(天津艾杰尔科技有限公司,规格0.5 g/6 mL),加0.5 mol/L的氢氧化钠20%甲醇溶液10 mL冲洗,再用20%甲醇溶液10 mL冲洗,最后用甲醇洗脱接收至10 mL量瓶中近刻度,加甲醇至刻度。
2.4 方法学验证 2.4.1 系统适应性取α-亚麻酸、亚油酸的混合对照品和供试品溶液按“2.1”的色谱条件进行PDA全波长扫描测定,结果α-亚麻酸、亚油酸均为纯度角度<纯度阈值,证明α-亚麻酸、亚油酸峰纯度均符合要求,分离度均大于1.5,理论塔板数均大于2000,说明系统适应性良好。见图 1。
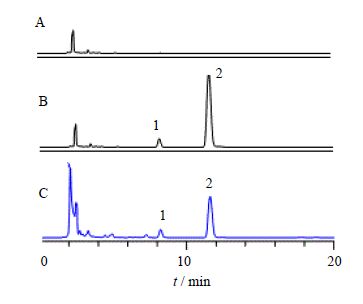
|
图 1 图1 空白溶剂(A)、混合对照品(B)及红参提取物供试品(C)色谱图
Fig. 1 HPLC of blank solvent (A),mixed reference substances (B),and red ginseng sample (C)
1- α-亚麻酸;2-亚油酸 1-α-linolenic acid; 2-linoleic acid |
取上述对照品储备液稀释制成含亚油酸、α-亚麻酸质量浓度分别为348.0、16.5 μg/mL的混合对照品溶液,分别进样4、6、8、10、15、20 μL,按“2.1”中的色谱条件测定。以峰面积为纵坐标,以进样质量为横坐标作图,并进行线性回归。结果α-亚麻酸的线性关系:Y=3×106X-223.8,r=0.999 9,线性范围0.066~0.33 μg;亚油酸线性关系:Y=2×106X-92 800,r=0.999 9,线性范围1.39~6.96 μg,证明α-亚麻酸、亚油酸的线性关系良好。
2.4.3 重复性考察取红参提取物(批号20130601)0.2 g,分别精密称定,共6份,按上述“2.3”中的供试品溶液制备方法制备,按“2.1”中的色谱条件进行测定,每个供试品溶液进样2针,以平均峰面积的计算各成分含量及RSD%,结果得6份供试品溶液中α-亚麻酸的平均质量分数为1.18 mg/g,RSD=1.338%,亚油酸的平均质量分数为12.30 mg/g,RSD=1.78%,说明重复性良好。
2.4.4 精密度考察取重复性试验中的1份供试品溶液按给定的色谱条件进行分离,连续进样6次,以亚油酸和α-亚麻酸色谱峰面积值进行计算,α-亚麻酸RSD值为0.36%,亚油酸RSD值为0.47%,说明仪器精密度良好。
2.4.5 稳定性考察取重复性试验中的1份供试品溶液按给定的色谱条件进行分离,每隔2小时进样一次,共进样6次,以亚油酸和α-亚麻酸色谱峰面积的值进行计算,α-亚麻酸RSD值为0.37%,亚油酸RSD值为1.86%,说明样品稳定性良好。
2.4.6 加样回收率考察取红参提取物(批号20130601)0.1 g,共6份,分别精密称定,分别加入亚油酸对照品溶液(13.918 mg/mL)88 μL、α-亚麻酸对照品溶液(6.603 mg/mL)23 μL,按“2.3.2”的供试品制备方法和“2.1”的色谱条件分析测定。计算回收率,结果亚油酸平均加样回收率为99.62%,RSD值为1.48%;α-亚麻酸平均加样回收率为100.76%,RSD值为1.35%。
2.5 样品测定取各批次红参提取物0.2 g,分别精密称定,按给定的供试品溶液制备条件制备及给定的色谱条件测定,结果见表 1。
|
|
表 1 14批红参提取物中α-亚麻酸、亚油酸的量 Table 1 Contentof alpha linolenic acid and linoleic acid in 14red ginseng extracts |
14批红参提取物中亚油酸、α-亚麻酸的均值为10.867 1、0.969 4 mg/g,RSD值为10.87%、14.15%,表明提取过程中的批间脂肪酸类物质含量仍有一定的变化。
2.6 红参提取过程中的油脂类物质含量监控取红参提取过程中对油脂类物质含量影响较大的3个过程中的药液,分别为红参一次浓缩液、红参油水分层后水层和红参二次浓缩液。分别取上述药液4 mL,加入2.5 mol/L氢氧化钠溶液1 mL混匀,然后按照“2.3.2”中的供试品溶液的制备方法制备样品,按“2.1”中的色谱条件测定。
从以上提取过程中的结果来看,α-亚麻酸、亚油酸从一次浓缩到二次浓缩是不断下降的,油水分层后大部分油脂类物质被分离,所以水层中油脂类物质含量较一次浓缩液中的低,油水分层后水层药液经过滤后浓缩到达二次浓缩时,α-亚麻酸、亚油酸含量再次降低。这说明提取工艺可有效降低红参药液中的油脂类物质的含量。见图 2。
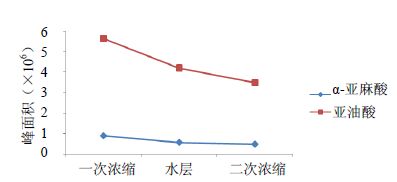
|
图 2 图2 红参提取过程中α-亚麻酸、亚油酸含量变化 Fig. 2 Contents of α-linolenic acid and linoleic acid in extraction process of red ginseng英文标题 |
本文采用的供试品溶液的前处理方法为皂化方法,根据影响皂化反应的因素和相关文献报道的反应条件[9, 10],分别单因素考察皂化反应的温度和皂化反应的时间:①对皂化反应的温度考察:取4组分别设定60 ℃、70 ℃、80 ℃、90 ℃下水浴加热30 min,结果样品含量在70 ℃以上即能反应完全,故反应的温度设定为70 ℃。②对皂化反应的时间考察:分别在70 ℃水浴下分别设定反应时间15 min、30 min、45 min、60 min,结果样品含量在30 min时最高,故反应时间定为30 min。综合以上优化条件,最终确定皂化反应的条件为:70 ℃下水浴30 min,在该条件下,皂化反应即可完全。若供试品溶液不经皂化处理,直接过SPE柱后进行HPLC检测,则在供试品溶液色谱图中,与亚油酸甲酯保留时间对应的位置检测到了明显的色谱峰,而在经皂化反应后的供试品溶液色谱中,与亚油酸甲酯保留时间对应的位置未出现色谱峰,表明,亚油酸甲酯经皂化反应已全部转变为亚油酸。由于亚油酸甲酯在高比例有机相为流动相的洗脱程序里,其保留时间过长,不适宜做为HPLC含量测定成分,故本实验首先对供试品溶液采用皂化方法将亚油酸甲酯转化为亚油酸,以便于测定。
α-亚麻酸、亚油酸测定的液相色谱条件,分别考察了紫外最大吸收波长、流动相、柱温等因素:①吸收的波长的选择:取α-亚麻酸、亚油酸的混合对照品溶液按给定的色谱条件进行PDA全波长扫描测定,结果表明,α-亚麻酸、亚油酸的最大吸收波长在203 nm处,故选定203 nm作为检测波长。②流动相的选择:分别以乙腈-水(90∶10)、乙腈-0.05%磷酸水(90∶10)、乙腈-0.1%磷酸水(90∶10)、甲醇-0.1%磷酸水(90∶10)为流动相洗脱,结果表明乙腈-0.1%磷酸水(90∶10)为流动相的色谱峰峰型对称、保留时间及分离度良好。③柱温的选择:分别考察柱温25 ℃、30 ℃、35 ℃、40 ℃,按给定的色谱条件进行检测比较,结果表明,柱温变化对峰面积影响较小,故选择柱温为30 ℃。综合以上因素考察,最终确定最佳色谱条件,该色谱条件能够准确测定α-亚麻酸、亚油酸含量。
样品的纯化方法采用Cleanert PS-SPE大孔吸附树脂商品柱,其填充基质为聚苯乙烯/二乙烯基苯,它是以聚苯乙烯为单体,二乙烯基苯为交联剂聚合而成的球形网状结构,这种结构可有效吸附红参提取物药液中的α-亚麻酸、亚油酸等脂肪酸类物质,使得α-亚麻酸、亚油酸等脂肪酸与色谱、糖类物质分离,从而达到纯化的目的。
红参是生脉注射液或参麦注射液的主要原药材,其中的油脂类物质难溶于水,不宜存在于中药注射液药液中。本方法可用于检测红参提取物中的α-亚麻酸、亚油酸含量,亦可用于监测有关红参生产过程中的油脂含量变化,以便于控制和去除油脂类物质,操作简便、结果可靠,从而代替采用GC/GC-MS测定油脂类物质的方法。
| [1] | 郭秀丽, 高淑莲. 人参化学成分和药理研究进展 [J]. 中医临床研究, 2012, 4(14): 26-27. |
| [2] | 杨秀伟. 红参化学、药理和临床研究进展 [J]. 中成药研究, 1984, (5): 30-33. |
| [3] | 刘 志, 阮长春, 刘天志, 等. HPLC法同时测定林下参、鲜人参、生晒参和红参中14种人参皂苷 [J]. 中草药, 2012, 43(12): 2431-2434. |
| [4] | 刘继永, 郑培和, 逄世峰, 等. 鲜人参、红参、蒸参水醚溶性成分的GC-MS分析 [J]. 安徽农业科学, 2010(28): 15155-15576. |
| [5] | 徐 涛, 曹立军, 赵 花, 等. 超临界CO2萃取人参脂溶性成分的GC-MS分析 [J]. 人参研究杂志, 2012, (4): 19-22. |
| [6] | 杨艳辉, 杨兴斌, 王 燕, 等. 人参脂肪酸和挥发油成分的GC-MS分析 [J]. 陕西师范大学学报: 自然科学版, 2007(1): 77-81. |
| [7] | 陈文学, 赵 岩, 杨 琦, 等. 基于GC-MS法的不同品种人参中脂肪酸成分及含量分析 [J]. 安徽农业科学, 2010, (20): 10106-10634. |
| [8] | 王晓丽. 柱前衍生化-HPLC法同时测定注射用沙棘籽油中脂肪酸的含量 [J]. 沈阳药科大学学报, 2010, 27(10): 808-812. |
| [9] | 刘 威. 柱前皂化HPLC法测定不同产地桃仁中亚油酸和油酸的量 [J]. 中草药, 2013, 43(14): 2000-2003. |
| [10] | 秦建平. HPLC同时测定火麻仁中α-亚麻酸、亚油酸和油酸含量 [J]. 中国实验方剂学杂志, 2012, 18(7): 71-73 |
 2015, Vol. 38
2015, Vol. 38


