2. 中国科学院长春应用化学研究所, 吉林 长春 130022
2. Changchun Institute of Applied Chemistry, Chinese Academy of Sciences, Jilin, Changchun 130022, China
人参为五加科植物人参Panax ginseng C. A. Mey. 的干燥根,红参是人参经过高温炮制后得到的加工品。人参具有抗氧化、抗衰老、提高机体免疫力及护心保肝等药理作用。乙醇在体内主要经肝脏代谢,其代谢物乙醛及代谢过程中产生的活性氧会对肝脏造成损害,长期饮酒和过量饮酒,会造成乙醇在体内堆积,对肝脏造成不同程度的损伤,损伤程度从轻到重表现为脂肪肝、肝纤维、肝硬化[1],引起机体内天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、三酰甘油(TG)、丙二醛(MDA)等生化指标水平增高。人参皂苷是红参的主要活性成分,《中国药典》和国家标准均以人参皂苷为红参的考核指标。近年来,有研究发现红参具有保肝功能[2, 3],本文旨在研究人参皂苷提取物对小鼠酒精性肝损伤的防治作用,揭示作用机制,为红参的临床应用提供依据。
1 材料与与仪器 1.1 仪器Infinite M200pro酶标仪(瑞士帝肯);Lecia- DM2500微生物显微镜,德国Lecia公司。
1.2 药物与试剂鲜人参,为5年生,产自吉林省抚松县,由长春中医药大学王淑敏教授鉴定为五加科人参属人参Panax ginseng C. A. Meyer干燥根;联苯双酯滴丸(浙江万邦药业有限公司,批号A02130407);56°北京红星二锅头酒(北京红星二锅头酒厂,批号20140224);ALT试剂盒、AST试剂盒、MDA试剂盒、GSH试剂盒(南京建成生物工程研究所,批号20150112);TG试剂盒(浙江东瓯生物工程有限公司,批号2015040104)。
1.3 实验动物清洁级ICR雄性小鼠,体质量20~22 g,由吉林大学基础医学院动物实验中心提供,动物合格证号:SCXK-(吉)2014-005。
2 实验方法 2.1 红参炮制称取鲜人参约300 g,用纱布包好,放入蒸参箱,在60 min升温到100 ℃后蒸制6 h,蒸制完毕后置于50 ℃烘干箱内烘干。将烘干后的红参研碎成粉,过80目筛。
2.2 人参皂苷提取物(Ginseng saponin extracts,GE)制备称取红参粉末,加入8倍量80%乙醇,超声提取(500 W,100 Hz)30 min,抽滤,滤渣加入6倍量乙醇超声30 min,滤过,合并滤液,40 ℃水浴蒸干,加入适量水溶解,即得人参皂苷提取物(人参总皂苷含量为3.84%),4 ℃下保存待用。
2.3 动物分组取清洁级ICR雄性小鼠72只,正常喂养5 d后,将其按体重平均分为6组,分别为对照组、阳性组(联苯双酯)、模型组及GE高、中、低剂量组,每组12只。
2.4 动物造模及给药给药剂量按照成人日均用药量与小鼠给药量进行剂量换算,除对照组每天ig等体积的蒸馏水外,其余各组ig给予56°白酒,给药剂量为0.2 mL/20 g,1次/d,造模5 d。给药组给予GE,低、中、高剂量组每日分别给予0.38、0.75、1.13 g/kg生药材浓度的GE,阳性对照组给予联苯双酯0.90 mg/kg,给药后1 h给予56°白酒,1次/d,连续30 d。小鼠给药期间每周进行称质量并记录,并观察小鼠的毛色、饮食、行为及死亡情况。
2.5 样本采集处理前禁食12 h,给药及白酒1 h后,小鼠摘眼球取血,常温静置后待其凝固,3 000 r/min离心15 min,取血清,−80 ℃保存待测。采血后,迅速剖取肝脏,用冷生理盐水洗净,滤纸吸湿后,称取肝脏湿重,计算肝脏系数(肝脏系数=肝质量/体质量)。取肝右叶做HE染色,肝左叶制备10%肝匀浆,匀浆制备方法:用冷生理盐水冲洗肝脏至无血色,称质量,加入9倍量冷生理盐水机械匀浆,将匀浆液2 500 r/min离心20 min,4 ℃,取上清。
2.6 生化指标检测每组取同等样本量的小鼠血清及肝匀浆,严格按照试剂盒操作方法进行小鼠血清ALT、AST、TG、肝匀浆MDA、GSH含量测定。
2.7 肝组织病理学检查取小鼠肝脏右叶置于10%中性福尔马林中进行固定,经一定梯度浓度的乙醇脱水、石蜡包埋、切片进行HE染色,用显微镜观察肝组织病理变化。
2.8 数据处理应用SPSS 19.0统计软件进行统计分析,采用单因素方差分析,组间比较采用最小显著差数法(LSD),数据均以表示。
3 结果 3.1 小鼠状况观察试验期间,GE中剂量组及阳性组死亡小鼠4只,其余各组死亡小鼠2只。对照组小鼠精神状态正常,毛色正常,模型组小鼠毛色较差,造模期间,ig给予白酒后20 min左右,出现醉酒状态,不自主行为增多,爬行不稳,有些小鼠呈现昏睡状态,给药组小鼠给予白酒20 min后,醉酒状态较模型组稍好。
3.2 体质量及肝脏系数变化各组小鼠体质量无统计学差异,与对照组相比,模型组小鼠肝质量增大(P<0.05),表明长期饮酒和乙醇的堆积造成小鼠肝脏受损肿大,质量增加可能与肝脏内脂肪堆积或其他物质生成有关。给药组小鼠肝脏系数相较模型组有明显降低(P<0.05),GE高、中、低剂量组均有降低,但组间变化趋势不明显,GE对酒精引起的小鼠肝脏受损肿大有一定的缓解作用。见表 1。
|
|
表 1 不同剂量GE对小鼠体质量、肝质量及肝脏系数影响 (x ± s) Table 1 Effect of different doses of GE on body ,liver weights,and liver index in mice with alcoholic- induced liver injury (x ± s) |
与对照组相比,模型组小鼠血清ALT(P<0.05)、AST(P<0.05)、TG(P<0.01)含量明显升高;与模型组相比,GE高、中剂量组ALT含量降低(P<0.01),GE各剂量组均能降低AST和TG水平(P<0.01),联苯双酯组可明显降低ALT、AST水平。但GE高、中、低剂量组组间呈现的量效关系不明显。长期白酒灌胃会造成小鼠血清ALT、AST、TG含量增高,GE可明显降低血清TG的含量,对ALT、AST含量降低有一定作用,说明GE对小鼠酒精性肝损伤有一定保护作用。见表 2。
|
|
表 2 不同剂量GE对小鼠血清ALT、AST和TG水平影响 (x ± s) Table 2 Effect of different doses of GE on levels of ALT,AST,and TG in serum of mice with alcoholic- induced liver injury (x ± s) |
小鼠肝匀浆MDA含量结果显示,模型组小鼠MDA含量高于对照组(P<0.01),GE各剂量组MDA含量低于模型组(P<0.01)。模型组GSH含量低于对照组(P<0.01),GE各剂量组GSH含量高于模型组(P<0.01),GE可降低MDA含量,增加GSH含量,说明其可在一定程度上抵御肝脏内的氧化作用,从而保护肝脏进一步损伤。见表 3。
|
|
表 3 不同剂量GE对小鼠肝内MDA和GSH水平影响(x ± s) Table 3 Effect of different doses of GE on levels of MDA and GSH in liver tissue of mice with alcoholic- induced liver injury (x ± s) |
正常组肝细胞结构正常,肝细胞条索排列整齐;模型组肝细胞变性坏死,有炎性细胞浸润,脂泡小而密集;联苯双酯组炎性细胞浸润和坏死程度减轻,GE中、高组也可见一定的炎性细胞浸润,但程度较模型组轻,小而密集的脂泡明显减少,见图 1。
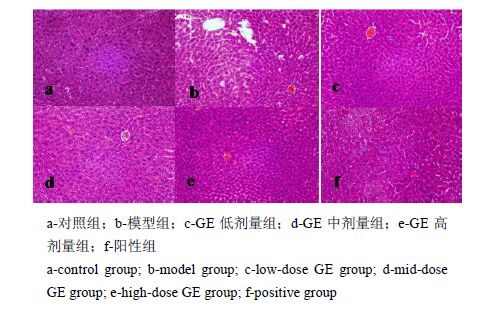
|
图 1 各组小鼠肝脏病理学观察(HE染色) Fig. 1 Histopathological observation on hepatic tissue of mice in each group (HE staining) |
本研究采用长期、固定剂量的酒精灌胃造模方法[4, 5]来模拟长期饮酒的状态,形成慢性酒精性肝损伤模型。通过实验观察,长期灌胃白酒的小鼠,不自主行为增多,会出现嗜睡、四肢无力、食欲减退、呼吸衰竭等状态,模型组小鼠的生化指标也表明长期白酒灌胃引起的肝功能的损伤,长期、固定剂量的酒精灌胃引起小鼠慢性酒精性肝损伤是可行的。
ALT、AST是检验肝脏损伤的一个重要指标,正常血清里ALT、AST含量极少,只有在肝细胞死亡破裂后肝细胞内的ALT、AST才会释放入血,血清中ALT、AST含量增加说明肝脏出现炎症。乙醇经肝脏代谢过程中产生的活性氧会直接对肝细胞造成氧化损伤[6],形成过脂质氧化产物——MDA,其含量是细胞氧化损伤的一个重要检测指标。模型组小鼠肝组织MDA含量高于正常组,GSH含量低于正常组,肝脏长期的酒精代谢会造成肝脏内氧化物质的增多,还原物质减少,造成肝细胞氧化损伤。同时肝脏脂质过氧化会产生脂肪酸的氧化,影响肝脏微管功能,致使肝脏内TG代谢障碍,长期的乙醇摄入,不仅增大了小鼠的肝质量、肝脏系数,也致使模型组小鼠较正常组小鼠TG的量明显增多。
红参醇提液中的成分主要是人参皂苷,红参中含有20多种人参皂苷,如人参皂苷Re、Rb1、Rh1、Rh2、Rd等,其人参皂苷Rg3、Rg2、Rh1的含量高于白参[7]。研究发现人参皂苷20 (S)-人参皂苷Rg3可明显抑制肝损伤小鼠ALT、AST的酶活性[8],人参皂苷Rb1可明显降低大鼠肝微粒体细胞色素P450酶与NADPH-P450的活性[9],人参皂苷Rh2可抑制肝纤维DNA的合成[10]等。通过本研究发现,GE可明显降低长期白酒灌胃小鼠血清中TG的含量,对降低其ALT、AST作用不明显,对抑制肝脏内MDA的含量,增加GSH含量有一定作用,对长期饮酒所造成的肝损伤有一定的预防和保护作用,从而阻止肝脏向纤维化进一步恶化。GE中、高剂量组与模型组的病理观察比较,GE可在一定程度上抑制肝细胞炎症发生,但抑制效果不明显,但可以显著减少小而密集的脂肪泡数量,GE中、高剂量组可明显抑制肝脏内的泡样损伤。GE可能主要通过抑制体内活性氧对肝脏脂质过氧化、减少肝脏脂肪堆积这一途径来避免肝脏受损。
综合以上结果,人参皂苷提取物对小鼠酒精性肝损伤有一定的保护作用,以中、高剂量效果最好,但红参保肝机制尚不明确,此研究为红参的保健开发和治疗酒精性肝损伤提供了一定的参考。
| [1] | 赵 洁, 雷金燕. 酒精性肝病的研究进展 [J]. 北京中医药, 2009, 28(11): 907-908. |
| [2] | Scott Luper N D. A review of plants used in the treatment of liver disease: Part 1 [J]. Liver Dis, 1998, 3(6): 410-421. |
| [3] | 董亚男, 陈逸云, 叶青艳, 等. 不同剂型垂盆草对急性肝损伤大鼠的防治作用 [J]. 药物评价研究, 2013, 36(6): 426-430. |
| [4] | 李有贵. 竹节人参皂苷对乙醇性肝损伤的保护机理研究 [D]. 杭州: 浙江大学, 2011. |
| [5] | 杜正彩, 邓家刚, 黄慧学, 等. 芒果叶醇提取物对小鼠急性酒精性肝损伤的影响 [J]. 中国实验方剂学杂志, 2013, 19(22): 250-253. |
| [6] | Masalkar P D, Abhang S A. Oxidative stress and antioxidant status in patients with alcoholic liver disease [J]. Clin Chim Acta, 2005, 335(1-2): 61. |
| [7] | Kitagawa I, Yoshikawa M, Yoshihara M, et al. Chemical studies on crude drug precession I on the constituents of ginseng radix rubra(1) [J]. Yakugaku Zasshi, 1983, 103: 612. |
| [8] | Lee H U, Bae E A, Han M J, et al. Hepatoprotective effect of 20 (S)-ginsenosides Rg3 and its metabolite 20 (S)-ginsenoside Rh2 on tert-butyl hydroperoxide-induced liver injury [J]. Biol Pharm Bull, 2005, 28(10): 1992-1994. |
| [9] | Park K H, Shin H J, Song Y B, et al. Possible role of ginsenoside Rb1 on regulation of rat liver triglycerides [J]. Biol Pharm Bull, 2002, 25(4): 457-460. |
| [10] | Byun B H, Shin I L, Lee L. Antipholiferative effects of Panax ginseng ginseno-sides on DNA synthesis in cultured mouse fibroblasts [J]. Koryo Insam Hakhoechi, 1995, 19(2): 114. |
 2015, Vol. 38
2015, Vol. 38


