1982年Border等[1]利用家兔静脉注射阳离子化牛血清白蛋白(C-BSA)首次造成了C-BSA肾炎模型。之后Adler等[2]证实C-BSA肾炎模型是原位免疫复合物(IC)所致,其发病机制是由于C-BSA与肾小球基底膜(GBM)上的带负电部位结合在GBM上,使机体产生相应抗体与抗原在原位形成IC,结果在GBM上皮下产生颗粒状沉积物而致病[3]。迄今为止,人们已运用C-BSA在家兔、大鼠及小鼠等动物上复制了实验性肾炎模型,并在一些指标上对模型进行了定性及定量研究[4, 5, 6]。但查阅文献发现,目前对于模型自身变化过程的追踪却模糊不明,仍较多偏于细微局部的观察研究,而有关其全方位、各系统的实验研究相对开展较少,主要围绕造模剂的给药剂量、给药方式等开展研究[6, 7, 8]以优化造模方案,而对造模剂给药时间、评价模型的指标选择以及模型的自我进展等问题研究较少,但模型本身的特点却影响着评价指标的选择、药物介入的时间、用药周期的长短等,这对药物的有效评价至关重要。
本文选择大鼠为受试动物复制C-BSA肾炎模型,利用多指标考察模型情况,探索造模时间、恢复时间与模型病变程度的关系,以及与之相符合的敏感指标等问题,为该模型在药物评价中的应用提供一些参考。
1 实验材料 1.1 实验动物SPF级SD雄性大鼠,48只,体质量200~220 g,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2006-0009,饲养于屏障系统环境。
1.2 主要药品及试剂牛血清白蛋白,索莱宝科技有限公司进口分装,批号724B055;URIT 11G尿试纸条,桂林优利特医疗电子有限公司,批号59120103;尿蛋白定量试剂盒,南京建成生物工程研究所,批号20130117;肌酐(Cr)试剂盒,南京建成生物工程研究所,批号20130115。
1.3 主要仪器URIT-500B型尿液分析仪,桂林优利特医疗电子有限公司;LBY-N6COMPACT型血液流变仪,北京普利生仪器有限公司;7080型全自动生化仪,日立公司;ADVIA2120血液分析仪,西门子。
2 实验方法 2.1 C-BSA的制备参照改良的Border[9]方法:将67 mL无水乙二胺溶于500 mL的蒸馏水中,再加入6 mol/L盐酸350 mL,将pH值调整到4.75,冷却至25 ℃,在不断搅拌下加入牛血清白蛋白5 g(溶于25 mL蒸馏水)中,再加入1.8 g碳化二亚胺盐酸盐,继续维持25 ℃并不断搅拌反应2 h,加入4 mol/L(pH 4.75)醋酸缓冲液30 mL终止反应,将所得溶液置于透析袋中于2~8 ℃下双蒸水透析72 h(2~5 h换水1次),最后真空冷冻干燥成粉末后,即得。保存于−80 ℃冰箱备用。
2.2 分组及造模将尿蛋白半定量检查为阴性的大鼠分为对照、模型两组,每组24只,实验期分为造模期和观察期两时期,具体安排如下:模型组尾iv给予C-BSA溶液(溶于pH 7.2的PBS中)5 mg/只,0.5 mL/只,隔日1次,持续6周,为造模期;造模停止后继续观察4周,为观察期。对照组的24只正常大鼠不做任何处理。整个实验持续10周。
2.3 数据收集在造模的第4周和第6周,两组随机各取12只动物使用代谢笼(禁食不禁水)收集24 h尿液,3 h时以尿试纸行尿常规(包括pH值、亚硝酸、葡萄糖、维生素C、隐血、尿比重、白细胞、酮体、尿胆原、胆红素)半定量检查,记录24 h尿量,用试剂盒测定尿蛋白、尿肌酐。麻醉后眼眶静脉丛采集EDTA抗凝血进行血常规检查,采集促凝血分离血清使用半自动生化分析仪进行生化指标检测,计算内生肌酐清除率(CCr),之后每组随机取6只大鼠称体质量后,腹主动脉采集肝素抗凝血,用血流变仪测定血液黏度,放血处死后分离肾脏、肝脏、脾脏,称质量,将肝脏和肾脏以12%福尔马林固定HE染色进行组织病理学检查。进入观察期后在第8周和第10周,两组动物随机各取6只,进行以上全部检测。
3 数据处理计量数据以x±s表示,采用SPSS 16.0统计软件进行检验分析。采用单因素方差分析(One-Way ANOVA)评价整体性差异,方差齐性用LSD t-test分析方法进行组间比较,方差不齐用Dunnett’s T3 分析方法进行组间比较。计数资料及病理学结果采用SPSS 16.0统计软件进行非参数秩和检验。
4 实验结果 4.1 一般观察、体质量及脏器系数结果试验期一般观察发现,对照组大鼠活泼好动探究能力强,皮毛光滑,性情温顺,无明显异常反应;模型组大鼠在注射C-BSA 2周后均不同程度的出现毛发污损无光泽,易激惹,体型消瘦,少动呆滞等症状,尿液颜色基本正常,呈黄色或稍深至褐色,正常大鼠亦可见。在观察期内模型组动物状态好转。
实验数据表明,与对照组比较,随造模时间延长,大鼠体质量逐渐降低,而进入观察期后大鼠体质量逐渐回升,直至第10周与对照组比较无明显差别。肝脏系数、肾脏系数及脾脏系数的变化趋势与体质量一致,在第4、6、8周时,与对照组相比明显增高,但第8周时肾脏系数明显低于第6周,第10周时各脏器系数与对照组比较均无明显差异。另外,该模型动物的胸腺系数无明显异常。见表 1。
| 表 1 模型对体质量及脏器系数的影响 Table 1 Effects of modeling on body weight and organ coefficient |
实验结果显示,在造模期时,动物的24 h尿量明显减少,且出现了明显的蛋白尿,24 h尿蛋白量与对照组相比具有极其显著的统计学意义(P<0.001);在观察期,动物的24 h尿量与对照组相比无明显统计学意义,在第8周时24 h尿蛋白仍明显高于对照组(P<0.01),在第10周时,尿蛋白量虽仍高于对照组,但已无统计学差异。在整个实验过程中,尿肌酐均未见明显异常。结果见图 1。
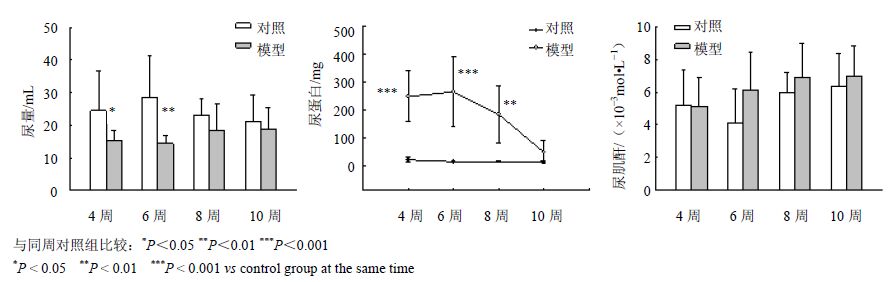 |
图 1 模型对24 h尿量、尿蛋白、尿肌酐的影响 Fig. 1 Effects of modeling on 24 h urine,urine protein,and urine creatinine |
尿常规结果显示,尾iv C-BSA未对大部分指标造成影响,包括未在尿中检测到红细胞和血红蛋白(数据未展示)。除蛋白质外,仅发现尿中白细胞量在第4、6、8、10周时显著升高。结果见表 2。
| 表 2 尿白细胞半定量检查例数分布表 Table 2 Examples distribution on semi-quantitative examination of urine leukocytes |
在造模期,模型组大鼠的RBC、HGB、HCT、MCH均有明显下降,具有统计学差异,第4周与第6周模型组比较无明显差异;进入观察期后仅在第8周可见RBC、HGB及HCT明显低于同期对照组,且与第4、6周模型组相应数据比较无明显差异,第10周时与对照组相比血常规指标全部无明显差异(表 3)。血常规其他指标仅偶见某单一指标变化,经分析无实际临床意义,因此结果未做展示。
| 表 3 模型对血常规指标的影响 Table 3 Effects of modeling on blood routine analysis |
在造模期及观察期,与对照组相比,模型组大鼠血清内Cr、BUN均没有变化,无统计学意义。计算出CCr显示,第4周时,模型组CCr稍低于对照组,无统计学差异;第6周时,模型组CCr进一步降低,显著低于对照组(P<0.05);第8周时,模型组CCr与第6周模型组相比稍有提高,与对照组比较已无显著差异;第8周时,模型组CCr与对照组数值基本相当,无统计学差异。见表 4。
| 表 4 模型对血清生化指标的影响 Table 4 Effects of modeling on serum biochemical indexes |
数据显示,第4、6、8周时模型组血清内TC、TG、HDL-C、LDL-C与对照组相比均显著升高,提示脂代谢紊乱,第10周时TG、LDL-C仍高于对照组,而TC、HDL-C回复到正常水平(P>0.05),同时发现进入观察期后,TC、TG、HDL-C、LDL-C水平都出现了恢复趋势。见表 4。
4.5.3 对肝功能(AST、ALT、TBIL)的影响造模第4周时,模型组AST、ALT的水平显著低于对照组,第6、8、10周时,ALT、AST与对照组相比无显著变化。造模第4、6周时,模型组总胆红素(TBIL)含量显著降低,与对照组比较,具有显著的统计学意义,进入观察期后,TBIL恢复到正常水平,与对照组相比无统计学意义。见表 4。
4.5.4 对血清蛋白(TP、ALB)的影响实验结果表明,在造模期,模型组血清内TP及ALB均显著低于对照组,统计学差异极其显著;进入观察期后,在第8周时,模型组仅ALB水平仍低于对照组,TP恢复到正常水平,在第10周时模型组TP及ALB与对照组比较均无明显差异。见表 4。
4.6 血液流变学检测结果血液流变学分析显示,在C-BSA造模期及之后的观察期中,与对照组相比,模型组大鼠全血黏度均没有变化。而模型组大鼠血浆黏度在第4、6、8周时明显升高,第8周时血浆黏度与第6周模型组相比进一步降低(P<0.05),第10周时模型组血浆黏度与对照组相比无明显差异。见表 5。
| 表 5 模型对血液黏度的影响 Table 5 Effects of modeling on blood viscosity |
镜下检查发现(图 2),实验第4、6、8、10周的模型组动物肾脏可见不同程度的肾小管蛋白管型、肾小管扩张、再生肾小管、间质炎细胞浸润、肾小球鲍曼氏囊增厚与相应对照组比较均有统计学意义(P值分别为0.019、0.003、0.012、0.007),提示造模成功。第4、8周与第6周的病变比较无统计学意义,表明造模6周的病变程度与造模4周比较无明显加重,第8周(造模后观察2周)病变程度无明显减轻;第10周与第6周比较有统计学意义(P=0.020),表明造模后恢复4周病变程度有所减轻。而肝脏在整个实验过程中均未见明显病变。
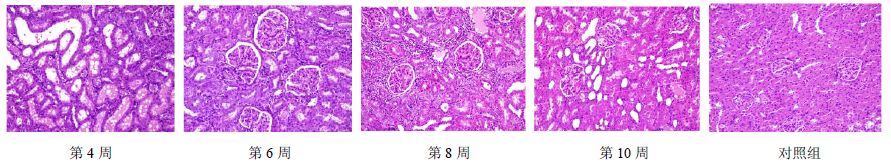 |
图 2 C-BSA肾炎模型肾脏组织病理图片(HE染色) Fig. 2 Kidney tissue pathological images of glomerulonephritis model induced by C-BSA |
本研究使用C-BSA隔日尾静脉注射4周,可见血红细胞、血红蛋白、血清总蛋白、白蛋白、24 h尿量均明显降低,血脂(TC、TG、LDL-C)、血浆黏度、24 h尿蛋白升高,造模6周时上述指标与正常值相比仍有显著差异,甚至有继续恶化的趋势,综合各项指标的变化情况符合肾炎病理病变特征。总结前人研究C-BSA肾炎模型特点[10, 11, 12, 13]:1)GBM原位可见IC沉积,主要有IgG和C3;2)足突损伤,GBM增厚,钉突形成。症状表现为大量的蛋白尿、脂代谢紊乱,与人类的肾病综合征相符,近似人类的膜性肾炎,本研究结果与文献报道相一致。另外,本研究首次发现,模型大鼠红细胞及血红蛋白均较正常大鼠偏低,提示模型大鼠出现了贫血症状,这一现象与慢性肾炎患者的临床症状相吻合,慢性肾小球肾炎患者可出现贫血、心衰等[14],其主要是由于肾实质受损,水分潴留所致的血液“稀释”,再者肾脏合成分泌的红细胞生成素减少,导致红细胞生成减少,大量蛋白随尿的排泄造成营养不良,都会导致贫血。研究发现,贫血和心衰等严重程度与肾脏病变及肾功能减退成正比[15]。综合各项数据表明本研究成功复制了大鼠C-BSA肾炎模型。
实验结果显示,血清Cr和BUN在整个实验周期内与对照组相比无统计学差异,提示Cr和BUN的值没有明显异常变化。多位学者[16, 17, 18, 19]利用大剂量C-BSA长周期给予复制了慢性肾功能衰竭(CRF)模型,在4周内亦未见Cr和BUN,到6周时Cr和BUN才明显升高,其解释为可能在4周内肾脏仍处于功能代偿期,健存肾单位发挥代偿作用,使Cr和BUN的值尚处于正常范围内,6周后由于健存肾单位的数目逐渐减少,肾小球的滤过功能显著降低,其值出现明显的升高。临床表现上,往往仅在慢性肾功能衰竭时Cr和BUN才会升高。依此来看,动物模型中Cr和BUN的变化程度与造模剂量及造模时间等因素有很大关系,低剂量短周期的造模确实可形成膜性肾炎模型,该期肾功能应处于代偿期,应不会有Cr和BUN的明显变化,一般认为当CCr降至50%以下时,Cr和BUN才会升高[20, 21]。而目前在各种肾炎模型中监测CCr的报道相对较少,很难客观的评价所造模型对肾脏的损伤程度,也就很难确定BUN、Cr是否达到升高的程度。本研究发现,5 mg/只C-BSA隔日注射6周后,大鼠的CCr为0.94 mL/min,显著低于正常值1.24 mL/min,仍远远未低到50%以下,此时24 h尿蛋白定量数据显示模型组大鼠尿蛋白量仍为正常值的近20倍,说明肾脏确实已有炎性改变,但Cr和BUN没有明显变化,本课题组认为该情况符合实际规律。
分析数据变化趋势发现,多项指标随造模的结束进入观察期后表现出恢复趋势,因此本研究将同期模型组数据与对照组数据相比,观察比值随时间的变化规律(图 3),结果显示随造模时间的延长模型病变程度逐渐加重,而造模结束后随恢复时间的延长模型病变程度又呈现逐渐减轻的趋势。这一变化规律目前很少有人报道,但主动型Heymann膜性肾炎模型容易恢复已有人提及[22],提示该类膜性肾病模型容易恢复是其特点之一。基于这一特点,使用该模型评价药物效用时,可采用预防给药的方式进行,采用治疗给药时,应密切关注模型恢复程度,以免数据失去可靠性。
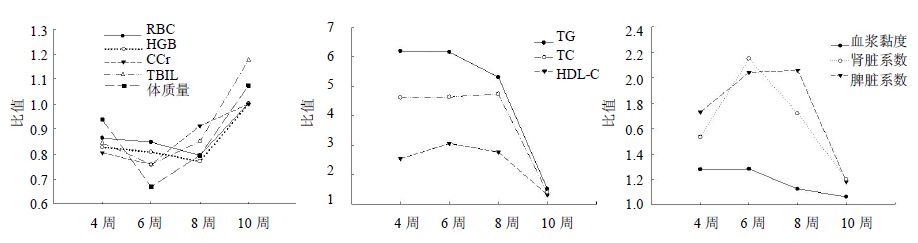 |
图 3 评价指标随时间变化规律曲线 Fig. 3 Variation curves with time |
蛋白尿是肾脏病变程度的标志,它作为一个独立持久的致病因素参与肾脏的病变过程[23],尿蛋白的程度是肾脏疾病进展至终末期以及死亡率增加的显著孤立的决定因素[24],降低蛋白尿延缓肾病进展应是药物治疗取得收益的主要指标之一。膜性肾病的患者大约80%伴有不同程度的低蛋白血症,结合本研究数据变化规律,本课题组认为白蛋白能够更为敏感的把血清蛋白水平与病变程度联系起来,可作为药效评价指标。低蛋白血症可通过一系列代偿机制导致高脂血症的出现,高脂血症也是肾小球硬化的主要致病因素之一,这一指标也逐渐被应用于临床前药物评价中来[25]。而Cr和BUN虽是衡量肾功能的重要指标,却需根据模型情况而定,结合CCr数据综合评价,当模型出现明显肾衰竭症状时可入选为评价指标,慢性肾炎的前中期则不适宜[26, 27]。临床上肾组织活检是确定肾脏病理改变的唯一方法,但属有创性检查,不宜重复操作和动态监测病变发展过程,因此在临床前动物模型研究中,组织病理学检查就显的尤为重要,是确定药物疗效的重要且必不可少的指标。
综上,确实应看到动物的个体差异,造模时间、造模剂量等因素对模型程度的影响,慢性肾炎和慢性肾衰竭病变特征相互联系又有所区别,这一关系在该模型上得到了明显的体现,两类指标的变化相互掺杂,互为联系。该模型主要用于治疗膜性肾炎药物的疗效评价,且C-BSA的使用剂量为5 mg/只,造模4周以上为宜,随造模时间的延长模型将逐渐加重,评价指标中血清ALB、TC、TG、尿白蛋白(推荐)、尿量及肾脏组织病理应为必须考察指标,而血清Cr和BUN的选择与否需搭配内生CCr才具有实质意义。考虑模型存在一定的自我恢复情况,建议采用预防给药或边给药边造模的方式,造模停止后给药时间不宜超过4周,且给药期间应至少采集数据1次,监测指标的动态变化过程。另外,应根据受试药物的特点增加相应的评价指标,比如增加免疫组化检查、组织电镜检查、血液黏度检查、血常规检查等。
| [1] | Border W A. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen [J]. J Clin Invest, 1982, 69(2): 451-461. |
| [2] | Adler S G, Wang H, Ward H J, et al. Electrical charge. Its role in the pathogenesis and prevention of experimental membranous nephropathy in the rabbit [J]. J Clin Invest, 1983, 71(3): 487-499. |
| [3] | 赵武述, 陈 仁, 卞志强. 现代临床免疫学 [M]. 北京: 人民军医出版社, 1994: 128. |
| [4] | 徐红梅, 马跃荣, 孙 健. 小鼠膜性肾小球肾炎模型的复制 [J]. 中国比较医学杂志, 2004, 14(4): 199. |
| [5] | 章友康, 王叔咸, 杜学海, 等. 用阳离子化牛血清蛋白制作原位免疫复合物型肾炎模型 [J]. 中华肾脏病杂志, 1985, 1(1): 7. |
| [6] | 周宝宽, 孙 涛, 高 伟. 牛血清白蛋白的阳离子化及其在原位免疫复合物型肾炎模型制备中的应用 [J]. 中国免疫学杂志, 2007, 23: 648. |
| [7] | 梁 静, 孙兴旺, 曹 灵, 等. 不同剂量阳离子化牛血清白蛋白对膜性肾病大鼠造模的影响 [J]. 中国组织工程研究与临床康复, 2008, 12(37): 7322-7325. |
| [8] | 张虎祥, 张海燕, 马跃荣. 小鼠膜性肾小球肾炎复制方法及免疫荧光定量研究 [J]. 温州医学院学报, 2003, 33(4): 222-224. |
| [9] | 王北婴, 李仪奎. 中药新药研制开发技术与方法 [M]. 上海: 上海科学技术出版社, 2003: 579-580. |
| [10] | 张虎祥. 膜性肾小球肾炎发病机制研究进展 [J]. 泸州医学院学报, 2000, 23(3): 250-251. |
| [11] | 尼日特, 杨巧芳. 慢性肾炎实验动物模型研究进展 [J]. 医学研究杂志, 2014, 43(1): 145-148. |
| [12] | 邸志权, 胡金芳, 刘 静, 等. 慢性肾炎的中医药实验方法研究进展 [J]. 药物评价研究, 2012, 35(3): 204-210. |
| [13] | 黄小平, 李成进, 李士梅. 大鼠原位性肾小球肾炎模型的建立 [J]. 中山医科大学学报, 1991, 12(2): 86-89. |
| [14] | 丁文娟, 潘 玲, 黎艳培, 等. 慢性肾脏病不同分期患者贫血与铁代谢的关系 [J]. 中国慢性病预防与控制, 2014, 22(3): 276-279. |
| [15] | 刘兰芳, 罗仙桃, 金银生, 等. 慢性肾功能不全与贫血关系的探讨 [J]. 新医药, 1990, 21(10): 520-521. |
| [16] | 薛继平, 王 健, 康春松. 慢性肾功能衰竭动物模型制作的研究 [J]. 实用医技杂志, 2009, 16(12): 953-955. |
| [17] | 陆 敏, 杜联芳, 王迎春, 等. 超声造影技术定量分析兔慢性肾病血流灌注的实验研究 [J]. 中华医学超声杂志: 电子版, 2015, 12(1): 72-80. |
| [18] | 陶 琦, 姚源璋. 慢性肾功能衰竭动物模型研究进展 [J]. 中国医药导报, 2013, 10(16): 31-33. |
| [19] | 张 颖, 侯兆辉. 慢性肾功能衰竭实验动物模型研究 [J]. 吉林中医药, 2008, 28(11): 839-841. |
| [20] | 吴光华, 邹 洁. 对血肌酐、尿素氮及内生肌酐清除率测定的某些看法 [J]. 临床医学杂志, 1988, 4(2): 80. |
| [21] | 刘旭航. 肾茶对SD大鼠慢性肾炎C-BSA模型治疗作用的实验研究 [D]. 黑龙江: 黑龙江中医药大学, 2014. |
| [22] | 王 慧, 王 净, 李 静, 等. 膜性肾病小鼠模型的建立与鉴定 [J]. 细胞与分子免疫学杂志, 2013, 29(2): 197-199. |
| [23] | 陈 华, 张建梅, 刘景城. 蛋白尿与慢性肾脏慢性病变的研究进展 [J]. 实用儿科临床杂志, 2001, 16(4): 236-237. |
| [24] | 康 林, 宋爱凤, 沈敬华. 加味过敏煎对膜性肾病大鼠蛋白尿及血清生化指标的影响 [J]. 内蒙古医学杂志, 2014, 46(6): 641-644. |
| [25] | 武尚文, 曹 彤, 李 伟. 血脂异常与慢性肾脏疾病进展的关系 [J]. 山东医药, 2010, 50(17): 64-65. |
| [26] | 宋立群, 李 慧, 马艳春, 等. 虫草益肾颗粒对膜性肾病大鼠生化指标及肾组织形态学影响的研究 [J]. 中医药学报, 2014, 42(3): 23-25. |
| [27] | 任美芳. 益肾通络方对膜性肾病大鼠的肾保护作用以及对肾组织Nephrin mRNA、Podocin mRNA表达的影响 [D]. 石家庄: 河北医科大学, 2013. |
 2015, Vol. 38
2015, Vol. 38


