2. 瀚盟生物技术(天津)有限公司, 天津 300457
2. Harmonia Biotechnology (Tianjin) Limited Company, Tianjin 300457, China
注射用血栓通(冻干)是从三七根中提取而成,主要治疗各种血管性和出血性疾病、脑血管病及其后遗症[1, 2],其主要成分为人参皂苷Rb1、Rg1、Re、Rd及三七皂苷R1,其含量比为22∶28∶4∶5∶6[3, 4]。本文建立了运用UPLC-MS/MS同时测定脑组织中人参皂苷Rb1、Rg1、Re、Rd及三七皂苷R1含量的方法,并对该测定方法进行了方法学验证,应用此方法检测脑缺血再灌注后脑内药物的含量从而探究药物在脑内分布情况。本实验旨在研究缺血再灌注后血栓通注射液中人参皂苷Rb1、Rg1、Re、Rd及三七皂苷R1在脑内的分布,为进一步研究血栓通治疗脑缺血的机制提供参考。
1 仪器及材料 1.1 实验仪器Acquity UPLC超高效液相色谱仪(Waters,USA)与Quattro Premier XE三重四级杆质谱仪(Waters,USA)联用。Mikro 220R高速离心机(S/N 0000346-01-00,Hettich),氮吹仪(S/N 21569,Organomation Associates Inc.),XS 205分析天平(Mettler Toledo)。
1.2 药品与试剂试剂:甲醇(色谱纯,美国Fisher公司);甲酸(色谱纯,MREDA);乙腈(色谱纯,美国Fisher公司);水(Milli Q)。
药品:人参皂苷Rg1、人参皂苷Rb1、人参皂苷Re、人参皂苷Rd、三七皂苷R1(均购自天津中新药业集团股份有限公司,质量分数98%,批号22427390、41753439、52286596、52705938、80418242);内标:特非那定(中国食品药品检定研究院,批号100292-200201),注射用血栓通(冻干)(250 mg/瓶,广西梧州制药集团股份有限公司,批号Z200025652)。
1.3 动物雄性Wistar大鼠(250~280 g),购自北京维通利华实验动物技术有限公司。动物使用许可证编号:SCXK(京)2012-0001。
2 分析方法的建立及验证 2.1 色谱及质谱条件采用Waters UPLC BEH C18(100 mm×2.1 mm,1.7 μm)色谱柱,流动相为0.1%甲酸的水溶液(A相)-乙腈(B相)。梯度洗脱程序为:0~1.5 min,5%~22%(B);1.5~4.5 min,22%~60%(B);4.5~4.6 min,60%~5%(B),4.6~7.0 min,5%(B)。体积流量为0.3 mL/min,进样量是7 μL。
质谱检测采用电喷雾离子化正离子(ESI+)模式,多反应监测(MRM)方式。检测电压为3.2 kV,离子源温度为120 ℃,脱溶剂气温度为300 ℃,脱溶剂气体积流量为600 L/h。待测化合物及内标特非那定的检测离子对为:人参皂苷Rg1,m/z 823.65→823.65;人参皂苷Rb1,m/z 1131.79→365.04;人参皂苷Rd,m/z 969.65→789.47;人参皂苷Re m/z 969.65→789.47;三七皂苷R1 m/z 955.60→775.45;特非那定m/z 472.46→436.46。
2.2 内标及溶液的配置 2.2.1 内标溶液的配制精密称定特非那定对照品,用甲醇溶解并配制成1 mg/mL的母液,再用甲醇稀释成质量浓度为5 ng/mL的内标溶液备用。
2.2.2 对照品溶液的配置精密称定人参皂苷Rg1、人参皂苷Rb1、人参皂苷Re、人参皂苷Rd、三七皂苷R1对照品粉末,用甲醇溶解并配制成质量浓度为1 mg/mL的对照品储备液备用。
2.3 脑组织样本处理精密称定脑组织样本的质量,加入5倍量生理盐水(如0.1 g组织,加入500 μL生理盐水),超声破碎后备用。取脑组织匀浆液样本50 μL,加入5 μL甲醇,再加入200 μL 5 ng/mL的内标溶液,涡旋1 min后,15 000 r/min离心10 min,取上清200 μL,氮气吹干后,加入150 μL水-乙腈(50∶50)复溶,涡旋1 min后,15 000 r/min离心10 min,取上清进样测定。
2.4 方法的专属性本实验条件下,内标特非那定的保留时间为5.0 min,人参皂苷Rb1、Re、Rd、Rg1的保留时间分别为4.14、3.42、4.61、3.45 min,三七皂苷R1的保留时间是3.31 min。由图 1可见,大鼠脑组织中内源性物质不干扰5种皂苷类化合物及内标的测定,方法专属性较好。
 |
1-人参皂苷Rb1;2-人参皂苷Re,3-人参皂苷Rd;4-人参皂苷Rg1;5-三七皂苷R1;6-特非那定 1-ginsenoside Rb1;2-ginsenoside Re;3-ginsenoside Rd;4-ginsenoside Rg1;5-notoginsenoside R1;6-Terfenadine 图 1 空白脑组织(A)、空白脑组织中加入人参皂苷Rg1、Rb1、Re、Rd和三七皂苷R1对照品(B)、静脉注射血栓通30 min后大鼠脑组织(C)UPLC-MS/MS图Fig. 1 UPLC-MS/MS of normal brain tissue (A), normal brain tissue with ginsenosides Rg1, Rb1, Re, Rd and notoginsenoside R1 reference substances (B), and brain tissue after 30 min of iv administration of Xueshuantong Injection (C) |
取大鼠空白脑组织匀浆液,分别加入不同量的人参皂苷Rg1、Rb1、Re、Rd和三七皂苷R1对照品溶液,使其成为含待测化合物质量浓度分别为5、10、20、30、50、100、200、500 ng/mL的脑组织匀浆样品,按“2.3”操作,分别记录样品的峰面积与内标的峰面积。以样品的峰面积与内标的峰面积的比值(Ri)对质量浓度线性回归,得出脑组织基质中5种皂苷类化合物的标准曲线。结果表明脑组织样品中5种皂苷类化合物的线性方程见表 1,r均大于或接近于0.999 0。
| 表 1 脑组织样品中5种皂苷类化合物的回归方程、线性范围及最低定量限 Table 1 Regression, linear range, and LLOQ of five kinds of saponins in brain tissue |
取大鼠空白脑组织匀浆液,按标准曲线最低浓度点(5 ng/mL)的处理方法,平行处理6份样品,分别记录化合物的峰面积与内标的峰面积。5种皂苷类化合物的峰面积信噪比(S/N)均大于10,6份样品用标准曲线校正的浓度偏差均小于15.4%。6份样品中5种皂苷类化合物峰面积的RSD值均低于13.8%,证明该方法中5种皂苷类化合物的最低定量限均为5 ng/mL,见表 1。证明该方法具有较高的检测灵敏度。
2.7 提取回收率和基质效应取大鼠空白脑组织匀浆液,分别加入不同量的人参皂苷Rg1、Rb1、Re、Rd和三七皂苷R1对照品溶液,配制成各化合物质量浓度为10、100、400 ng/mL的样品,按“2.3”操作,测定化合物的峰面积。与空白脑组织匀浆液经“2.3”操作处理后再加入相应质量浓度的对照溶液进样测定后的峰面积的进行比值,得到各化合物的提取回收率。人参皂苷Rg1高、中、低浓度的提取回收率大于83.2%,人参皂苷Rb1的提取回收率大于81.4%,人参皂苷Re的提取回收率大于85.2%,人参皂苷Rd的提取回收率大于82.9%,三七皂苷R1的提取回收率大于86.8%。
空白脑组织匀浆液按“2.3”方法处理后,分别加入不同量的人参皂苷Rg1、Rb1、Re、Rd和三七皂苷R1对照品溶液,配制成各化合物质量浓度为10、100、400 ng/mL的样品,进样测定后的峰面积与相应浓度的对照品溶液测得的峰面积之比,得到各化合物的基质效应。人参皂苷Rg1高、中、低浓度的基质效应在92.5%~113.4%,人参皂苷Rb1的基质效应在87.5%~102.8%,人参皂苷Re的基质效应在93.8%~103.1%,人参皂苷Rd的基质效应在91.3%~117.4%,三七皂苷R1的基质效应在86.8%~99.5%。
2.8 日内及日间精密度取大鼠空白脑组织匀浆液,分别加入不同量的人参皂苷Rg1、Rb1、Re、Rd和三七皂苷R1对照品溶液,配制成各化合物质量浓度为10、100、400 ng/mL的样品,按“2.3”操作,测定样品与内标峰面积,计算Ri,代入标准曲线方程,计算得到相应浓度,考察日内和连续3 d的日间变异情况。结果见表 2。
| 表 2 大鼠脑组织中人参皂苷Rb1、Re、Rd、Rg1及三七皂苷R1的日内及日间精密度 Table 2 RSD of ginsenosides Rg1, Rb1, Re, Rd and notoginsenoside R1 in brain tissue of rats |
取大鼠空白脑组织匀浆液,分别加入不同量的人参皂苷Rg1、Rb1、Re、Rd和三七皂苷R1对照品,配制成各化合物质量浓度为10、100、400 ng/mL的样品,室温放置4 h及冷冻解冻循环3次后按“2.3” 项方法处理,测定药物浓度,考察样品室温放置4 h稳定性及冻融稳定性。
取大鼠空白脑组织匀浆液,分别加入不同量的人参皂苷Rg1、Rb1、Re、Rd和三七皂苷R1对照品,配制成各化合物质量浓度为10、100、400 ng/mL的样品,按“2.3”项方法处理后,去上清液在4 ℃放置12 h后,测定药物浓度,考察样品4 ℃放置12 h稳定性。
稳定性结果见表 3。
| 表 3 人参皂苷Rb1、Re、Rd、Rg1及三七皂苷R1在大鼠脑组织中的稳定性 (n = 3) Table 3 Stability of ginsenosides Rg1, Rb1, Re, Rd and notoginsenoside R1 in brain tissue of rats (n = 3) |
取Wistar大鼠30只,雄性,随机分为5组。分为对照组(12只)、术后24 h组(12只)和术后7 d组(6只)。对照组动物不造模,分为2组,分别给予注射用血栓通(冻干)50、100 mg/kg。其余动物依照Zea-longa[5]法复制大脑中动脉缺血再灌注(MCAO)模型。将大鼠麻醉,取颈部正中切口,分离右侧颈总动脉(CCA)及其分支颈外动脉(ECA)和颈内动脉(ICA),结扎并切断ECA及其分支,用动脉夹夹闭CCA和ICA,将栓线由ECA断端插进,沿CCA入ICA,至大脑中动脉的起始部。造模成功后,术后24 h组于术后24 h尾iv注射用血栓通(冻干)50、100 mg/kg,术后7 d组于术后第7天尾iv注射用血栓通(冻干)100 mg/kg。给药后30 min心脏灌流取脑,取材部位为手术侧纹状体背部的皮质部分。精密称量,−80 ℃保存备用。取脑组织按“2.3”项下方法处理,进行分析测定脑组织中各化合物的药物浓度。
3.2 结果由图 2结果不难看出,术后24 h,模型组的大鼠脑内人参皂苷Rg1、Rb1、Re和三七皂苷R1的量比对照组都有增高,且其含量随着用药剂量的增加呈增加趋势。Rg1可达1.5 μg/g组织,是在正常大鼠脑内浓度的近15倍。
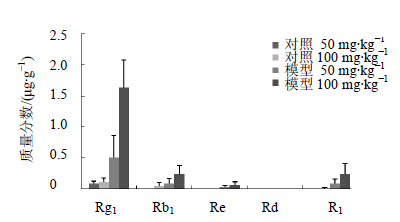 | 图 2 缺血再灌注24 h给药30 min后缺血区药物量Fig. 2 Content of Xueshuantong Injection in ischemic brain tissue iv administered for 30 min after ischemia for 24 h |
图 3是造模后1 d和7 d给药30 min后缺血区的脑内药物含量的比较。可以看出,造模后,随着时间的延长,血脑屏障的功能明显恢复,其药物透过量明显减少。与图 1中的对照组相比,药物透过量还是有明显升高,说明血脑屏障的功能没有完全恢复。
 | 图 3 脑缺血再灌注后1、7 d给药30 min后缺血区药物量Fig. 3 Content of Xueshuantong Injection in ischemic brain tissue iv administered for 30 min after ischemia for 1 d and 7 d |
这个结果充分展示了血栓通主要成分人参皂苷Rb1、Rg1、Re及三七皂苷R1在脑缺血大鼠脑中的含量远高于正常大鼠,并且其在脑内的含量随缺血时间的延长降低。
4 讨论 4.1 方法学评价生物样品的前处理方法是关系到检测灵敏度及准确度的关键步骤,一般生物样本前处理方法包括蛋白沉淀(PPT)、液液萃取(LLE)及固相萃取(SPE),Feng等[6]用固相萃取的方法检测犬血浆中的三七皂苷R1及人参皂苷Rb1和Rd1,得到较好的灵敏度,但SPE方法成本较高。而传统的PPT法虽能满足提取回收率的要求,但基质效应严重。最终采用传统的蛋白沉淀后,氮气吹干再用流动相复溶的方法。在得到较高的检测灵敏度的同时,方法的提取回收率较高,同时脑组织中的内源性物质不干扰5种皂苷类化合物及内标的测定。
建立的脑组织样品中人参皂苷Rb1、Rg1、Re、Rd及三七皂苷R1同时检测的方法,专属性良好,标准曲线的r均大于0.99。日内及日间RSD值均小于15%,质控样品及稳定性试验均符合要求。
4.2 血栓通(冻干)透过血脑屏障研究的意义李晓宇等[7]对三七总皂苷多效应成分在正常大鼠体内的药动学进行了研究,发现单体成分三七皂苷R1,人参皂苷Rg1、Rd、Re、Rb1在大鼠血浆中的药物浓度随时间的延长降低。何希辉等[8]发现三七皂苷R1、Rg1在正常和脑缺血30 min后再灌注状态下的血液内药动学参数无明显差异。注射用血栓通(冻干)主要成分是三七总皂苷,为三醇和二醇皂苷[3],是大分子物质,研究者发现:静脉给药后,人参皂苷原人参二醇型、原人参三醇型均能透过血脑屏障[9],且三七皂苷R1和人参皂苷Rg1能够透过血脑屏障进入大鼠脑脊液[10]。前人对脑缺血后血脑屏障的通透性进行了一系列研究,证实了脑缺血后的血脑屏障功能破坏,依文思蓝渗入量增加[11, 12]。但是对脑缺血后药物通透性的研究,尤其是大分子药物的通透性研究甚少。本实验就是基于这一理念展开设计。因前人对药物血液内浓度研究甚多[13, 14],本实验仅关注脑内药物含量的变化。
本实验中,模型组中人参皂苷Rg1、Rb1、Re、Rd及三七皂苷R1的脑组织浓度均高于对照组,且具有一定的剂量相关性。这也就证实了脑缺血后,血脑屏障破坏,药物的透过性增加,从而更好的发挥其治疗的功效。从缺血后的时间上来看,术后1 d脑内各个单体的含量明显高于术后7 d。术后7 d组脑内的单体含量相对对照组来说,仍有升高,表明缺血7 d后,因为脑内神经、血管等的再生,促成了血脑屏障的功能恢复,而尚未完全关闭。这更好的解释了治疗脑缺血药物在治疗上的时间窗问题。综上而言,本研究通过UPLC-MS/MS法测定脑缺血再灌注后脑内药物浓度,提供相关的参数,为进一步研究血栓通治疗脑缺血的机制提供参考。
| [1] | 王炎炎, 朱会超, 许文平, 等. 注射用血栓通对高脂血症家兔血小板功能的影响[J]. 中草药, 2015, 46(3): 396-400. |
| [2] | 王炎炎, 朱会超, 李来来, 等. 注射用血栓通体外对家兔血小板聚集的影响[J]. 中草药, 2014, 45(18): 2669-2672. |
| [3] | 傅萍, 刘仲义. 指纹图谱测定注射用血塞通、血栓通注射液及注射用血脉通的化学成分[J]. 华西药学杂志, 2007, 22(1): 76-78. |
| [4] | 高增平, 陆蕴如, 孙 伟. 血栓通注射液指纹图谱研究[J]. 中国实验方剂学杂志, 2002, 8(6): 1-3. |
| [5] | Zea-longa E L, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. |
| [6] | Feng H Z, Chen W, Zhu C Y. Pharmacokinetics study of bio-adhesive tablet of Panax notoginseng saponins[J]. Int Arch Med, 2011, 4(1): 4-18. |
| [7] | 李晓宇, 郝海平, 王广基, 等. 三七总皂苷多效应成分整合药代动力学研究[J]. 中国天然药物, 2008, 6(5): 378-381. |
| [8] | 何希辉, 炎彬, 潘卫松, 等. 三七皂苷中R1、Rg1在正常和脑缺血再灌注大鼠的动力学变化[J]. 中药药理与临床, 2001, 17(6): 12-14. |
| [9] | 孔令提. 人参皂苷元的药代动力学研究[D]. 北京: 北京协和医学院, 2013. |
| [10] | 李磊, 张丽慧, 李智, 等. 解毒通络方中三七皂苷类成分脑脊液药代动力学研究[J]. 中国药理学通报, 2014, 30(1): 126-131. |
| [11] | 刘一沉, 王静, 高艳, 等. 局灶性脑缺血再灌注损伤后大鼠血脑屏障通透性的研究[J]. 中国儿童保健杂志, 2009, 17(3): 309-311. |
| [12] | 刘式威, 刘政华, 吕霞, 等. 脑缺血再灌注损伤对大鼠血脑屏障内皮屏障抗原及通透性的影响[J]. 第二军医大学学报, 2010, 31(11): 1258-1260. |
| [13] | 侯宏伟, 赵晶. 血栓通注射液对缺血性脑血管病血液流变学的影响[J]. 心血管康复医学杂志, 2001, 10(6): 533-535.刘学华, 陈健文, 胡黎平. 血栓通注射液对犬脑循环的影响研究[J]. 中国药师, 2010, 13(12): 1755-1756. |
 2015, Vol. 38
2015, Vol. 38


