多发性硬化症(multiple sclerosis,MS)是一种以中枢神经系统脱髓鞘病变为特征的自身免疫性疾病,其发病人群以青壮年为主,尤以女性多见,在病程中表现出缓解-复发倾向[1]。复发性多发性硬化症(RMS)是一种中枢神经系统的慢性炎性自身免疫性疾病,患者往往会出现疲倦、视力衰退、行走不稳、身体麻木、眩晕甚至小便失禁等问题,严重影响日常生活[2]。浙江海正药业股份有限公司研发的重组人干扰素β-1a注射液临床拟用于治疗MS且在过去两年内至少有2次复发的患者,已完成的多项临床前药理毒理研究结果表明其具有很好的开发前景。本试验对重组人干扰素β-1a注射液的制剂安全性进行全面评价,为其临床应用提供参考依据。
1 材料与仪器设备 1.1 实验动物大耳白家兔,体质量2~3 kg,由北京隆安实验动物养殖中心提供,生产许可证号SCXK(京)2009-0005;Hartley豚鼠,体质量300~400 g,由北京维通利华实验动物技术有限公司提供,生产许可证号SCXK(京)2006-0009;SD大鼠,体质量100~200 g,由天津市山川红实验动物科技有限公司提供,生产许可证号SCXK(津)2009-0001。所有动物均饲养于天津药物研究院新药评价有限公司动物实验楼内,家兔饲养温度18~26 ℃,湿度40%~70%,换气次数8~10次全新风/h,光照12 h明/12 h暗;豚鼠和大鼠饲养环境温度20~26 ℃,湿度40%~70%,换气次数8~10次全新风/h,光照12 h明/12 h暗。
1.2 药品和试剂重组人干扰素β-1a注射液(批号20101003,规格0.5 mL:22 μg,pH 3.5;批号20110605,规格5 mL:440 μg,pH 3.6;批号20120201,规格0.5 mL:22 μg,pH 4.5;批号20120303,规格5 mL:440 μg,pH 4.3)、不含人血清白蛋白重组人干扰素β-1a(批号20110606,规格1 mL:44 μg)样品、含人血清白蛋白空白溶媒(批号20110502,规格5 mL/支,pH 3.6;批号20120302,规格5 mL/支,pH 4.3)及相同规格不含人血清白蛋白空白溶媒(批号20110503),均由浙江海正药业股份有限公司提供;生理盐水购自河北天成药业股份有限公司;甲醛购自天津市风船化学试剂科技有限公司;冰醋酸购自天津市凯信化学工业有限公司;卵清白蛋白购自Sigma公司;百白破联合疫苗购自成都生物制品研究所。
1.3 仪器组织自动脱水机(日本樱花检验仪器株式会社),组织石蜡包埋机(德国Leica),自动切片机(日本樱花检验仪器株式会社),自动封片机(日本樱花检验仪器株式会社),自动染色装置(日本樱花检验仪器株式会社),普通光学显微镜(日本Olympus公司),图像采集系统(日本Olympus公司),数显电热培养箱(上海博迅实业有限公司医疗设备厂),低速台式离心机(上海安亭科学仪器厂),恒温培养箱(Sanyo),酶标仪(Tecan)。
2 方法 2.1 家兔肌肉和皮下刺激性试验大耳白家兔分别经腿部肌肉和胸部皮下按11(低剂量组)、22 μg/kg(高剂量组)注射给予pH 3.6和pH 4.3的重组人干扰素连续7 d,并以相同途径给予相应空白溶媒(溶剂对照组),同时以生理盐水设置生理对照组,每组家兔4只,雌雄各半。每天观察给药局部刺激反应,并于末次给药后4 d和14 d每组剖杀1/2动物进行大体解剖和组织病理学检查。
2.2 豚鼠主动全身过敏性试验豚鼠连续间日sc pH 3.5的重组人干扰素5.5 μg/kg(低剂量1组)和22 μg/kg(高剂量组),同时以其空白溶媒设置溶剂对照组、以5.5 μg/kg不含人血清白蛋白样品设低剂量2组、以10 mg/mL卵清白蛋白卵清白蛋白设阳性对照组、以生理盐水设阴性对照组,每组豚鼠6只,雌雄各半。共致敏5次,末次致敏后12 d,于豚鼠前肢静脉一次快速给予2倍体积的相应药物进行激发,观察动物过敏反应症状。
2.3 大鼠被动皮肤过敏性试验被动过敏性试验组别设置和剂量设计同主动过敏性试验,其中卵清白蛋白质量浓度为40 mg/mL。大鼠连续间日sc致敏给药5次,同时ip百白破联合疫苗,末次致敏后12 d,腹腔采血制备抗体血清。皮内注射不同稀释度抗血清0.1 mL进行被动致敏,被动致敏后48 h,静脉快速注射相应药物和伊文思兰染液进行激发,观察大鼠皮肤蓝斑反应。
2.4 体外溶血性试验家兔1只,经心脏取血,制备2%红细胞混悬液。pH 3.5和pH 4.5的临床制剂浓度重组人干扰素,用生理盐水按1∶3进行稀释备用。供试品管内分别加入0.5、0.4、0.3、0.2、0.1 mL重组人干扰素稀释液,并以去离子水设阳性对照管、以生理盐水设阴性对照管。各管37 ℃孵育3 h,观察管内溶血和红细胞聚集情况;孵育结束后,离心,以酶标仪检测各管吸光度(A)值,计算溶血率,以溶血率5%判断药物是否有体外溶血作用。
溶血率=(试验管A值−阴性对照管A值)/(阳性对照管A值−阴性对照管A值)
以上试验均参照《化学药物刺激性、过敏性和溶血性研究技术指导原则》[3]和《治疗用生物制品非临床安全性技术评价指导原则》[4]的要求进行设计。
3 结果 3.1 重组人干扰素对家兔的局部刺激作用重组人干扰素(pH 3.6)及其溶媒给药组家兔,给药和恢复期间给药局部肉眼观察和大体解剖均未见明显刺激反应表现。组织病理学检查,给药后4 d,溶剂对照和重组人干扰素高、低剂量组分别有1只家兔腿部肌肉见骨骼肌纤维变性坏死、间质炎细胞浸润,至给药后14 d已无明显异常;给药后4 d和14 d,溶剂对照组和重组人干扰素高、低剂量组分别有1只家兔胸部皮下及周围组织镜下见散在炎细胞浸润、局部肌纤维变性,生理对照组家兔未见明显异常。溶剂对照和重组人干扰素高、低剂量组家兔组织病理学改变见图 1。
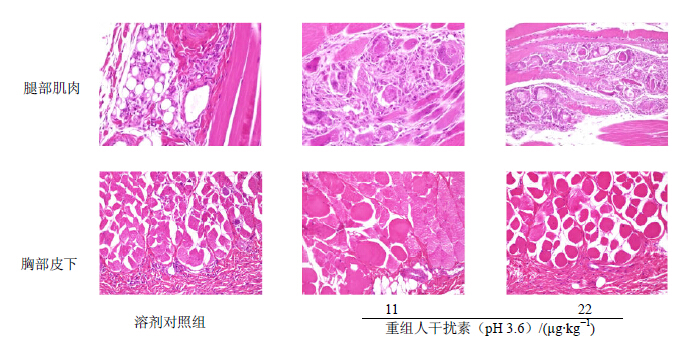 | 图 1 组织病理学图片Fig. 1 Histopathologic pictures |
重组人干扰素(pH 4.3)及其溶媒给药组家兔,给药和恢复期间给药局部肉眼观察、大体解剖和组织病理学检查均未见明显药物刺激反应。
3.2 重组人干扰素对豚鼠的主动全身过敏反应阳性对照组、溶剂对照组和重组人干扰素高剂量、低剂量1组豚鼠激发给药后出现搔鼻、呼吸困难、紫癜、步态不稳、痉挛等症状,发生强过敏反应,死亡率分别为100%、83.3%、100%、83.3%。空白豚鼠iv给予激发剂量的溶剂对照、低剂量1组和高剂量组药物,未出现类似过敏反应症状,可以判定以上为过敏反应所致,而非药物直接毒作用。低剂量2组和阴性对照组豚鼠未发生任何过敏反应。各组具体反应情况见表 1。
| 表 1 重组人干扰素β-1a注射液对豚鼠的主动过敏反应结果(n=6) Table 1 ASA results of recombinant human interferon β-1a injection (n=6) |
除阳性对照组大鼠皮肤蓝斑反应呈阳性外,其余各组大鼠未发生蓝斑反应,重组人干扰素对大鼠无被动致敏作用。
3.4 重组人干扰素对家兔红细胞的体外溶血作用重组人干扰素(pH 3.5)试验管,孵育期间肉眼观察与阴性对照管一致,上清澄清无明显溶血现象;溶液内未见絮状沉淀,管底沉淀振摇后可均匀分散,无红细胞凝聚发生。酶标仪测定上清A值,计算溶血率见表 2,其中管1和管2溶血率略高于5%,为可疑轻度溶血。
| 表 2 pH3.5的重组人干扰素β-1a注射液溶血性试验结果 Table 2 Hemolysis test results of pH 3.5 recombinant human interferonβ-1a injection |
重组人干扰素(pH 4.5)的溶血性检测,肉眼观察无溶血现象和红细胞凝聚发生;上清经酶标仪检测,溶血率均明显低于5%,无溶血发生。具体结果见表 3。
| 表 3 pH 4.5的重组人干扰素β-1a注射液溶血性试验酶标仪测定结果 Table 3 Hemolysis test results of pH 4.5 recombinant human interferon β-1a injection |
本试验pH 3.6组的重组人干扰素β-1a注射液及其溶媒,对家兔肌肉和皮肤黏膜及其周围组织有一定刺激作用;pH 4.3组的重组人干扰素β-1a注射液及其溶媒均对家兔肌肉和皮肤黏膜及其周围组织无刺激作用发生。同时,pH 3.5的重组人干扰素β-1a注射液对家兔红细胞具有可疑轻度体外溶血作用;pH 4.5的重组人干扰素β-1a注射液对家兔红细胞体外溶血和红细胞凝聚作用则均为阴性。以上刺激和溶血试验,除被检药物pH值不同外,其他各项操作和指标检测完全一致,结果表明重组人干扰素β-1a注射液pH值为3.5或3.6时具有一定的刺激性和体外溶血作用,pH值为4.3或4.5则对给药局部无刺激性、对家兔红细胞不具体外溶血和红细胞凝聚作用,提示pH值为药物产生刺激和溶血作用的原因[5, 6, 7]。
重组人干扰素β-1a注射液以人血清白蛋白为主要赋形剂。本试验分别对含有人血清白蛋白和不含人血清白蛋白的样品进行过敏性检测,发现含有人血清白蛋白的样品及其溶媒可使豚鼠发生强阳性主动过敏反应,过敏反应的发生无药物特异性。而给予不含人血清白蛋白样品的豚鼠不发生任何过敏反应症状,可知溶媒和重组人干扰素β-1a注射液药物本身对豚鼠无致敏作用。因此推测该制剂过敏原为其赋形剂人血清白蛋白,而非重组人干扰素β-1a药物本身。由于人血清白蛋白对豚鼠为种属异源性蛋白,可使豚鼠产生严重过敏反应,人体则极少发生对人源蛋白的严重过敏反应,因此重组人干扰素β-1a注射液在临床应用产生过敏反应的可能性不大。
综上所述,重组人干扰素β-1a注射液的pH值对其刺激性和体外溶血作用有明显影响,制剂生产中需注意对pH值的控制;虽然该制剂对豚鼠具有明显致敏作用,但药物本身无致敏作用,过敏反应为其赋形剂人血清白蛋白所致,对人体发生致敏作用的可能不大。重组人干扰素制剂安全性较好,推测可能对人无明显刺激、过敏和溶血作用。
| [1] | 张玉镇, 王运良. 甲泼尼龙冲击治疗急性期多发性硬化症疗效观察[J]. 中国基层医药, 2013, 20(19): 2929-2930. |
| [2] | 张秀颖, 白秋江, 李岩峰, 等. 治疗复发性多发性硬化症新药--特立氟胺[J]. 中国药师, 2013, 16(12): 1928-1930 . |
| [3] | 化学药物刺激性、过敏性和溶血性研究技术指导原则[S]. 2005. |
| [4] | 治疗用生物制品非临床安全性技术评价指导原则[S]. 2012. |
| [5] | Antoine J L, Contreras J L, Van Neste D J. pH influence of surfactant-induced skin irritation. A non-invasive, multiparametric study with sodium laurylsulfate[J]. Derm Beruf Umwelt, 1989, 37(3): 96-100 . |
| [6] | Sutinen R, Paronen P, Saano V, et al. Water-activated, pH-controlled patch in transdermal administration of timolol. Ⅱ. Drug absorption and skin irritation[J]. Eur J Pharm Sci, 2000, 11(1): 25-31. |
| [7] | 关昕, 解黎雯. pH值对注射用双黄连中间体溶血凝血的影响[J]. 基层中药杂志, 2000, 14(2): 13. |
 2015, Vol. 38
2015, Vol. 38


