2. 省部共建国家重点实验室培育基地天津市现代中药重点实验室, 天津 300193
2. Tianjin State Key Laboratory of Modern Chinese Medicine, Tianjin 300193, China
肝脏作为药物代谢的主要器官,也是受药物损伤的主要器官。药物性肝损伤(DILI)是导致上市药物撤市,药物临床研发失败的主要原因,是药物安全性研究所面临的关键问题。药物主要通过两种机制造成DILI:(1)特异质不良反应,这种肝脏损伤仅发生在少数个体,并且与用药剂量和疗程无相关性,通常是不可预测的,也难以通过实验动物模型复制。(2)药物和/或活性中间产物(RMs)对肝脏的直接毒性作用。药物经CYPs酶代谢产生亲电性RMs,并通过与细胞膜磷脂质的不饱和脂肪酸结合发生脂质过氧化反应,造成细胞器膜功能损害,致使线粒体损伤、细胞坏死等。亲电性RMs还可通过与细胞中蛋白半胱氨酸残基的巯基、赖氨酸残基的氨基等亲核基团共价结合,导致肌动蛋白凝聚而细胞骨架破坏,使细胞膜失去其化学及生理特性而产生细胞应激或凋亡。这类DILI是剂量依赖性的、可预测的,并可通过动物模型复制[1]。
近年来,细胞及亚细胞水平的体外实验方法已被广泛应用于对药物肝毒性及肝脏保护作用的研究之中[2, 3]。常用的细胞模型包括原代肝细胞、HepG2细胞系、L-02细胞系等,其中原代肝细胞因其更接近肝脏的原有功能已广泛用于研究药物对CYPs酶的作用及其机制、药物相互作用、药物毒理学等方面[4]。但原代肝细胞在体外培养的状态下CYPs酶的活性明显下降,故其不能灵敏准确的评价基于CYPs酶代谢产生肝毒性化合物的毒性。苯巴比妥和β-萘黄酮作为CYPs酶的广谱诱导剂可以提高细胞中CYPs酶的活性,增加其对药物的代谢能力[5, 6]。1-aminobenzotriazole(ABT)和metyrapone(MET)是常用的CYPs酶广谱抑制剂[7],原代肝细胞结合ABT和MET使用,可以更明确的考察药物的致毒机制。
本文拟分别采用苯巴比妥和β-萘黄酮诱导构建高CYPs酶活性的大鼠原代肝细胞模型,选用基于CYPs代谢导致肝毒性的药物他克林、双氯芬酸钠和对乙酰氨基酚为模型药物[8, 9, 10],通过比较诱导前后肝细胞酶活性和其对分别经苯巴比妥和β-萘黄酮诱导前后大鼠原代肝细胞的细胞毒作用,评价高CYPs酶活性大鼠原代肝细胞模型的准确性和灵敏性。建立高CYPs酶活性的大鼠原代肝细胞模型,对于基于CYPs酶代谢产生RMs导致肝毒性的药物有更灵敏高效的判断。维拉帕米是钙离子通道拮抗剂,主要用于心绞痛、心律失常和高血压等疾病的治疗[11, 12],在体内主要经CYP3A4代谢活化[13],临床使用中偶见肝毒性的报道[14],但因其毒性发生几率小且轻微,因此少有文章对其肝毒性做更多的研究。本课题组前期研究表明,维拉帕米肝毒性机制可能是由CYPs酶代谢产生RMs导致的肝毒性[1]。本文采用所构建的高CYPs酶活性大鼠原代肝细胞模型评价维拉帕米的肝毒性机制,为该模型的进一步应用提供基础。
1 材料 1.1 仪器FlexStation酶联免疫检测仪,美国Molecular Devices公司;HERACELL150i型CO2培养箱、Thermo Scientific生物洁净工作台、77202-60型蠕动泵,美国Colo-parmer 公司;液质联用系统(API 4000 Qtrap,SER .N: AR26221101,岛津LC-20AD泵;SIL-20AC恒温自动进样器,CTO-20A柱温箱,CBM-20A控制器,ESI离子源;Analyst Software 1.5.2色谱工作站),美国应用生物系统公司。
1.2 药品苯巴比妥、β-萘黄酮购于天津一方科技有限公司(质量分数>98%),他克林、双氯芬酸钠、维拉帕米、卡马西平(内标)购于中国食品药品检定研究院。非那西丁(PHE)、对乙酰氨基酚(PAR)、甲苯磺丁脲(TOL)、4-羟基甲苯磺丁脲(OHTOL)、右美沙芬(DEXM)、去甲右美沙芬(DEXP)、咪达唑仑(MDZ)、1-羟基咪达唑仑(OHMDZ)、氯唑沙宗(CHL)、6-羟基氯唑沙宗(OHCHL)、美芬妥因(MEP)、4-羟基美芬妥因(OHMERP)、DMEM、DMSO购于美国Sigma公司;FBS购于美国Gibco公司;细胞培养板,青霉素-链霉素购于美国Corning公司。细胞活性氧检测试剂盒和线粒体膜电位检测试剂盒购于碧云天生物技术研究所。所有其他溶剂和化学试剂均为分析纯或以上。
1.3 动物Wistar大鼠,体质量200~220g,雄性,购于北京华阜康生物科技有限公司,动物质量合格许可证号NO.0309714。
2 方法 2.1 高CYPs酶活性大鼠原代肝细胞模型的建立分别给予Wistar大鼠ip 40 mg/kg苯巴比妥(溶于生理盐水)和β-萘黄酮(溶于橄榄油),连续给药5 d。实验前大鼠禁食14~16 h,应用Seglen两步胶原酶消化法获得大鼠原代肝细胞[15],第一步用不含钙的灌流液Ⅰ以30 mL/min灌流15 min,第二步用含有胶原酶的灌流液Ⅱ以20 mL/min消化7 min。冰冷的HBSS离心洗涤2次,4℃、60×g离心3 min,,得到高CYPs酶活性大鼠原代肝细胞。台盼蓝染色法考察细胞活率,细胞活率≥85%可进行实验。细胞接种在Ⅰ型鼠尾胶包被的细胞培养板中。最后用DMEM离心洗涤1次,4℃、50×g离心3 min。细胞培养基是含有5%FBS、100 U/mL青霉素/链霉素的DMEM。细胞培养在37℃、5%CO2和湿度100%的细胞培养箱中。
2.2 苯巴比妥和β-萘黄酮诱导剂对大鼠肝功能的影响实验前大鼠禁食14~16 h,大鼠腹主动脉取血暂时存放在肝素钠润洗过的离心管中,3 500 r/min离心15 min,取上清,自动生化仪检测血浆中丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)水平。
2.3 应用“cocktail”探针底物法考察诱导剂对CYP450酶的影响 2.3.1 “cocktail”探针底物法建立“cocktail”探针底物法的建立按照实验室已建立的方法,液相和质谱条件参照实验室前期已建立好的方法[16]。
用磷酸盐缓冲液配制“cocktail”底物,其中CYP1A2的底物为PHE,CYP2C9的底物为TOL,CYP2C19的底物为MEP,CYP3A4的底物为MDZ,CYP2E1的底物为CHL,CYP2D6 的底物为DEXM。内标卡马西平用甲醇配制成质量浓度为75 ng/mL的终止液。
2.3.2 实验流程消化得到的大鼠原代肝细胞以1.5×105个/mL密度种在鼠尾胶包被的48孔板中,每孔300 μL,4 h后弃去上清液和未贴壁细胞,加入新鲜的培养基;在细胞种板后4、16、28 h加入300 μL cocktail底物,37℃环境中孵育1 h,加入含有内标(卡马西平)的冰冷甲醇1 200 μL终止反应;4℃、10 000 r/min离心10 min,取1500 μL上清液,氮气吹干,以200 μL甲醇复溶,LC-MS/MS分析各自代谢产物。
2.4 应用他克林、双氯芬酸钠和对乙酰氨基酚评价高CYPs酶活性大鼠原代肝细胞模型的灵敏性他克林主要由CYP1A2代谢,双氯芬酸钠主要由CYP3A4代谢,对乙酰氨基酚主要由CYP3A4和CYP2E1代谢。选用基于CYPs代谢导致肝毒性的药物他克林、双氯芬酸钠和对乙酰氨基酚作为评价高CYPs酶活性大鼠原代肝细胞模型药物。分别考察细胞上清液中乳酸脱氢酶(LDH)、细胞中活性氧(ROS)和线粒体膜电位(MMP)水平变化。
2.4.1 LDH含量测定消化得到的大鼠原代肝细胞以1.5×105个/mL接种在鼠尾胶包被过的48孔细胞培养板中,每孔300 μL。孵箱中培养4 h,去掉上清液及未贴壁的细胞,对于加入抑制剂的组,先加入ABT或MET孵育30 min,30 min后弃去上清液,分别加入含有模型药他克林、双氯酚酸钠和对乙酰氨基酚(30、100 μmol/L)以及抑制剂与模型药物(100 μmol/L)的混合培养基,0.1% DMSO培养基的细胞组作为空白对照组。ABT给药剂量是1 mmol/L,MET给药剂量是2 mmol/L。细胞孵育24 h后取上清液,用全自动生化仪检测上清液中的LDH水平。
2.4.2 ROS含量和MMP水平测定消化得到的大鼠原代肝细胞以1.5×105个/mL接种在鼠尾胶包被过的96孔黑板中,每孔100 μL。在细胞培养箱中培养4 h后弃去上清液和未贴壁的细胞,对于加入抑制剂的组,先加入ABT或MET孵育30 min,30 min后弃去上清液,加入分别含有他克林、双氯酚酸钠和对乙酰氨基酚(30、100 μmol/L)以及抑制剂与模型药物(100 μmol/L)的混合培养基,含有0.1% DMSO培基的细胞作为空白对照组。ABT给药剂量是1 mmol/L,MET给药剂量是2 mmol/L。细胞孵育12 h后用ROS试剂盒染色,酶标仪进行活性氧含量检测,检测条件为激发波长为485 nm,发散波长为535 nm;细胞孵育12 h后加入JC-1染料染色,在激发波长490 nm,发散波长530 nm条件下检测JC-1单体;在激发波长525 nm,发散波长590 nm条件下检测JC-1聚合物。
2.5 高CYPs活性大鼠原代肝细胞模评价维拉帕米肝细胞毒性采用所构建的高CYPs酶活性大鼠原代肝细胞模型对维拉帕米的肝毒性进行评价。维拉帕米浓度30、100 μmol/L,抑制剂ABT和MET的给药剂量和方法同上。检测指标分别是细胞上清液中LDH水平、细胞中ROS水平和MMP水平。
2.6 统计分析LDH、ALT、AST数据用GraphPad Prism (version 5.0)分析,数据以x±s 表示。统计学结果分析应用SPSS11.5软件,t检验比较两组间差异。
3 结果 3.1 苯巴比妥和β-萘黄酮两种诱导剂分别对大鼠肝功能的影响苯巴比妥或β-萘黄酮40 mg/(kg∙d)连续给药5 d,结果见图 1,诱导剂诱导过的大鼠血浆中ALT和AST水平与未诱导大鼠血浆没有差异。ALT和AST是肝细胞膜完整性指标,一般情况下ALT和AST存在于肝细胞内,当细胞膜受到损伤后,ALT和AST会漏到细胞外进入血液,导致血液中ALT和AST水平升高。实验结果显示,诱导剂没有破坏肝细胞膜的完整性。
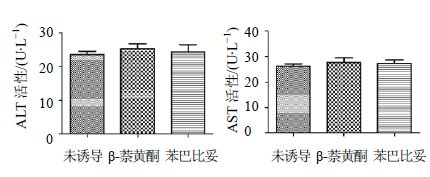 | 图 1 分别应用苯巴比妥和β-萘黄酮诱导前后大鼠血浆中ALT和AST水平变化Fig. 1 Change of ALT and AST levels in rat serum before and after adminstration with phernobarbital and β-naphthoflavone |
以不同时间点代谢产物与内标(卡马西平)的峰面积比值与时间作图(图 2),结果显示,与普通大鼠原代肝细胞组比,高CYPs酶活性大鼠原代肝细胞中CYP1A2、CYP3A4、CYP2D6和CYP2C9代谢产物的量有显著升高(P < 0.05或P < 0.01),即两种CYPs酶诱导剂诱导后的大鼠原代肝细胞中4种CYPs酶亚型活性在整个实验过程比普通大鼠原代肝细胞中高,但两种诱导剂诱导的结果又有不同。苯巴比妥偏重于CYP3A4亚型酶的诱导,β-萘黄酮偏重于CYP1A2亚型酶的诱导。
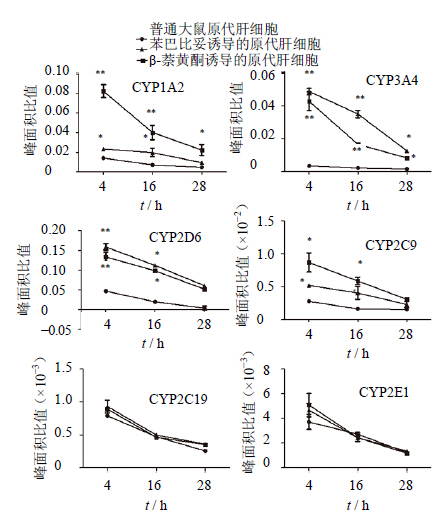 | 与同时间点普通大鼠原代肝细胞组相比:*P < 0.05,**P < 0.01 *P < 0.05, **P < 0.01 vs general rat hepatocytes group in the same time piont 图 2 6种底物在不同时间点代谢产物与卡马西平的峰面积比值Fig. 2 Peak area ratio of metabolic products of six substrates and carbamazepine in different time pionts |
选用基于CYPs酶代谢导致肝损伤的药物他克林、双氯芬酸钠和对乙酰氨基酚作为模型药物,研究比较其作用于诱导前后大鼠原代肝细胞产生的细胞毒作用。LDH是重要的糖酵解酶,同ALT、AST一样也是细胞膜完整性指标,几乎存在于机体所有细胞中,所以在整体动物实验中LDH指标不具有特异性[17]。大鼠原代肝细胞实验是应用纯化后的肝细胞考查药物的细胞毒性,排除了其他组织、细胞的干扰,所以选取LDH作为细胞膜完整性的指标。本次研究结果显示,他克林、双氯芬酸钠和对乙酰氨基酚在30 μmol/L和100 μmol/L时在高CYPs酶活性大鼠原代肝细胞上清液中LDH和细胞中ROS水平均高于普通大鼠原代肝细胞组,且差异有显著性,同时给予CYPs抑制剂ABT和MET后,LDH和ROS水平与100 μmol/L组相比有显著下降;对于细胞MMP水平,3种药物在100 μmol/L剂量下引起MMP水平的下降,ABT和MET抑制了MMP的下降,结果见图 3、图 4和图 5。他克林主要经CYP1A2代谢,在β-萘黄酮诱导的高CYPs酶活性大鼠肝细胞中得到更严重的损伤,LDH和ROS水平均高于苯巴比妥诱导的高CYPs酶活性大鼠原代肝细胞结果;双氯芬酸钠主要经CYP3A4代谢,对乙酰氨基酚主要经CYP3A4和CYP2E1代谢,所以对苯巴比妥诱导的高CYPs酶活性大鼠原代肝细胞导致更严重的细胞毒性,LDH和ROS水平均高于β-萘黄酮诱导的高CYPs酶活性大鼠原代肝细胞组。
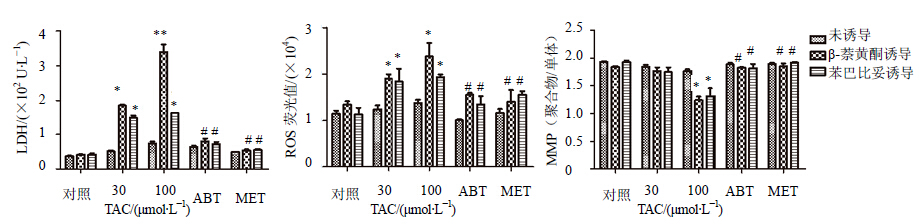 | 与对照组相比:*P < 0.05,**P < 0.01;与100 μmol/L TAC组相比:#P < 0.05 *P < 0.05, **P < 0.01 vs control group; #P < 0.05 vs 100 μmol/L TAC group 图 3 他克林在大鼠原代肝细胞和分别给予苯巴比妥和β-萘黄酮诱导过的大鼠原代肝细胞中毒性比较Fig. 3 Heptotoxicity of TAC in primary rat hepocytes with high CYPs activity compared with general primary rat hepatocytes |
 | 与对照组相比:*P < 0.05,**P < 0.01;与100 μmol/L TAC组相比:#P < 0.05 *P < 0.05, **P < 0.01 vs control group; #P < 0.05 vs 100 μmol/L TAC group 图 4 双氯芬酸钠在大鼠原代肝细胞和分别给予苯巴比妥和β-萘黄酮诱导过的大鼠原代肝细胞中毒性比较Fig. 4 Heptotoxicity of DIC in primary rat hepocytes with high CYPs activity compared with general primary rat hepatocytes |
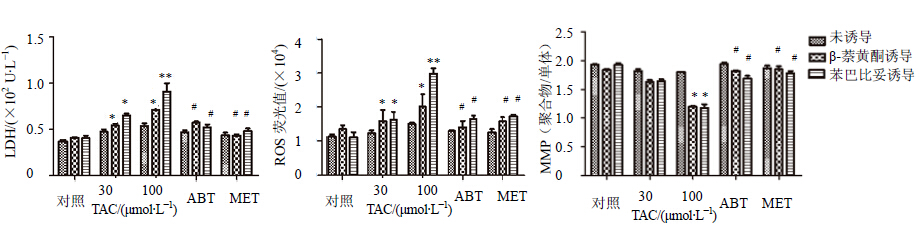 | 与对照组相比:*P < 0.05,**P < 0.01;与100 μmol/L TAC组相比:#P < 0.05 *P < 0.05, **P < 0.01 vs control group; #P < 0.05 vs 100 μmol/L TAC group 图 5 对乙酰氨基酚在大鼠原代肝细胞和分别给予苯巴比妥和β-萘黄酮诱导过的大鼠原代肝细胞中毒性比较Fig. 5 Heptotoxicity of PAR in primary rat hepocytes with high CYPs activity compared with general primary rat hepatocytes |
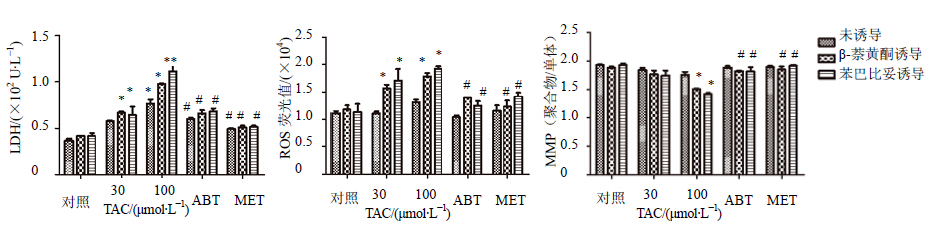
采用上述所构建的高CYPs酶活性大鼠原代肝细胞模型对维拉帕米的肝细胞毒性进行评价,不同的指标以不同浓度的他克林作为阳性对照。结果显示,与普通大鼠原代肝细胞组相比,100 μmol/L维拉帕米可引起高CYPs酶活性大鼠原代肝细胞上清液中LDH水平升高,细胞中ROS水平升高,MMP水平的下降,给予CYPs抑制剂ABT和MET后能抑制这种变化(图 6)。上清液中LDH和细胞中ROS水平,30 μmol/L的维拉帕米在苯巴比妥诱导的高CYPs酶活性大鼠原代肝细胞中即可产生显著的升高,在β-萘黄酮诱导的高CYPs酶活性大鼠原代肝细胞中则不能;100 μmol/L的维拉帕米可引起β-萘黄酮诱导的高CYPs酶活性大鼠原代肝细胞LDH和ROS升高,差异有显著性(P < 0.05),导致苯巴比妥诱导的高CYPs酶活性大鼠原代肝细胞LDH和ROS升高,差异有极显著性(P < 0.01)。ABT和MET能改变肝细胞损伤的发生。维拉帕米主要经CYP3A4代谢,因此苯巴比妥诱导的高CYPs酶活性大鼠原代肝细胞对维拉帕米肝毒性及其机制的评价更灵敏。
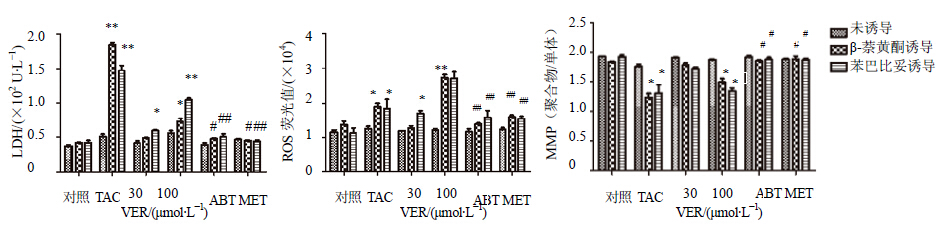 | 与对照组相比:*P < 0.05,**P < 0.01;与100 μmol/L TAC组相比:#P < 0.05 ##P < 0.05, *P < 0.05 , **P < 0.01 vscontrol group; #P < 0.05, ##P < 0.05 vs 100 μmol/L TAC group 图 6 维拉帕米在大鼠原代肝细胞和分别给予苯巴比妥和β-萘黄酮诱导过的大鼠原代肝细胞中细胞毒性结果Fig. 6 Heptotoxicity of VER in primary rat hepocytes with high CYPs activity compared with general primary rat hepatocytes |
大鼠原代肝细胞模型能快速方便的评价药物的肝细胞毒性,但在体外培养过程中原代肝细胞中CYPs酶的活性水平下降,从而导致细胞中酶对药物的代谢能力减弱。在药物致毒机制是基于CYPs酶代谢产生肝损伤且毒性较轻微的情况下,大鼠原代肝细胞则不能真实的反应此类药物的毒性,更不能准确的判断药物肝细胞毒性的机制。因此本研究建立一种高CYPs酶活性的大鼠原代肝细胞模型,这种细胞模型比普通的大鼠原代肝细胞更灵敏的考察药物肝毒性机制。
本研究结果显示,无论是对于细胞膜完整性的破坏,细胞中ROS的产生或是对MMP的影响,模型药物他克林、对乙酰氨基酚和双氯芬酸钠在分别经苯巴比妥和β-萘黄酮诱导过的高CYPs酶活性大鼠原代肝细胞模型中均呈现出比普通的大鼠原代肝细胞更严重的细胞毒性,CYPs酶广谱抑制剂ABT和MET能抑制损伤。苯巴比妥和β-萘黄酮均是CYPs酶的广谱诱导剂,但诱导结果各有侧重不同,如图 1所示,苯巴比妥对于CYP3A4的诱导能力 强[18],β-萘黄酮主要诱导CYP1A[19]。他克林主要由CYP1A2代谢,在β-萘黄酮诱导过的高CYPs酶活性大鼠原代肝细胞中显示出更强的毒性作用;双氯芬酸钠和对乙酰氨基酚被CYPs酶广谱代谢,主要经CYP3A4代谢产生肝毒性,但肝毒性发生具有偶然性,发生肝毒性的几率小于他克林的肝毒性发生。因此β-萘黄酮诱导过的高CYPs酶大鼠原代肝细胞可以更灵敏的考察他克林等主要经CYP1A代谢的药物毒性;苯巴比妥更适用于双氯芬酸钠和对乙酰氨基酚这种经广谱CYPs酶代谢或主要经CYP3A代谢产生毒性的药物的考察。维拉帕米在临床上有偶发性肝毒性报道,在普通的大鼠原代肝细胞中并未表现出细胞毒性,而其在高CYPs酶活性大鼠原代肝细胞模型中LDH、ROS和MMP 3种指标均显示维拉帕米具有肝细胞毒性,在经由苯巴比妥诱导的高CYPs酶活性大鼠原代肝细胞中能在较低浓度下产生毒性(30 μmol/L可使LDH和ROS升高),而β-萘黄酮诱导过的高CYPs酶活性大鼠原代肝细胞要在较高浓度下才产生毒性(100 μmol/L可导致LDH和ROS升高)。ABT和MET能抑制细胞损伤。从而可知维拉帕米的致毒机制是经CYPs酶代谢产生RMs导致,苯巴比妥诱导的大鼠原代肝细胞更适用于维拉帕米肝毒性的考察。因此,本实验所建立的高CYPs酶活性大鼠原代肝细胞模型可以更灵敏的评价经CYPs代谢产生肝毒性的药物。
| [1] | Feng S, He X. Mechanism-based inhibition of CYP450: an indicator of drug-induced hepatotoxicity[J]. Curr Drug Metab, 2013, 14 (9):921-945 . |
| [2] | 鄢良春, 张婷婷, 吴懿, 等. 苍耳子及苍术苷对大鼠原代肝细胞的毒性作用研究[J]. 中药药理与临床, 2012, 28(3): 36-39. |
| [3] | Zahno A, Bouitbir J, Maseneni S, et al. Hepatocellular toxicity of clopidogrel: mechanisms and risk factors[J]. Free Radic Biol Med, 2013, 65: 208-216 . |
| [4] | 顾立强, 马冰洁, 孟夏, 等. 中药肝毒性及肝脏保护作用的研究方法进展[J]. 中国药物警戒, 2013, 10(7): 408-410. |
| [5] | Valoti M, Fusi F, Frosini M, et al. Cytochrome P450-dependent N-dealkylation of L-deprenyl in C57BL mouse liver microsomes: effects of in vivo pretreatment with ethanol, phenobarbital, beta-naphthoflavone and L-deprenyl[J]. Eur J Pharmacol, 2000, 391(3):199-206 . |
| [6] | Heidar R, Babaei H, Roshangar L, et al. Effects of enzyme induction and/or glutathione depletion on methimazole-induced hepatotoxicity in mice and the protective role of N-acetylcysteine[J]. Adv Pharm Bull, 2014, 4(1): 21-28 . |
| [7] | Shi Q, Yang X, Greenhaw J, et al. Hepatic cytochrome P450s attenuate the cytotoxicity induced by leflunomide and its active metabolite A77 1726 in primary cultured rat hepatocytes[J]. Toxicol Sci, 2011, 122(2):579-586 . |
| [8] | Basile J. The role of existing and newer calcium channel blockers in the treatment of hypertension[J]. J Clin Hypertens, 2004, 6(11):621-629 . |
| [9] | Held C, Bjorkander I, Forslund L, et al. The impact of diabetes or elevated fasting blood glucose on cardiovascular prognosis in patients with stable angina pectoris[J]. Diabet Med, 2005, 22(10): 1326-1333 . |
| [10] | Galisteo M, Rissel M, Sergent O, et al. Hepatotoxicity of tacrine: occurrence of membrane fluidity alterations without involvement of lipid peroxidation[J]. J Pharmacol Exp Ther, 2000, 294(1):160-167. |
| [11] | Ramm S, Morissey B, Hernandez B, et al. Application of a discovery to targeted LC-MS proteomics approach to identify deregulated proteins associated with idiosyncratic liver toxicity in a rat model of LPS/diclofenac co-administration[J]. Toxicology, 2015[ahead of print]. |
| [12] | Jiang Y, Fan X, Wang Y, et al. Hepato-protective effects of six schisandra lignans on acetaminophen-induced liver injury are partially associated with the inhibition of CYP-mediated bioactivation[J]. Chem Biol Interact, 2015, 231(6):83-89 . |
| [13] | Yin J, Meng Q, Dong X. Auto-inhibition of verapamil metabolism in rat hepatocytes of gel entrapment culture[J]. Biomed Pharmacother, 2011, 65(5):328-333 . |
| [14] | Odeh M, Oliven A. Verapamil-associated liver injury[J]. Harefuah, 1998, 134 (1): 36-37 . |
| [15] | Seglen P O. Preparation of isolated rat liver cells[J]. Methods Cell Biol, 1976, 13: 29-83 . |
| [16] | 颜晶晶, 俸珊, 何丽娜, 等.延胡索乙素对映体对人肝微粒体细胞色素P450酶抑制作用机制研究[J]. 中草药, 2015, 46(4):534-540 . |
| [17] | 盛云华, 周绮, 姚广涛, 等. 酶生物标志物在肝毒性评价中的应用[J]. 医学综述, 2011, 17(8): 1121-1123 . |
| [18] | Sasaki E, Matsuo K, Iida A, et al. A novel mouse model for phenytoin-induced liver injury: involvement of immune-related factors and P450-mediated metabolism[J]. Toxicol Sci, 2013, 136(1): 250-263 . |
| [19] | Ohno M, Motojima K, Okano T, et al. Induction of drug-metabolizing enzymes by phenobarbital in layered co-culture of a human liver cell line and endothelial cells[J]. Biol Pharmac Bull, 2009, 32(5): 813-817. |
 2015, Vol. 38
2015, Vol. 38


