2. 武汉爱民制药有限公司, 湖北 鄂州 436070;
3. 湖北省天然组分药物工程技术研究中心, 湖北 鄂州 436070
2. Wuhan Aimin Pharmaceutical Co. Ltd., Ezhou 436070, China;
3. Hubei Engineering Technology Centre of Natural Component Medicine, Ezhou 436070, China
广地龙为钜蚓科动物参环毛蚓Pheretima aspergillum (E. Perrier) 的干燥体,其性味咸寒,有清热熄风、降压平喘、通络利尿之功效[1]。现代研究表明,地龙有溶栓[2]、抗肿瘤[3]、降压[4]等药理活性,其药用价值备受重视。研究发现地龙氨基酸含量及组成与其药理作用有很大关系[5, 6]。广地龙中含有丙氨酸、异亮氨酸、缬氨酸、亮氨酸、赖氨酸等多种氨基酸,成分复杂[7]。而在含地龙的中成药的工艺研究中,大多数仅仅采用测定单一或某几个氨基酸作为评价工艺优劣的指标。采用单一指标进行工艺评价是不能表征中药通过多成分、多途径、多环节、多靶点实现疗效的药效学特点的。
指纹图谱是近年来用于表征中药中多成分特征的分析方法[8, 9],以指纹图谱作为中药天然药物提取物及其制剂的质量控制方法已成为目前国际共 识[10]。本研究借鉴指纹图谱方法,采用异硫氰酸苯酯柱前衍生化反相高效液相色谱法[11, 12],建立了地龙氨基酸组分的HPLC指纹图谱,并用于考察地龙提取物不同干燥工艺下氨基酸组分的图谱变化,优选地龙氨基酸提取物的干燥工艺。
1 仪器与材料RE-5298旋转蒸发器(上海亚荣生化仪器厂);LYO-0.5(CIP)真空冷冻干燥机(上海东富龙科技股份有限公司);DZG-6020型真空减压干燥箱(上海森信实验仪器有限公司);HWZ-5B箱式微波真空干燥机(广州兴兴微波能设备有限公司);MA45红外水分测定仪(德国赛多利斯公司);安捷伦1260液相色谱仪系统(美国安捷伦公司);电子分析天平(梅特勒-托利多(上海)仪器有限公司);相似度软件为“中药色谱指纹图谱相似度评价系统”(中国药典委员会)。
17种混合氨基酸对照品溶液(门冬氨酸、谷氨酸、丝氨酸、甘氨酸、组氨酸、精氨酸、苏氨酸、丙氨酸、脯氨酸、胱氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、赖氨酸)、衍生试剂A(异硫氰酸苯酯-乙腈溶液)和衍生试剂B(三乙胺-乙腈溶液)均来自月旭公司氨基酸分析包。三水合醋酸钠(分析纯,国药集团化学试剂有限公司);冰醋酸(分析纯,国药集团化学试剂有限公司);乙腈(HPLC级,美国TEDIA试剂);正己烷(HPLC级,美国TEDIA试剂);实验用水为娃哈哈纯净水(杭州娃哈哈集团)。地龙药材经湖北省药学会中药鉴定分会陈科力教授鉴定为钜蚓科动物参环毛蚓Pheretima aspergillum (E. Perrier)的干燥体,产地、批号及来源见表 1。
| 表 1 地龙样品来源Table 1 Sources of Pheretima |
色谱柱为Ultimate Amino Acid AAA氨基酸分析柱(250 mm×4.6mm,5 μm);体积流量1.0 mL/min;柱温40 ℃;进样量5 μL;检测波长254 nm。流动相A为0.1 mol/L醋酸钠溶液(pH 6.5)-乙睛(93∶7);流动相B为水-乙腈(20∶80),二元梯度洗脱,洗脱条件见表 2。
| 表 2 梯度洗脱条件Table 2 Gradient elutionprogram |
取Welch公司17种氨基酸混合对照品溶液用水稀释至原来浓度的1/10倍作为对照品溶液。
2.2.2 地龙药材提取物的制备称取地龙粗粉10 g,加水100 mL,浸泡60 min,超声处理(250 W,50 Hz)60 min,12 000 r/min离心10 min,取上清液,备用。
2.2.3 地龙氨基酸提取物的不同干燥样品的制备以含水量低于5%为干燥标准,精密量取地龙药材提取物,分别采用真空减压干燥、真空冷冻干燥和微波干燥3种方式干燥地龙氨基酸组分提取物。
真空冷冻干燥工艺:预冻温度为−40 ℃,时间3 h;升华干燥温度20 ℃,升温时间2 h,时间为8 h;解析温度为40 ℃,时间为8 h;工作压力10~30 Pa。
真空减压干燥工艺:温度控制在40 ℃左右,真空度控制在−0.09 MPa,提取液的相对密度控制在1.25左右,时间为4 h。
微波干燥工艺:将金属温度探头置于样品表面测量温度,调节一定的微波功率进行辐射(通过间隙辐射控制温度在40 ℃以下)。
2.2.4 衍生步骤分别将A、B两种衍生试剂用稀释剂稀释至原来浓度的1/5倍,精密量取“2.2.1”项所制备对照品溶液1 mL,置于试管中,加入稀释后的A溶液0.5 mL和稀释后的B溶液0.5 mL,涡旋混合1 min,在50 ℃水浴中加热45 min,取出,加入正己烷溶液1 mL,振摇,涡旋混合1 min,静置30 min,吸取下层澄清液体,用孔径为0.45 μm有机滤膜滤过,即得。供试品溶液稀释到适宜浓度后的衍生步骤与对照品相同。
2.3 方法学考察 2.3.1 精密度试验取“2.2.4”项下的衍生化后供试品溶液,按照上述色谱色谱条件连续进样6次。将6次测定图谱转化为AIA格式后依次导入相似度软件,输出17个共有峰峰面积的RSD为0.12%~3.43%,保留时间的RSD为0.04%~0.31%,表明仪器精密度良好。
2.3.2 稳定性试验取“2.2.4”项下制备的同一份衍生化后供试品溶液,在上述色谱色谱条件下,分别在0、2、4、6、8、12、24、48、72 h进样,进行测定。测定图谱转化为AIA格式后依次导入相似度软件,输出17个共有峰峰面积的RSD为0.17%~2.81%,保留时间的RSD为0.03%~0.13%,实验结果表明样品在72 h内稳定。
2.3.3 重复性试验取“2.2.4”项下的平行制备的6份衍生化后供试品溶液,按照上述色谱色谱条件进行测定。测定图谱转化为AIA格式后依次导入相似度软件,输出17个共有峰峰面积的RSD为0.41%~3.58%,保留时间的RSD为0.03%~0.15%,实验结果表明方法的重复性良好,证明分析方法和提取工艺的稳定性和可靠性。
2.4 不同干燥工艺比较 2.4.1 样品测定及指纹图谱的建立按“2.2.2”项制备10批地龙药材提取物,按“2.2.4”项衍生化方法进行衍生化,按“2.1”项色谱条件进行测定,除衍生试剂外的其他色谱峰均积分。将10批地龙氨基酸组分提取物图谱导入相似度软件,计算相似度,10批地龙氨基酸组分提取物的相似度在0.99以上,说明提取工艺的稳定性和重复性良好。将地龙氨基酸组分提取物按“2.2.3”项的3种干燥工艺各制备干燥样品的供试品溶液各10批,按“2.2.4”项衍生化方法进行衍生化,按“2.1”项色谱条件进行测定,得到各供试样品。
2.4.2 指纹图谱分析氨基酸组分提取物及3种干燥工艺干燥样品经与17种氨基酸对照峰比较,发现地龙药材中含有17种游离氨基酸成分,峰1~17为地龙氨基酸组分提取物中含有的17种氨基酸成分,分别为门冬氨酸、谷氨酸、丝氨酸、甘氨酸、组氨酸、精氨酸、苏氨酸、丙氨酸、脯氨酸、胱氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、赖氨酸。其中谷氨酸、丝氨酸、精氨酸、丙氨酸、胱氨酸、蛋氨酸、酪氨酸、赖氨酸等含量较高,门冬氨酸、甘氨酸、组氨酸、苏氨酸、脯氨酸、缬氨酸、异亮氨酸含量较低,峰10胱氨酸在HPLC图谱中分离良好,含量较高且稳定,所以选择胱氨酸为参照峰。以胱氨酸为参照峰,共标示了17个共有峰。见图 1。
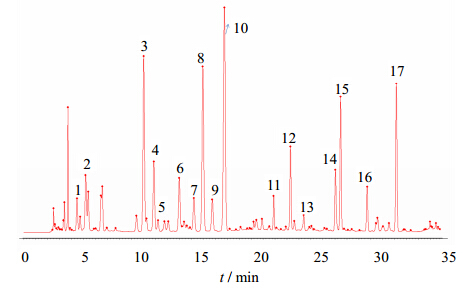 | 图 1 地龙氨基酸组分提取物参照图谱Fig. 1 Reference fingerprint of Pheretima amino acid components extract |
分别量取未经干燥样品以及3种干燥工艺制备的样品适量,按“2.2.4”项下衍生化方法制备供试品溶液,测定。运用指纹图谱软件处理,分别建立该4种样品的HPLC共有指纹图谱模式,以各工艺10批样品的HPLC指纹图谱共有模式与编号1样品的指纹图谱进行对比,结果见图 2,表明镜像度比较高。
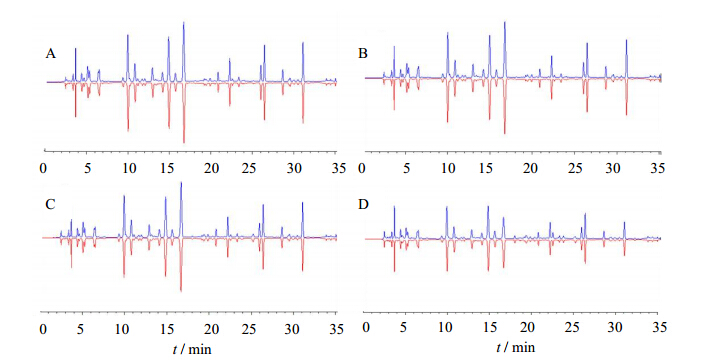 | A-原药材(未经干燥) B-冻干样品C-减压干燥样品 D-微波干燥样品 A-raw materials (undried) B-freeze-drying samples C- vacuum drying samples D-microwave drying samples图 2 不同干燥工艺制备提取物与共有模式图谱镜像对比Fig. 2 Common pattern fingerprint mirror of Pheretima amino acid components extract prepared by different drying processes |
将10批地龙氨基酸组分提取物图谱导入相似度软件,以未经干燥样品为参照,计算相似度。10批地龙原药材指纹图谱见图 3。
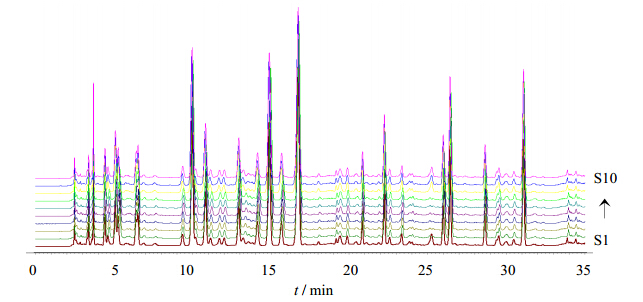 | 图 3 10批地龙提取物指纹图谱Fig. 3 HPLC fingerprint of 10 batches Pheretima amino acid components extract |
运用《中药色谱指纹图谱相似度评价系统》软件,对不同干燥工艺制备的10批样品检测结果进行相似度分析,以未经干燥的地龙药材氨基酸组分提取物图谱作为参照图谱,相似度分析包括相关系数法和夹角余弦法,结果见表 3,说明各干燥工艺制备的不同批次提取物均具有良好的相似性(>0.9)。其中冻干工艺样品的相似度均在0.99以上,减压干燥样品的相似度均在0.98以上,微波干燥样品的相似度均在0.93以上。从相似度分析结果可以看出,减压干燥和真空冷冻干燥方式均能较好的保持地龙氨基酸组分提取物的原有品质,结合外观性状等其他指标,真空冷冻干燥样品为淡黄色疏松块状物,且样品具有良好的复溶性,因此,真空冷冻干燥方法是更适合地龙氨基酸组分提取的干燥方式。
| 表 3 不同干燥工艺制备的提取物的相似度分析Table 3 Similarity analysis of extract prepared by different drying processes |
现阶段氨基酸分析中应用较广的是柱前衍生-高效液相色谱法。异硫氰酸苯酯[13, 14]作为衍生化试剂具有衍生产物单一、稳定,衍生副产物对HPLC测定无干扰,衍生化反应速度快,一、二级氨基酸均可被测定的优点,是目前应用较广泛的方法。本实验采用异硫氰酸苯酯作为柱前衍生化试剂来测定地龙氨基酸组分提取液中的氨基酸。
相似度分析结果充分显示了不同干燥工艺下地龙氨基酸组分提取物的质量差异,表明HPLC指纹图谱技术在中药提取物干燥工艺质量控制方面具有优势,能够较好的体现中药的整体疗效与物质总量的关系,可为中成药的工艺研究、中药材炮制研究提供参考。对比相似度分析结果可以看出冷冻干燥方法能够最大限度的保持地龙氨基酸组分提取液的品质,冷冻干燥法是地龙氨基酸组分提取液最适宜的干燥方法。
| [1] | 中国药典 [S]. 2010. |
| [2] | 毕燕芳, 马书林. 中药地龙中溶栓成分研究进展 [J]. 上海中医药杂志, 2004, 38(8): 60-62. |
| [3] | 余艳秋, 陈 洪. 蚯蚓提取物抗肿瘤作用的研究进展 [J]. 临床肿瘤学杂志, 2007, 12(3): 232-234. |
| [4] | 李承德, 康 白, 毛淑梅, 等. 地龙降压蛋白对自发性高血压大鼠血管紧张素及内皮素含量的影响 [J]. 中国医药导报, 2008, 5(21): 11-13. |
| [5] | 刘亚明, 郭继龙, 刘必旺, 等. 中药地龙的活性成分及药理作用研究进展 [J]. 山西中医, 2011, (3): 48-49. |
| [6] | 周 琼, 陆大祥, 付咏梅, 等. 甘氨酸对小鼠心肌缺血性损伤的防治作用研究 [J]. 中国病理生理杂志. 2002, (4): 25-27. |
| [7] | 裴福成, 李长新, 任桂萍. 柱前衍生HPLC法测定地龙中氨基酸的含量 [J]. 中医药学报, 2007, (3): 30-31. |
| [8] | 陈林伟, 秦昆明, 徐雪松, 等. 中药指纹图谱数据库的研究现状及展望 [J]. 中草药, 2014, 45(21): 3041-3047. |
| [9] | 李 强, 杜思邈, 张忠亮, 等. 中药指纹图谱技术进展及未来发展方向展望 [J]. 中草药, 2013, 44(22): 3095-3104. |
| [10] | 徐为公, 徐 鹏. 中药提取物的国际化策略 [J]. 中药研究与信息, 2005, 7(10): 34-34. |
| [11] | Checa-Moreno R, Manzano E, Mirón G, et al. Revisitation of the phenylisothiocyanate-derivatives procedure for amino acid determination by HPLC-UV [J]. J Sep Sci, 2008, 31(22): 3817-3828. |
| [12] | 杨 智, 阳利龙, 祝文兵, 等. 异硫氰酸苯酯柱前衍生化RP-HPLC法测定人血浆中10种氨基酸的浓度 [J]. 中国临床药理学与治疗学, 2011, (5): 75-78. |
| [13] | 宋志峰, 王 丽, 纪 锋, 等. 氨基酸分析中的柱前衍生技术 [J]. 吉林农业科学, 2004, 29(6): 54-58. |
| [14] | 杨 菁, 孙黎光, 白秀珍, 等. 异硫氰酸苯酯柱前衍生化反相高效液相色谱法同时测定18种氨基酸 [J]. 色谱, 2002, 20(4): 369-371. |
 2015, Vol. 38
2015, Vol. 38



