2. 中国医学科学院北京协和医学院药用植物研究所, 北京 100193;
3. 齐齐哈尔市中医医院, 黑龙江 齐齐哈尔 161000
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China;
3. Qiqihar City Hospital of Traditional Chinese Medicine, Qiqihar 161000, China
和厚朴酚(honokiol)是来源于厚朴等植物的一种含有酚羟基的小分子生物活性物质[1],作为木兰科植物的主要活性成分,具有抗氧化[2]、抗炎[3]、抗焦虑[4]、神经保护[5]、抗血小板凝聚[6]等多方面的药理活性。最近,研究者们不断发现和厚朴酚具有抗肿瘤作用,如诱导肿瘤细胞凋亡、促进肿瘤细胞 分化、抑制肿瘤细胞增殖、抑制肿瘤转移、抗肿瘤血管形成、逆转肿瘤多耐药等作用[7, 8]。但和厚朴酚不溶于水,难吸收,生物利用度较低,限制了其临床应用和疗效的发挥。将和厚朴酚制备成纳米制剂,能解决难溶性问题,提高生物利用度,静脉注射后还能因增强渗透滞留效应(enhanced permeability and retention effect,EPR)而对肿瘤组织具有一定的靶向性。目前,关于和厚朴酚的纳米制剂已有脂质体、胶束、固体脂质纳米粒等,但这些纳米粒的载药量均较低(<25%),药物传输效率受到限制。本文提供了一种高载药量和厚朴酚纳米粒的制备方法,并通过荷瘤小鼠的抑瘤实验证实具有较好的抗肿瘤效果且呈现剂量相关性。
1 仪器与试药 1.1 仪器KQ3200DB型数控超声波清洗器(昆山市超声仪器有限公司);Meppler Toledo AL204电子天平(梅特勒-托利多仪器(上海)有限公司);超净工作台;CO2孵育箱;酶标仪(El×800Bio2TEK Instruments);恒温水浴锅(江苏省金坛市江南仪器厂);CKX31型倒置显微镜(奥林巴斯(中国)投资有限公司);Zetasizer nano zs 90纳米粒度及zeta电位分析仪(马尔文仪器有限公司);LGJ—10B冷冻干燥机(北京四环科学仪器厂有限公司);U3000高效液相色谱仪(戴安中国有限公司);透射电镜(JEOL JEM—100CⅡ)。
1.2 试药与实验动物和厚朴酚(质量分数98%,陕西永源生物技术有限公司);和厚朴酚纳米粒(honokiol nanoparticles,自制);注射用环磷酰胺(CTX,山西普德药业股份有限公司,规格为200 mg/支);生理盐水(欣辰药业股份有限公司,规格为500 mL/瓶);RPMI1640培养基(Gibco l BRL公司);胎牛血清(BSA,北京元亨金马生物技术开发有限公司);DMSO(北京精求化工有限责任公司,分析纯);噻唑蓝(MTT)(美国Sigma公司);台盼蓝(Tyrpanblue,TB)(Amresco公司);胰蛋白酶-EDTA消化液(0.25%)(北京Solarbio科技有限公司)。
H22细胞系购自中国医学科学院基础医学究所;ICR小鼠100只,SPF级,雄性,6~8周龄,体质量18~22 g,购自北京维通利华实验动物技术有限公司,动物合格证:SCXK(京)2011-2119。
2 方法 2.1 和厚朴酚纳米混悬剂的制备精密称取BSA 50.0 mg、PVP 50.0 mg于烧杯中以20 mL水溶解,再精密称取和厚朴酚 100.0 mg于西林瓶中加4 mL丙酮溶解,在25 ℃、250 W超声、浆搅拌(300 r/min)的条件下,将和厚朴酚的丙酮溶液滴入水中,40 ℃减压旋转蒸发除去丙酮,以马尔文激光粒度仪测其粒径及粒度分布。
2.2 载药量和包封率的测定精密称取适量和厚朴酚,以乙腈溶解,配置成不同浓度。以乙腈-0.2%甲酸水(75∶25)为流动相,体积流量为1 mL/min,检测波长294 nm;柱温25 ℃;进样量20 μL,以峰面积为纵坐标,以质量浓度为横坐标进行线性回归,得到标准曲线方程:A=0.463 8C+0.122 5(R2=0.999 9)。结果表明,和厚朴酚在1~200 μg/mL与峰面积线性关系良好。
取10 mL和厚朴酚纳米粒将其冻干后,精确称重,加入适量乙腈溶解破坏纳米粒使药物释放出来,高效液相测定载入纳米粒内的药物含量,根据以下公式测定载药量(drug loading,DL)和包封率(entrapment efficiency,EE)。
EE(%)=(W1/W2)×100%
DL(%)=W1/W×100%
其中W1为实测的10 mL纳米粒中和厚朴酚的量,W2代表制备10 mL和厚朴酚纳米粒时药物的投料量,W代表所取10 mL和厚朴酚纳米粒冻干后的实测质量。
2.3 形态学观察室温条件下取和厚朴酚-Nps加水稀释100 μg/mL后滴加在覆盖碳膜的铜网上,自然干燥后,再滴加1%的磷钨酸溶液染色15~20 min,晾干。在透射电镜下观察并拍摄照片。
2.4 储存温度按“2.1”项制备和厚朴酚纳米粒(实测含和厚朴酚4.48 mg/mL),分别放置于室温和4 ℃下,测0、7、15、30 d后的粒径及分布和Zeta电位。
2.5 体外释放分别精密量取和厚朴酚纳米粒1 mL(按照实测和厚朴酚的量计5 mg)、和厚朴酚原料粉末5 mg及物理混合物(含和厚朴酚原料粉末5 mg、PVP 2 mg、BSA 2 mg)分别至透析袋中(MwCO为3 500),放置于50 mL释放介质(0.5% SDS/PBS,pH 7.4)中,37 ℃恒温振荡,于0.5、1、2、4、8、12、24、36、48、60、72 h取样1 mL,分别补加相同体积的释放介质,HPLC法测定释放介质中药物质量浓度,计算累计释放率。
2.6 H22 荷瘤小鼠模型的建立取腹腔内传代7 d的肝癌H22小鼠,在无菌条件下抽取肿瘤细胞,并用生理盐水洗涤3次,经0.2%台盼蓝染色后计算活细胞数>95%,调整细胞浓度为1×107/mL。选健康活泼ICR小鼠60只,雌雄各半,体质量18~22 g,于每只小鼠右侧腋窝皮下接种H22肝癌瘤细胞悬液0.2 mL,建立动物模型。
2.7 体内抗肿瘤药效研究接种肿瘤7 d后,将H22肝癌肿瘤小鼠随机分为6组,每组10只:阳性对照组(环磷酰胺5 mg/kg); 和厚朴酚纳米粒低、中、高剂量组(和厚朴酚纳米粒 10、20、40 mg/kg);各组均ip给药。另取10只健康小鼠为阴性对照组(ip 0.2 mL生理盐水);
每日观察各组小鼠活动、睡眠、毛发色泽和蜷曲脱落及死亡情况,并用电子秤测量小鼠的体质量变化(精确到0.1 g)。末次给药后处死小鼠,完整剥离腋窝皮下转移瘤体,称质量,计算抑瘤率。
抑瘤率=(对照组平均瘤质量-用药组平均瘤质量)/对照组平均瘤质量
2.8 统计学处理实验所得数据均以$\bar x \pm s$表示,以SPSS 15.0统计学软件分析。数据采用单因素方差分析,两组间比较采用LSD检验。
3 结果 3.1 和厚朴酚纳米粒的一般性状所制备的和厚朴酚纳米粒,采用马尔文激光粒度仪平均粒径为(116.50±2.63)nm,PDI为0.12±0.01,粒度分布较窄(图 1),实测药物浓度4.48 mg/mL,在电镜下呈现圆形或近圆形(图 2)。和厚朴酚纳米粒载药量(45.45±1.84)%,包封率(89.60±2.13)%,显著高于文献报道的载药量(25.70±2.70)%[9]。室温放置1周后,纳米粒平均粒径仅增加约10 nm,15 d后平均粒径增加50 nm,30 d后平均粒径从124 nm增加到215 nm;4°C放置稳定性稍好一些,15 d平均粒径增加33 nm,30 d增加约50 nm(表 1)。作为胶体分散体系,以上结果显示和厚朴酚纳米粒恒温储存稳定性尚可,在4°C储存更佳;但作为给药体系,长期储存需要冻干,临用前以注射用水分散。
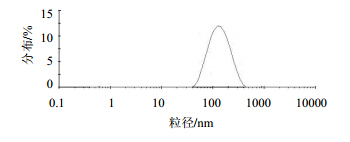 | 图 1 和厚朴酚纳米粒的粒径及分布图Fig. 1 Particle size and distribution of HK-Nps |
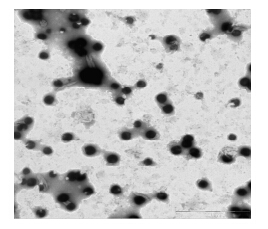 | 图 2 和厚朴酚纳米粒的透射电镜图Fig. 2 TEM photographs of HK-Nps |
| 表 1 和厚朴酚纳米粒在不同温度下放置不同时间后的粒径和粒度分布($\bar x \pm s$,n=3) Table 1 Mean particle size and distribution of HK-Nps after placement atdifferent time in different temperatures($\bar x \pm s$,n=3) |
以0.5%SDS/PBS(pH 7.4)为释放介质,和厚朴酚原粉、和厚朴酚纳米粒、物理混合物(和厚朴酚、PVP、BSA的物理混合物,比例与纳米粒中相同)的体外释放见图 3。可知,纳米粒较和厚朴酚原粉的释放速度和程度都显著提高,在第60小时,原料药释放仅有34.83%,而纳米粒释放已经达到96.29%。
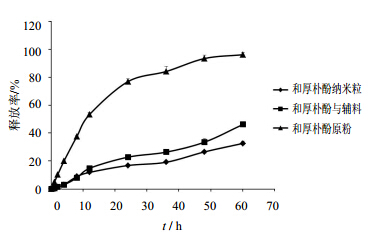 | 图 3 和厚朴酚纳米粒及原药粉末在PBS(pH 7.4)中的体外释放曲线 (n = 3)Fig. 3 In vitro release profiles of HK-Nps and HK-CS in PBS (pH 7.4) (n = 3) |
H22荷瘤小鼠在给药期间的体质量变化见图 4。可以看出,阴性对照组小鼠的体质量始终呈增长的趋势;和厚朴酚纳米粒高、中剂量和环磷酰胺组的小鼠体质量增长的速率较慢。在整个实验过程中各组均无小鼠死亡,但环磷酰胺组和和厚朴酚纳米粒高剂量组小鼠反应迟缓,体型相对瘦小,毛色有粘连,不光滑,有脱毛现象,这可能与环磷酰胺较强的副作用有关。
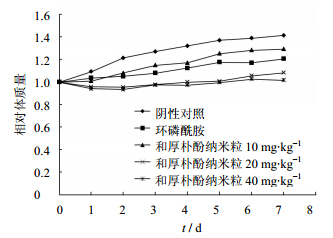 | 图 4 给药后各组小鼠的体质量变化 (n= 10)Fig. 4 Relative body weight change of the mice after ip administration with Saline, CTX solution and HK-Nps (n = 10) |
各个实验组对H22小鼠的抑瘤率实验结果见表 2。与阴性对照组相比,环磷酰胺组、和厚朴酚纳米粒高、中和低剂量的抑瘤作用差异极显著(P<0.01),抑瘤率分别为86.2%、71.2%、66.3%和52.5%。此研究结果说明和厚朴酚纳米粒对肿瘤的生长具有抑制作用。
| 表 2 和厚朴酚纳米粒对H22小鼠的抑瘤率 (n= 10) Table 2 In vivo antitumor effects of HK-Nps in H22 tumor-bearing mice (n = 10) |
本研究以BSA和PVP为辅料,采用超声-沉淀法成功制备高载药量的和厚朴酚纳米粒。和厚朴酚纳米粒平均粒径约120 nm,外观呈球形,载药量高达(45.45±1.84)%,实测药物浓度4.48 mg/mL,最高达到10 mg/mL,大大改善了其溶解性差、难于给药的缺点。现有和厚朴酚纳米给药系统载药量有限,如脂质体中不到2%[10];张卿[11]在和厚朴酚白蛋白纳米粒的处方研究中,载药量最高达到了21.2%,但从粒径等因素考虑最终用于后续研究的纳米粒载药量不到5%;另一篇和厚朴酚脂质体文献中,理论载药量达到了20%。迄今为止文献报道载药量最高的达到了25%[9, 12],但只有体外研究。本研究和厚朴酚纳米粒中,实测载药量达到了45%,这对给药剂量相对较大的天然药物将具有很好的适用性。
透射电镜(TEM)可以直接获得一个样本的投影,真实的反映了纳米粒子的形态及一定视野内的粒子大小。由图 2可知,本研究所制备的和厚朴酚纳米粒呈球形,粒径较小。透射电镜显示和厚朴酚纳米粒的粒径主要在50 nm左右,较用动态光散射测的粒径稍小。这是因为动态光散射所测得的是在水相中的水化动态半径,通常要较电镜观察到的干态纳米粒的粒径要大,尤其是当纳米粒外周有水化层(如PEG修饰)时更为明显。
由于较大的比表面产生了高表面能,载药纳米粒在储存过程中常会聚集、沉降,粒径增大甚至产生沉淀。本研究以粒径和粒度分布为指标对和厚朴纳米粒放置稳定性进行了考查。从表 2中,在30 d放置时间内,和厚朴酚纳米粒在室温和4 ℃下的平均粒径及PDI值均随时间延长稍有增大,但最终粒径仍在220 nm以内,低温储存粒径变化稍小。这一结果提示,若要较长时间储存,和厚朴纳米粒需要进行冻干保存。
由体外释放曲线(图 3)可知,将和厚朴酚制成纳米粒后,药物的释放显著加快,这是因为纳米粒具有很大的比表面积和表面能,从而具有更快的溶出速度和更高的溶出程度。将难溶性药物制备成纳米粒,已成为改善溶解性、提高溶出度的有效策略。以往研究中,和厚朴酚常和其他药物联合使用发挥抗肿瘤作用[13, 14, 15]。本研究单独使用高载药量的和厚朴酚纳米粒,在H22荷瘤小鼠身上表现出了不错的抗肿瘤作用,且呈剂量相关关系,这为和厚朴酚进一步用于肿瘤治疗研究奠定了基础。
从体质量增加的数据来看,中、高剂量的和厚朴酚纳米粒组体质量增加较环磷酰胺组要低;而且高剂量组和环磷酰胺组小鼠活动状态不佳,提示和厚朴酚纳米粒具有一定的毒副作用,其强度与剂量呈相关性。和厚朴纳米粒副作用的原因尚不明确,判断主要由和厚朴酚本身的性质引起,并推测可能与药物在纳米粒中的分布和状态有关。关于和厚朴酚静脉给药的毒副作用,因其溶解性差难于静脉给药,相关研究文献很少。有限的几个纳米给药系统(包括和厚朴酚脂质体等)体内抗肿瘤研究中,也未查阅到有价值的数据。这部分有待于未来进一步 研究。
腹腔注射的载药纳米粒,药物需要释放后才能吸收入血,故本文中的和厚朴酚在血液中其实不是以纳米粒的形式存在,纳米粒的EPR效应没有体现出来。和厚朴酚纳米粒的粒径不到200 nm,静脉注射后应当因EPR效应而具有对肿瘤的被动靶向性,从而有望提高对肿瘤抑制效果,并可能藉此降低给药剂量和毒副作用,静脉注射后肿瘤抑制的相关研究已计划于近期开展。同时,本课题组会选择和厚朴酚的敏感细胞株进行下一步实验,以期降低剂量,同时降低毒副作用。
| [1] | Ishitsuka K, Hideshima T, Hamasaki M, et al. Honokiol overcomes conventional drug resistance in human multiple myeloma by induction of caspase-dependent and independent apoptosis [J]. Blood, 2005, 106: 1794-1800. |
| [2] | Lo Y C, Teng C M, Chen C F, et al. Magnolol and honokiol isolated from Magnolia officinalis protect rat heart mitochondria against lipid peroxidation [J]. Biochem Pharmacol, 1994, 47: 549-553. |
| [3] | Liou K T, Shen Y C, Chen C F, et al. The anti-inflammatory effect of honokiolonneutrophils: mechanisms in the inhibition of reactive oxygen speciesproduction [J]. Eur J Pharmacol, 2003, 475: 19-27. |
| [4] | Kuribara H, Stavinoha W B, Maruyama Y. Honokiol, a putative anxiolytic agent extracted from magnolia bark, has no diazepamlike side-effects in mice [J]. J Pharm Pharmacol, 1999, 51: 97-103. |
| [5] | Lin Y R, Chen H H, Ko C H, et al. Neuroprotective activity of honokiol and magnolol in cerebellar granule cell damage [J]. Eur J Pharmacol, 2006, 537: 64-69. |
| [6] | Teng C M, Chen C C, Ko F N. Two antiplatelet agentsfrom Magnolia officinalis [J]. Thromb Res, 1988, 50: 757-765. |
| [7] | Hu J, Chen L J, Liu L, et al. Liposomal honokiol, a potent anti-angiogesis agent, in combination with radiotherapy produces a synergistic antitumor efficacy without increasing toxicity [J]. Exp Mol Med, 2008, 40(6): 617-628. |
| [8] | Luo H, Zhong Q, Chen L J, et al. Liposomal honokiol, a promising agent for treatment of cisplatin-resistant human ovarian cancer [J]. Cancer Res Clin Oncol, 134: 937-945. |
| [9] | 蔡 喆, 潘文合. 和厚朴酚泊洛沙姆F-127胶束的制备及其体外抗肿瘤研究 [J].中国现代应用药学, 2014, 31(2): 186-189. |
| [10] | 吴德强. 和厚朴酚脂质体的制备及表征 [J]. 实用中西医结合临床, 2014, 14(8): 86-88. |
| [11] | 张 卿. 和厚朴酚白蛋白纳米粒的制备及性质的初步考察 [D]. 重庆: 重庆医科大学, 2012. |
| [12] | 刘 屹. 和厚朴酚脂质体治疗卵巢癌的实验研究 [D]. 成都: 四川大学, 2007. |
| [13] | 周 行. 和厚朴酚联合阿霉素抗肿瘤的实验研究 [D]. 成都: 四川大学, 2006. |
| [14] | 王晓华. 和厚朴酚联合紫杉醇治疗小鼠lewis肺癌实验研究 [D]. 成都: 四川大学, 2006. |
| [15] | 汪琪琪. 和厚朴酚联合顺铂治疗人肺癌A549的实验研究 [D]. 成都: 四川大学, 2006. |
 2015, Vol. 38
2015, Vol. 38


