药物的致癌性实验是创新药物安全性评价和上市风险控制内容的重要组成部分,对于明显存在潜在致癌毒性的化合物,药政管理部门要求在早期进行致癌试验研究,用来支持后续的临床试验。而越来越多的证据表明,经典的2种啮齿类终身暴露致癌毒性评价体系存在诸多局限与缺陷。替代试验在 指导原则中的出现为致癌毒性研究带来了更加灵活多样的选择,也为致癌性试验的进步和发展带来了契机。自1996年转基因小鼠模型出现在ICH的指导原则中以来,美国FDA已经接受了一些使用转基因小鼠模型的致癌性试验[1, 2]。其中,rasH2和p53+/-两种转基因小鼠价值最为突出。与p53+/-小鼠只能用于评价遗传毒性致癌物质不同,rasH2转基因小鼠(Tg rasH2小鼠)同时适用于遗传毒性和非遗传毒性的致癌物,使用范围更广。该模型选用BALB/c小鼠和C57BL/6小鼠的杂交F1代,在基因中转入了多份与细胞增殖相关的c-Ha-ras基因拷贝,使得小鼠模型对致癌物质具有很强的敏感性[2],预测准确率可达到76%[3]。但目前,国内还没有对于这种模型开展相关研究的文献或数据。
在小鼠实验中,受其血容量限制,进行毒代动力学研究需要单独设立卫星组,且动物数量较多。在现阶段,使用Tg rasH2小鼠开展的短期致癌试验中,毒代卫星组通常选用转基因小鼠的同窝野生 型[4],而目前Tg rasH2小鼠模型和它的同野生型只有日本开发源公司能够培育、提供,都只能通过进口获得,运输不便而且价格昂贵,应用起来还存在一些需要解决的问题。
另外,药物毒性试验选用的动物模型如果与前期研究中的实验动物代谢特征相近,毒性试验的结果更具有连贯性和说服力。而且,致癌试验的剂量选择通常需要通过一批动物进行预实验来确定,而分批购买转基因小鼠周期长,代价高昂。所以,有必要对转基因小鼠和常用品系小鼠对药物代谢动力学的特点进行比较,以便于优化和简化试验的设计。
F3SM是军事医学科学院毒物药物研究所合成的新化合物,是一种新的PPARδ激动剂,化学名为2-[2-甲基-4-[4-[2-[4-(三氟甲基)苯基]嘧啶基]甲硫基]苯氧基]乙酸,主要药理作用为调节脂质代谢;口服利用度>85%,最佳有效剂量5~10 mg/kg。本文试验以F3SM为测试药物,初步比较Tg rasH2小鼠与C57小鼠两种动物单次给药后的代谢动力学特征,为更好地开展Tg rasH2小鼠研究工作提供有力的研究数据。 1 仪器与材料 1.1 主要仪器
美国Agilent QQQ 6410三联四极杆串联液相色谱﹣质谱联用仪(LC/MS/MS);色谱柱选用美国Agilent公司C-18柱(50 mm×2.1 mm, 3.5 μm)。 1.2 药物及主要试剂
F3SM,批号20130509,质量分数99.72%,由军事医学科学院毒物药物研究所提供;羧甲基纤维素钠,化学纯,批号20120928;国药集团化学试剂有限公司;F3SM溶液:用蒸馏水配制均匀的0.5%羧甲基纤维素钠溶液作为溶剂,将F3SM配制成6 mg/mL的混悬液;甲醇、乙腈为色谱纯,购于J&K Chemical Ltd.;超纯水由Milli-Q Reagent Water System(美国)制备;甲酸,分析纯,批号A20471,J. T. Baker。 1.3 动物
10周龄SPF级Tg rasH2小鼠4只,购于日本Nomura Jimusho公司,小鼠在出厂前6周龄时接受基因型检测,确定转入人源c-Ha-ras基因。10周龄SPF级C57小鼠4只,购于北京维通利华实验动物技术有限公司。
小鼠饲养于军事医学科学院国家北京药物安全评价研究中心屏障设施内,实验设施合格证号为SCXK-(军)2012-0019。室温控制在20~25 ℃,湿度40%~70%,12 h照明,12 h黑暗。饲养方式为笼养,每笼2只,Tg rasH2小鼠单独房间饲养。
本中心动物屏障设施经国际实验动物评估和认可管理委员会(Association for Assessment and Accreditation of Laboratory Animal Care,AAALAC)认可,也完全遵守中华人民共和国的相关实验动物福利的管理规定。动物试验方案均经过本中心的动物福利委员会(Institutional Animal Care and Use Committee,IACUC)审查,批准后方可开始试验。 2 方法与结果 2.1 血样采集
选用相同周龄的C57小鼠、Tg rasH2小鼠各4只,ig给予相同剂量(60 mg/kg)的F3SM羧甲基纤维素钠溶液。在给药后5、15、30 min和1、3、10、24 h,共7个时间点进行采血,采血量≥40 μL,采血方式为颌下静脉采血。 2.2 样品前处理方法
血样采入肝素抗凝管中,将采血管缓慢转动使血样与抗凝剂充分混匀。样品以3 000 r/min、4 ℃离心10 min,分离血浆;拟用10 μL血浆/时间点。移出血浆于-80 ℃冻存备测。 2.2.1 标准血浆样品
取空白小鼠血浆样品10 μL,加入F3SM 10 μL系列标准溶液,40 μL乙腈溶液(含内标紫杉醇 500 ng/mL),混旋1 min,13 000 r/min离心10 min。取上清液30 μL,进样5 μL用于LC/MS/MS分析。 2.2.2 待测血浆样品
取血浆样品10 μL,加入10 μL甲醇和40 μL乙腈溶液(含内标紫杉醇500 ng/mL),混旋1 min,13 000 r/min离心10 min。取上清液100 μL,进样5 μL 用于LC/MS/MS分析。 2.3 生物样品中F3SM测定方法的建立 2.3.1 色谱条件
Agilent C-18柱(50 mm×2.1 mm, 3.5 μm);流动相为水-乙腈-0.1%甲酸(35∶65∶0.1);体积流量0.3 mL/min;柱温23 ℃。 2.3.2 质谱条件
离子化方式:电喷雾(ESI);喷雾电压为4 000 V;喷雾压力137.895 kPa;温度350 ℃。F3SM和内标检测的m/z分别为435.1和876.3。选择性离子(SRM)方式检测m/z 435.1的碎片离子为m/z 269.1和238.1(碎裂电压30 V);m/z 876.3的碎片离子为m/z 591.3和308.1(碎裂电压25 V)。 2.4 测定生物样品中F3SM方法学考察 2.4.1 标准曲线
分别精密吸取C57小鼠和Tg rasH2小鼠血浆10 μL,分别加入含F3SM系列工作液,混匀后制成含F3SM治疗浓度范围为5~5 000 μg/L的标准样品,方法参见“1.5.1”操作步骤,然后按“1.6.1”色谱条件进行分析。在本研究样品的处理方法和色谱条件下,在F3SM保留时间处无干扰峰出现(图 1),C57小鼠血浆样品和Tg rasH2小鼠血浆样品在F3SM 5~5 000 μg/L线性关系良好。标准曲线方程为Y=7.144 3X+0.048 2(C57小鼠,r2>0.99);Y=7.43 6 9X+0.052 0(Tg rasH2小鼠,r2>0.99)。
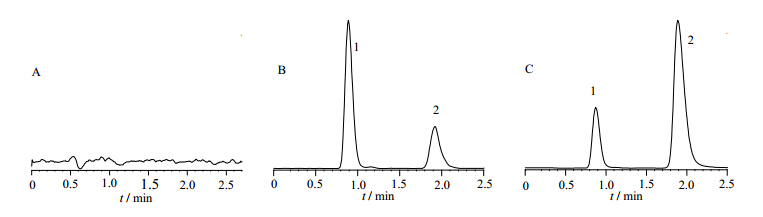 | 1- F3SM; 2- 紫杉醇
1- F3SM; 2- Taxol 图 1 C57小鼠空白血浆(A)、对照品F3SM和内标紫杉醇(B)及给予F3SM后5 min血浆样品(C)的色谱图Fig. 1 Chromatograms of blank plasma (A), reference substance F3SM and internal satandard Taxol (B), and plasma sample after administration at 5 min (C) in C57 mice |
按上述方法制备分别含F3SM 20、200、4 000 μg/L的质控样品,以相同方法处理后进样分析。比较以上样品于日内5次测定的F3SM浓度变化,计算日内精密度;连续测定3 d,计算日间精密度。F3SM在两种小鼠血浆中的日内、日间RSD均<10%,说明F3SM在C57和Tg rasH2小鼠血浆中精密度符合检测要求(表 1、2)。
| 表 1 F3SM在C57小鼠和Tg rasH2小鼠血浆中的日内精密度(x±s, n = 15) Table 1 Intraday precision of F3SM in plasma of C57 and Tg rasH2 of mice (x±s, n = 15) |
| 表 2 F3SM在C57小鼠和Tg rasH2小鼠血浆中的日间精密度(x±s, n = 15) Table 2 Interday precision of F3SM in plasma of C57 and rasH2 mice (x±s, n = 15) |
制备在小鼠血浆中含F3SM 20、200、4 000、5 000 μg/L的血浆样品,分别考察室温保存(4 h),在-20 ℃下放置30 d以及样品经处理后放置10 h后的稳定性。所有样品的标准偏差绝对值均小于5%,表明小鼠血浆中F3SM在上述条件下均稳定。 2.4.4 回收率
按上述方法制备分别含F3SM 20、200、4 000 μg/L的质控样品,以相同方法处理后进样分析。比较以上样品于日内5次测定的峰面积变化,计算日内精密度。同时将峰面积代入标准曲线方程,计算F3SM浓度,与加入浓度相比较,求得方法回收率,用以表示分析方法准确度。
| 表 3 F3SM在C57小鼠和Tg rasH2小鼠血浆中的回收率 (x±s, n = 15) Table 3 Recovery rate of F3SM in plasma of C57 and rasH2 mice (x±s, n = 15) |
质谱数据分析采用“Agilent MassHunter Quantitative Analysis”软件数据处理系统;药物代谢动力学参数分析采用“DAS实用药代动力学程序2.0”分析软件,用房室模型和统计矩方法计算Tg rasH2小鼠和C57小鼠单次ig给药F3SM的主要代谢动力学参数;代谢动力学参数间统计差异分析采用“SPSS statistics 19.0”进行统计学比较分析。
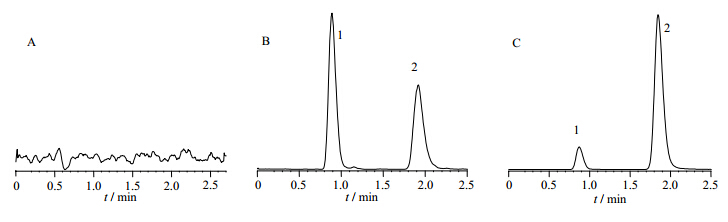 | 1- F3SM; 2- 紫杉醇
1- F3SM; 2- Taxol 图 2 Tg rasH2小鼠空白血浆(A)、对照品F3SM和内标紫杉醇(B)及给予F3SM后5 min血浆样品(C)的色谱图Fig. 2 Chromatograms of blank plasma (A), reference substance F3SM and internal satandard Taxol (B), and plasma sample after administration at 5 min (C) in Tg rasH2 mice |
对两种小鼠单次给药后的AUC(0-t)、MRT(0-t)、t1/2、Tmax和Cmax采用t检验进行分析,其差异均无统计学意义(P>0.05),说明本次试验中两种小鼠对药物F3SM的代谢动力学参数无显著差异(表 4)。
| 表 4 单次给予两种小鼠F3SM(60 mg∙kg-1)后的药动学参数(x±s, n = 4) Table 4 Pharmacokinetic parameters in blood of 2 species mice after single administration of F3SM (60 mg∙kg-1) (x±s, n = 4) |
对两种小鼠单次给予F3SM后5、15、30 min及1、3、10、24 h 7个时间点的血药浓度做出血药浓度–时间曲线,显示给药后的趋势基本一致,差异不显著(图 3)。
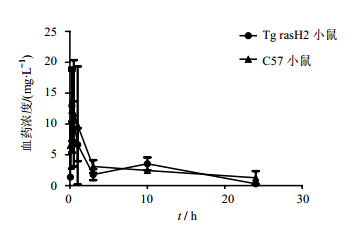 | 图 3 单次给予两种小鼠F3SM(60 mg∙kg-1)后的药-时曲线(n = 4)Fig. 3 Concentration-time profile of F3SM (60 mg∙kg-1) after administration (n = 4) |
本试验中,对C57小鼠与Tg rasH2小鼠单次给予F3SM后的几项基本代谢动力学参数进行比较,结果表明,两种小鼠对于受试药物F3SM代谢特征相近,提示了药物在C57小鼠体内的代谢情况外推至转基因小鼠模型的可能性。目前,已有对于Tg rasH2小鼠及其野生型之间代谢特征的研究[5],而对 转基因小鼠和亲代动物之间的代谢特征研究较少。更完整的代谢对比,还需要对两种动物的代谢酶系的诱导情况进行系统地比较[6, 7, 8],这一部分内容将作为本课题组下一步的研究方向。
确定C57小鼠与Tg rasH2小鼠对药物的代谢无差异,能够帮助致癌试验的剂量摸索直接参考药物前期研究中的小鼠试验数据,能够使受试药物的药效学研究与毒性研究更加连贯,在将来外推至临床试验用药剂量时更加具有参考价值;并且可以使用C57小鼠进行致癌试验剂量选择的预实验,为转基因小鼠试验的设计提供直接依据;另外还可能使用C57小鼠代替转基因小鼠野生型作为Tg rasH2小鼠短期致癌试验中的毒代卫星组,提供药物代谢动力学数据。这样,目前价格昂贵、运输繁琐的Tg rasH2小鼠模型推广使用的便利程度将大大提高,也能使应用新模型的成本大量减少。对两种小鼠代谢特征的比较,是对转基因小鼠模型的初步探索,期望能为新模型的应用提供有用的支持条件。
| [1] | Song Z, Xu J H, Wang Q L, et al. Genetically modified mouse models in carcinogenicity assessment of pharmaceuticals [J]. Chin J Pharmacol Toxicol, 2010, 24(6), 557-561. |
| [2] | Daniel M, Carl L A, Arthur J R, et al. The Tg rasH2 mouse in cancer hazard identification [J]. Toxicol Pathol, 2002, 30(1): 139-146. |
| [3] | Storer R D, sistare F D, Reddy M V, et al. An industry perspective on the utility of short-term carcinogenicity testing in transgenic mice in pharmaceutical development |
| [4] | Norikazu T. The rasH2 transgenic mouse: nature of the model and mechanistic studies on tumorigenesis [J]. Toxicol Pathol, 2001, 29(Suppl.): 81-89. |
| [5] | Yasuyuki O, Toshiro A, Miho K, et al. Induction of drug metabolism-related enzymes by methylcholanthrene and phenobarbital in transgenic mice carrying human prototype c-ha-ras gene and their wild type littermates [J]. Exp Anim, 2001, 50(1): 33-39. |
| [6] | Liu J, Li M C, Wang P P, et al. Chronopharmacokinetics of erlotinib in tumor-bearing mice [J]. Chin J Pharmacol Toxicol, 2014, 28(3): 403-407. |
| [7] | Gollapudi B B, Stott W T, Yano B L, et al. Mode of action considerations in the use of transgenic animals for mutagenicity and carcinogenicity evaluations [J]. Toxicol Lett, 1998, 103: 479-484. |
| [8] | Itoh K, Chiba T, Takahashi S, et al. An Nrf/Small Maf heterodimer mediates the induction of phase Ⅱdetoxifying enzyme genes through antioxidant response elements [J]. Biochem Biophys Res Commun, 1997, 236: 313-322. |
 2015, Vol. 38
2015, Vol. 38


