近年来,血瘀证研究已成为中西医结合学术研究最见成效、最受国内外关注的领域之一,尤其在心血管系统、血液系统疾病等方面取得了许多宝贵的经验及成就。从民族药物中寻找具有抗血瘀证疗效的药物备受关注。
龙血竭胶囊是由龙血竭单味药材制成的制剂,具有活血散瘀、定痛止血、生肌敛疮等功效,临床用于治疗外科、妇科、内科、皮肤科等多种病症。近年来有研究表明,龙血竭及其提取物总黄酮有抗血栓、抗体内外血小板聚集作用[1],并可以改善急性动物兔模型的血流变特征[2],但对慢性血瘀证及其机制研究报道比较少。因此,本实验从龙血竭胶囊内容物提取总黄酮类成分,建立慢性血瘀证兔模型,研究龙血竭及其总黄酮类成分对慢性血瘀证兔模型的血液流变学指标、一氧化氮(NO)/内皮素(ET)平衡以及心主动脉内皮细胞的影响,初步探讨龙血竭胶囊活血化瘀的有效部位及作用机制。 1 材料和方法 1.1 主要药物及试剂
龙血竭胶囊,西双版纳雨林制药有限责任公司,批号230607;龙血竭总黄酮由本实验室自制[3],质量分数为77.36%;复方丹参片,广州白云山和记黄埔中药有限公司,批号H1A016;高分子葡聚糖(Dextran T-500),Pharmacia,批号17032001;牛血清白蛋白(albumin bovine V),Spain;盐酸肾上腺素注射液,远大医药(中国)有限公司,批号120907;胆固醇(Cholesterol),Amresco;乌来糖,国药集团化学试剂有限公司,批号20120810;NO试剂盒,南京建成生物工程研究所,货号A012;兔ET酶联免疫试剂盒,武汉博士德生物工程有限公司,货号AE9065。 1.2 动物
日本大耳朵白兔72只,普通级,体质量(1.8~2.2)kg,由武汉生物制品研究所有限责任公司提供,许可证号SCXK(鄂)2008-0003。 1.3 仪器
SA-7000型全自动血液流变测试仪(西安百特医学工程有限公司);LG-PABER型血小板聚集及凝血因子分析仪器(北京世帝科学仪器公司);Leica Rm2265型超薄切片机(德国);Leica EG0050H包埋机(德国);Leica DMIL倒置显微镜系统(德国);TGL-20M高速冷冻离心机(长沙平凡仪器仪表有限公司)。 1.4 造模方法
实验动物房温度为(22±2)℃,湿度为45%~75%,12 h的交替日光灯照明。动物进行1周适应性饲养期后进入实验。
模型建立如下[4]:实验兔随机分为正常组、模型组、阳性组(复方丹参片,500 mg/kg−1)及龙血竭高(800 mg/kg)、中(400 mg/kg)、低(200 mg/kg)剂量组以及龙血竭总黄酮高(500 mg/kg)、中(250 mg/kg)、低(125 mg/kg)剂量组,共9组,每组8只。各组均给予正常饮食,除正常组外,其他组每天每只另加服胆固醇0.5 g。正常组外的其他组每周一、周四耳缘iv 10%高分子葡聚糖5 mL/kg,每周二、周五iv去甲肾上腺素50 μg/kg,每周三、周六将兔放进水深10 cm的冰水方盒中冰水刺激10 min,每周日在兔清醒状态下局部消毒后剪脚爪一个。除正常组外,实验第1周末各组iv牛血清白蛋白0.25 g/kg,间隔10 d再静注1次。正常组iv等体积生理盐水,但不加服胆固醇、不冰水刺激和剪爪。阳性组及龙血竭高、中、低剂量组和龙血竭总黄酮高、中、低剂量组在造模的同时每日ig给予相应药物。
实验进行4周结束时,禁食24 h,20%乌拉坦麻醉,腹主动脉取血供血液流变学指标检测和血清NO和ET水平的检测;手术解剖、摘取心脏主动脉,用生理盐水清洗后浸泡于10%中性福尔马林溶液中供制作HE染色病理切片。 1.5 各组兔血液流变学指标检测
实验结束时,取肝素抗凝血,应用全自动血液流变分析仪检测全血黏度、血浆黏度、血细胞压积、红细胞聚集指数、红细胞变形指数以及卡森黏度等血液流变学指标。 1.6 各组兔血小板聚集率的检测
将3.8%的枸椽酸钠抗凝的血液以800 r/min离心10 min,收集上层富血小板血浆(PRP),剩余血液以3 000 r/min离心10 min,取贫血小板血浆(PPP)。采用比浊法测定,致聚集剂为二磷酸腺苷(APD),浓度为5 μmol/L,在LG-PABER型血小板聚集及凝血因子分析仪记录最大聚集率并根据下面公式计算抑制率。
聚集抑制率=(模型组最大聚集率−给药组最大聚集率)/模型组最大聚集率 1.7 各组兔血清NO和ET浓度的检测
各组兔血液4 000 r/min离心15 min分离血清,用兔ET酶联免疫试剂盒检测血清中NO和ET的含量。 1.8 各组兔心主动脉内皮组织HE切片的制作及观察
心主动脉浸泡于10%中性福尔马林溶液中固定24 h后,取出用自来水冲洗3 h,然后梯度乙醇脱水,行常规石蜡包埋及切片制作,作HE染色后,镜下观察各组兔心主动脉内皮细胞形态学变化并拍摄图像。 1.9 统计学处理
实验数据以x±s表示,采用SPSS 11.5软件进行单因素方差分析比较组间差异及事后检验比较。 2 结果 2.1 龙血竭及其总黄酮类成分对慢性血瘀证兔模型血液黏滞性指标的影响
表 1所示,与正常组比较,模型组全血黏度和血浆黏度都显著升高。给药治疗后,与模型组比较,龙血竭高、中、低剂量组和龙血竭总黄酮高、中、低剂量组均能成剂量关系的降低全血黏度和血浆黏度,其中阳性组降低全血黏度和血浆黏度作用最强,其次是龙血竭总黄酮高剂量组,之后是龙血竭高剂量组;龙血竭高、中、低剂量组与龙血竭总黄酮高、中、低剂量组组间比较发现差异无统计学意义,两者效果相当。
| 表 1 龙血竭及其总黄酮类成分对慢性血瘀证兔模型血液黏滞性指标的影响(x±s±s, n = 8) Table 1 Effectsof Sanguis draxonis and its total flavonoids on blood viscosity index in rabbit model of chronic stasis syndrome (x±s±s, n = 8) |
龙血竭高、中、低剂量组和龙血竭总黄酮高、中、低剂量组均能成剂量相关性降低红细胞压积、红细胞聚集指数和卡森黏度,升高红细胞变形指数;同模型组比较,龙血竭总黄酮高剂量组能显著地降低红细胞压积、红细胞聚集指数和卡森黏度(P<0.01),也能显著地升高红细胞变形指数(P<0.01);此外,龙血竭高、中、低剂量组与龙血竭总黄酮高、中、低剂量组组间比较,差异无统计学意义,两者效果相当(表 2)。
| 表 2 龙血竭及其总黄酮类成分对慢性血瘀证兔模型血液流变性的影响 (x±s±s, n = 8) Table 2 Effectsof Sanguis draxonis and its total flavonoids on hemorheology in rabbit model of chronic stasis syndrome (x±s±s, n = 8) |
从表 3可以看出,龙血竭与龙血竭总黄酮均有一定的抗血小板凝集作用。通过比较各给药组对慢性血瘀证兔模型血小板的聚集抑制率发现,阳性组抑制率最大,而龙血竭总黄酮高剂量组、龙血竭高剂量组抑制率也很高,分别比阳性组降低3.68%、6.03%;龙血竭总黄酮高、中、低剂量组组内有显著的差异性(P<0.01),且成剂量相关性;龙血竭高、中、低剂量组也有剂量相关性;龙血竭总黄酮高、中、低剂量组与龙血竭高、中、低剂量组组间比较,差异无统计学意义,两者效果相当。
| 表 3 龙血竭及其总黄酮类成分对慢性血瘀证兔模型血小板聚集率的影响 (x±s±s, n = 8) Table 3 Effectsof Sanguis draxonis and its total flavonoids onplatelet aggregation rate in rabbit model with chronic stasis syndrome(x±s±s, n = 8) |
从表 4可以看出,模型组NO水平比正常组降低,而ET水平则升高;与模型组比较,各给药组NO水平均有所升高,其中阳性组、龙血竭高剂量组和龙血竭总黄酮高剂量组分别升高36.94%(P<0.01)、15.39%(P<0.05)和27.70%(P<0.01),而ET水平均有所降低,分别降低40.88%(P<0.05)、33.10%(P<0.05)和37.83%(P<0.01);龙血竭高、中、低剂量组与龙血竭总黄酮高、中、低剂量组均能成剂量相关性上调慢性血瘀证兔模型血清NO水平,下调ET-1水平。
| 表 4 龙血竭及其总黄酮类成分对慢性血瘀证兔模型血清 NO和ET水平的影响 (x±s±s, n = 8) Table 4 Effectsof Sanguis draxonis and its total flavonoids onserumNO and ET levels in rabbit model with chronic stasis syndrome (x±s±s, n = 8) |
镜下观察,正常组兔心主动脉内皮细胞连续完整而光滑,排列平行有序;模型组兔心主动脉内皮 细胞则完全失去了平行密集有序的排列方式,表面粗糙,脂肪颗粒及空泡增多,内皮细胞形态损伤明显,细胞大小不一,多呈球形和不规则形,边缘不清晰,极少见到正常长梭形的细胞;各给药组内皮细胞形态都有不同程度的损伤,损伤程度介于正常组与模型组之间,其中阳性组损伤最小,其次是龙血竭总黄酮高剂量组,次之是龙血竭高剂量组;龙血竭高、中、低剂量组和龙血竭总黄酮高、中、低剂量组的组内比较发现,心主动脉内皮细胞形态损伤程度有一定的剂量相关性(图 1)。
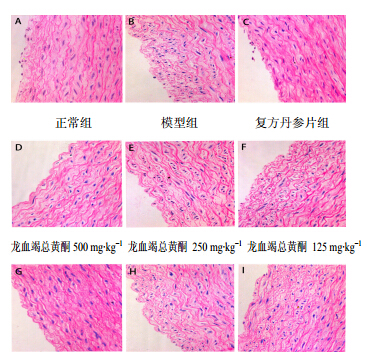 | 图 1 各组家兔心主动脉组织HE染色病理切片图Fig. 1 Pathological slices of heart aorta tissue of rabbits in each group by HE staining |
血瘀证是多种原因造成的与血液循环障碍有关的诸多疾病的总称,而形成血瘀后又可以引发多种更严重的病变,主要表现在微循环障碍、血液流变学异常及血液动力学异常[5]。临床上主要症状为舌暗有瘀点或瘀斑、舌腹静脉曲张、唇瘘舌青、口燥但欲漱水不欲咽、疼痛夜甚或痛处不移、脉微大来迟或涩等,严重影响患者的健康和生活质量[6]。血瘀证在血液流变学、凝血功能、血小板聚集及释放、微循环障碍、血液动力学等方面主要表现为血液流变性出现血浆及全血黏稠增高,红细胞变形能力、红细胞压积的改变,血小板聚集增高,微循环障,血栓形成导致血液动力障碍等[7, 8, 9]。然而,目前所制作的血瘀证动物模型主要以急性为主,且多为单一因素造模,而血瘀证实际上是一个由多因素参与的慢性病理过程。因此本实验利用多因素建立慢性血瘀证兔模型,以便模拟出血瘀证的病因病机。本文中龙血竭剂量是根据龙血竭胶囊临床用量折算成家兔用量,再经预实验确定,而龙血竭总黄酮剂量是根据龙血竭总黄酮产率折算并经预实验确定,因而龙血竭和龙血竭总黄酮在剂量上是等效的。结果显示,龙血竭和龙血竭总黄酮均能降低慢性血瘀证兔模型全血和血浆黏度、红细胞压积、红细胞聚集指数和卡森黏度,升高红细胞变形指数,对血小板聚集有很好的抑制作用,但组间比较发现以上各指标无统计学差异,两者效果相当,这些表明龙血竭胶囊有改善慢性血瘀证兔模型的血液流变学特性,具有活血化瘀功效,其主要活性部位是总黄酮类成分。
近年来,随着对血瘀证的病理生理研究不断深入,大量研究表明血瘀证与血管内皮细胞损失有相关性,并把NO/ET指标列为血瘀证实验室诊断标准内,是研究血瘀证的重要指标之一[10, 11]。血管内皮细胞作为内分泌器官,能合成和分泌主要舒血管物质NO与主要缩血管物质ET,NO/ET是一对维持血管壁基础张力的细胞因子,共同维持血管及血液内环境的平衡,调节平滑肌张力和血管舒缩的功能。ET/NO比例失调则有可能导致体内血管内皮细胞内分泌功能紊乱、血管内皮受损及通透性改变,同时还会引发血液成分、血流变性的变化,表现为血瘀证的特性。临床数据表明[12, 13],血瘀证患者血清ET水平明显高于非血瘀证患者,而NO水平明显低于非血瘀证患者。本实验结果显示,龙血竭总黄酮能较好地降低慢性血瘀证兔模型血清ET水平(P<0.01),升高NO水平(P<0.01);心主动脉内皮组织病理切片显示,龙血竭总黄酮能保护慢性血瘀证兔模型心主动脉内皮细胞受损失,利于内皮细胞分泌NO与ET因子趋于平衡状态,维持血液内环境的稳态,从而发挥活血化瘀的作用,这可能是其发挥抗慢性血瘀证的机制之一。
本研究结果表明,一方面,龙血竭和龙血竭总黄酮均能改善慢性血瘀证兔模型血液流变学特性,保护慢性血瘀证兔模型心主动脉内皮细胞,维持NO/ET平衡,这些可能是龙血竭胶囊抗慢性血瘀证的机制之一;另一方面,龙血竭和龙血竭总黄酮抗慢性血瘀证活性效果相当,这表明是龙血竭胶囊抗慢性血瘀证的主要活性部位为总黄酮类成分。通过本文研究,希望对龙血竭胶囊在慢性血瘀证的临床应用提过科学的理论依据。
| [1] | 马建建, 宋 艳, 贾 敏, 等. 血竭总黄酮对血小板聚集、血栓形成及心肌缺血的影响 [J]. 中草药, 2002, 33(11): 1008-1010. |
| [2] | 黄树莲, 陈学芬, 陈晓军, 等. 广西血竭总黄酮活血化瘀作用的研究 [J]. 广西医学, 1996, 18(1): 1-2. |
| [3] | Chen F F, Xiong H, Wang J X, et al. Antidiabetic effect of total flavonoids from Sanguis draxonis in type 2 diabetic rats [J]. J Ethnopharmacol, 2013, 149: 729-736. |
| [4] | 武继彪, 隋在云, 许复郁. 慢性血瘀证动物模型的建立及其血液流变学的变化 [J]. 中药药理与临床, 2001, 17(5): 45-46. |
| [5] | 郭玉明, 姜 淼, 吕爱平. 中医证候分类研究进展 [J]. 中国中医药信息杂志, 2011, 18(7): 106-109. |
| [6] | 时 晶, 田金洲, 王永炎, 等. 血瘀证的生物学基础研究 [J]. 中华中医药杂志, 2006, 21(6): 363-364. |
| [7] | 潘洪平, 杨嘉珍, 李吕力, 等. 葛根素注射液对急性血瘀模型大鼠血液流变性改善作用的实验研究 [J]. 中国中药杂志, 2001, 28(12): 1178-1180. |
| [8] | 赵 玲, 胡昌江, 潘 新, 等. 下瘀血汤中大黄生熟互换对热结血瘀模型大鼠血管内皮功能及微循环的影响 [J]. 药物评价研究, 2014, 37(5): 413-416. |
| [9] | 谢 涛, 薛 洁, 朱路佳, 等. 祛栓灵胶囊对急性血瘀模型兔和大鼠血液流变学的改善研究 [J]. 现代药物与临床, 2014, 29(2): 139-142. |
| [10] | 王 奇, 陈云波, 赖世隆, 等. 血府逐瘀汤对用血瘀证兔模型血清损伤的血管内皮细胞内分泌功能的影响 [J]. 中国实验方剂学杂志, 2002, 8(2): 12-14. |
| [11] | 谢建祥, 黄 敏, 吴 锐, 等. 血瘀证目征与血管内皮细胞损伤的关系的实验研究 [J]. 中华中医药杂志, 2011, (4): 781-784. |
| [12] | 江 泳, 徐蓉娟, 李 红, 等. 血瘀证与血管内皮功能障碍的关系 [J]. 辽宁中医药大学学报, 2013, 15(6): 57-59. |
| [13] | 徐万忠, 李 思, 张 呈. 维持性血液透析患者血瘀证积分与ET、NO的相关性研究 [J]. 中医临床研究, 2013, 5(3): 1-2. |
 2015, Vol. 38
2015, Vol. 38


